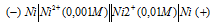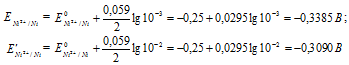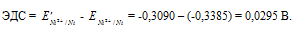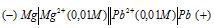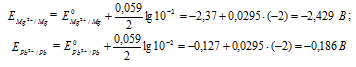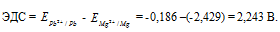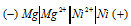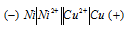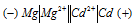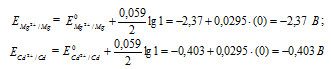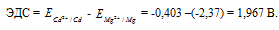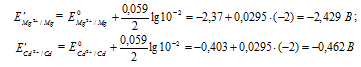Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
- Простейший гальванический элемент: схема работы
- Пластинка металла и вода: простые взаимоотношения
- Пластинка металла и раствор его соли: к чему приводит такое соседство
- Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
- Типовые задачи на схему гальванического элемента: примеры решения
- Гальванические элементы
- Как рассчитать ЭДС гальванического элемента
- Решение задач на составление схемы гальванического элемента
- 🌟 Видео
Видео:Задачи на гальванический элемент. Продукты в ОВР. Ч.5-4.Скачать

Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

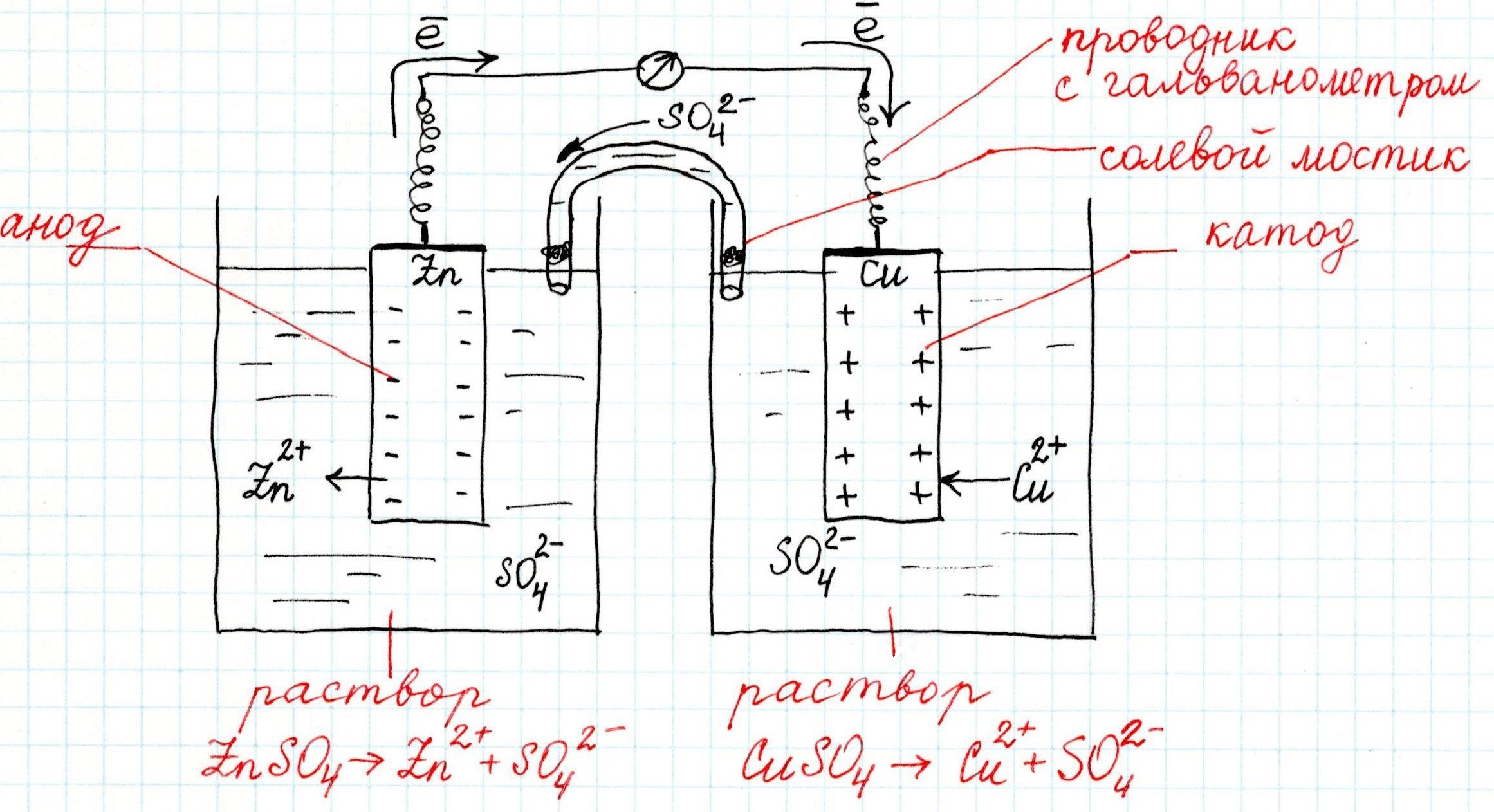
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
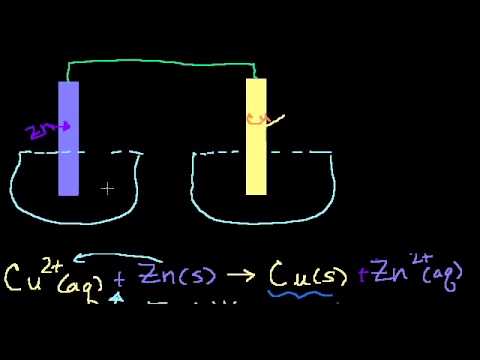
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
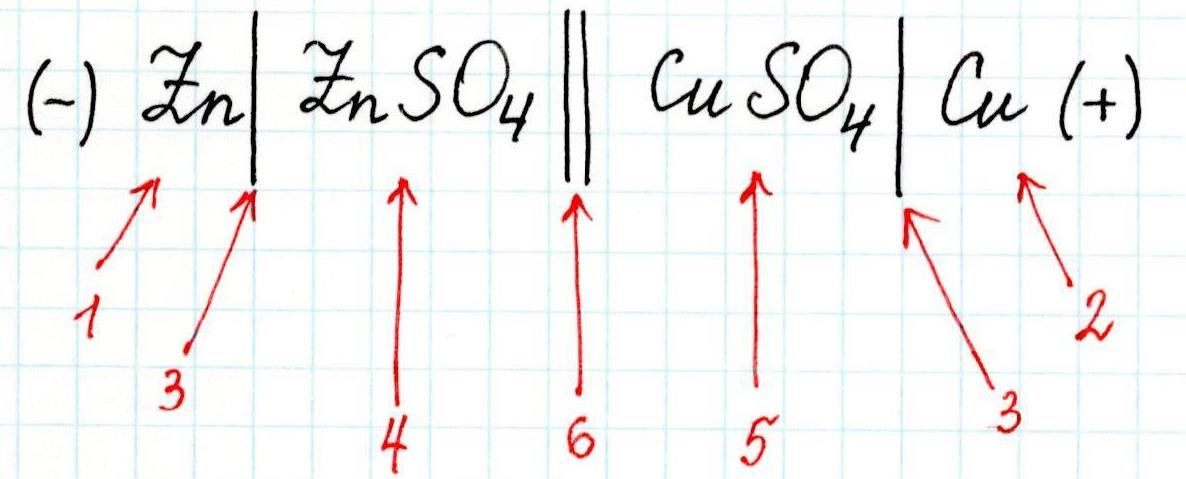
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Видео:Электроды и гальванические элементыСкачать

Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Гальванические элементы
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникнет направленное перемещение электронов – электрический ток. При этом энергия, химической окислительно-восстановительной реакции превращается в электрическую энергию. Устройства, в которых происходит такое превращение, называются химическими источниками электрической энергии, или гальваническими элементами.
Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
изображается следующим образом:
Zn | Zn(NО3)2 || AgNО 
Эта же схема может быть изображена в ионной форме:
Zn | Zn 2+ || Ag + | Ag.
В данном случае металлические электроды непосредственно участвуют в происходящей реакции. На аноде цинк окисляется Zn = Zn 2+ + 2 

и в виде металла осаждается на электроде. Складывая уравнения электродных процессов (с учетом числа принимаемых и отдаваемых электронов), получаем суммарное уравнение реакции: Zn+2Ag + = Zn 2+ + 2Ag.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой (ЭДС) элемента. Если реакция осуществляется в стандартных условиях, т. е. если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом ЭДС называется стандартной электродвижущей силой данного элемента.
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов Е, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Так, для рассмотренного выше серебряно-цинкового элемента ЭДС выражается разностью:
Здесь ЕAg и ЕZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
При вычислении электродвижущей силы меньший (в алгебраическом смысле) электродный потенциал вычитается из большего.
Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта. Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 г-ион/л, а кобальта – 0,1 г-ион/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е = Е 0 + 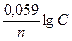
Е° для никеля и кобальта соответственно равны – 0,25 и – 0,277В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
ЕNi 2+ /Ni = – 0,25 + 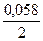
ЕCo 2+ /Co = – 0,277 + 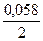
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен –2,41 В. Вычислите концентрацию ионов магния в г-ион/л.
Решение.Подобные задачи также решаются на основании уравнения Нернста:
–2,41 = –2,37 + 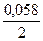
lgC = – 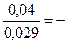
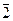
CMg 2+ = 4,17 · 10 -2 г-ион/л.
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 г-ион/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(–) Mg | Mg 2+ || Zn 2+ | Zn(+)
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (–2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg –2 
Цинк, потенциал которого –0,763В, – катод, т. е. электрод, на котором протекает восстановительный процесс:
Zn 2+ + 2 
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg + Zn 2+ = Mg 2+ + Zn
Для определения электродвижущей силы – ЭДС, гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 г-ион/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
ЭДС = 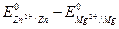
Коррозия металлов.
Методы защиты от коррозии
I
В силу широчайшего использования различных металлических конструк-ций, аппаратов, приборов коррозионный процесс наносит огромный ущерб на-родному хозяйству. Любой вопрос новой техники сейчас же вызывает необходи-мость решения проблем в области корро-зии. Защита металлов от коррозии не-возможна без знания закономерностей течения этого процесса.
К о р р о з и я — это процесс самопроизвольного разрушения металлов вследствие их взаимодействия с окружающей средой.
Свободный металл (Ме ○ ) является термодинамически неустойчивой формой по сравне-нию с ионной (Ме + n ) – ведь в природе металлы, как правило, встреча-ются не в самородном состоянии, а в виде минералов и руд (соли или оксиды ме-таллов).Этим и объясняется само-произвольное разрушение большинства метал-лов. Судить о степени термодинамической не-стабильности можно по величине стандартного электродного потенциала – чем отрицатель-нее эта величина, тем в большей степени металл будет подвержен коррозионному разруше-нию (см. таблицу).
Коррозионный процесс относится к окислительно-восстановительным и включает в себя две сопряженные реакции – окисление и восстановление, например Ме ○ + Ок ○ → Ме + n + Ок − n ,
где окисление: Ме ○ − ne → Ме + n ;
восстановление: Ок ○ + ne → Ок − n .
В зависимости от механизма протекания этих сопряженных реакций коррозия бывает химической или электрохимической.
Химическая коррозия подразумевает процесс взаимодействия металла с окружающей средой за счет гетерогенной химической реакции (атом металла непосредственно взаимо-действует с молекулой реагента и переходит в ионное состояние без переноса электрона через компактный металл). К химической коррозии относятся окисление металлов при вы-соких температурах в газовой атмосфере либо разрушение металла при его соприкоснове-нии с растворами неэлектролитов.
Электрохимическая коррозия протекает с разделением анодной (окисле-ние) и катодной (восстановление)реакций либо в пространстве (по поверхности), либо во времени (если они протекают в одной точке п оверхности). Возникает эта коррозия на границе раздела фаз «металл — электролит» и сопровождается перемещением электронов с одних участков ме-талла к другим, т.е. появлением электрического тока. К ней относят:
— атмосферную коррозию во влажной газовой или воздушной атмосфере;
— электрокоррозию под действием блуждающих токов и др.
В зависимости от характера разрушений, сопровождающих процесс элект-рохимической коррозии, различают с п л о ш н у ю коррозию, захватывающую всю поверхность металла, и м е с т н у ю, локализующуюся на отдельных участках:
— коррозия пятнами (диаметр поражения велик по сравнению с его глубиной);
— язвенная коррозия (диаметр поражения мал, велика глубина проникновения);
— питтинговая коррозия (точечное поражение, проходящее часто через всю толщу металла) и др.
Скорость коррозии может быть выражена различными способами, однако чаще пользуются весовым, глубинным и токовым показателями.
Весовой или массовый показатель скорости коррозии численно равен потере массы за единицу времени, отнесенную к единице площади:
Глубинный показатель оценивает скорость коррозии по глубине проник-новения коррозионного разрушения в толщу металла за определенный проме-жуток времени: Пгл (мм/год).
Токовый показатель — плотность тока: i (А/см 2 ).
Стандартные электродные потенциалы некоторых металлов (Е ○ ) и общая термодинамическая характеристика их коррозионной стойкости по отношению к водным растворам
| Термодинамическая стабильность металла | Металл и его электродный потенциал (Е ○ , В) |
| 1. Металлы повышенной нестабильности (неблагородные). Могут корродировать даже в нейтральных средах, не содержащих окислителей | Li (-3,045) Na (-2,714) Cr(II)(-0.913) K (-2,925) Mg (-2,370) Zn (-0,762) Ba(-2,900) Be (-1,850) Cr(III)(-0,740) Ca(-2,870) Al (-1,670) Fe(II)(-0,440) |
| 2. Металлы нестабильные. Устойчивы в ней-тральных средах при отсутствии кислорода, в кислых средах могут корродировать и в от-сутствие кислорода | Cd (-0,402) Pb (-0,126) Co (-0,277) Fe(III) (-0,037) Ni (-0,250) Sn(II) (-0,136) |
| 3. Металлы промежуточной стабильности (полублагородные). В отсутствие О2 и окис-лителей устойчивы в кислых и нейтральных средах | Sn(IV) (+0,007) Ag (+0,799) Cu(II) (+0,337) Cu(I) (+0,521) Hg(I) (+789) |
| 4. Металлы высокой стабильности (благород-ные) не корродируют в нейтральных средах при наличии О2. Могут корродировать в кислых средах при наличии О2 или окислителей | Hg(II) (+0,854) Pd (II) (+0,987) Ir (II) (+1,156) Pt (III) (+1,190) |
| 5. Металлы полной стабильности. Устойчивы в кислых средах при наличии О2 . Могут растворяться в комплексообразователях при наличии окислителей | Au (III) (+1,500) Au(I) (+1,680) |
Рассмотрим электрохимическую коррозию на примере действия серной кислоты на технический цинк, содержащий примеси железа. В этом случае на поверхности цинка возникает множество микрогальванопар, в которых цинк яв-ляется анодом (т.к. электродный потенциал цинка (-0,762 В) отрицательнее электродного потенциала железа (-0,44 В), а железо – катодом. Анодный про-цесс в этом случае – окисление цинка, катодный – восстановление окислителя, присутствующего в электролите (катионы водорода):
на аноде Zn ○ — 2e = Zn +2 ионизация цинка (окисление);
на катоде 2Н + + 2e = Н2↑ восстановление катионов водорода.
Поверхность цинка (анод) разрушается, высвободившиеся электроны перетека-ют к включениям железа (катод), на которых выделяется газообразный водород.
Помимо электрохимического растворения цинк может растворяться и в результате химического процесса: Zn ○ + 2Н + = Zn +2 + Н2↑ . Однако опыт показывает, что скорость растворения цинка в этом случае значительно ниже, чем скорость ионизации цинка как анода гальванопары. Вторичный процесс обусловлен взаимодействием образовавшихся катионов металла и кислотного остатка, присутствующего в электролите: Zn +2 + SO4 -2 =ZnSO4. Таким обра-зом протекает коррозионный процесс в кислых средах.
Течение коррозионного процесса в нейтральных средах отличается от вышерассмотренного. Например: коррозия технического железа, покрытого пленкой влаги, на воздухе или электролите с нейтральной реакцией среды. Анодный процесс аналогичен – ионизируется металл; на катоде в этом случае восстанавливаются молекулы кислорода, растворенного в воде:
на аноде Fe ○ — 2e = Fe +2 ионизация железа (окисление);
на катоде О2 + 2Н2О + 4е = 4ОН — восстановление кислорода.
Возможные вторичные процессы:
Нередко продукты коррозии оказываются малорастворимыми и своим при-сутствием на поверхности металла защищают его от дальнейшего разрушения – пассивируют металл. Это могут быть оксиды, гидроксиды, соли.
П а с с и в а ц и е й или пассивностью металла называется такое его сос-тояние, в каком он не подвергается коррозионному разрушению. Это состояние может быть достигнуто как за счет действия соответствующих окислителей, так и в случае анодной поляризации. Целый ряд металлов уже в естественных усло-виях имеет на своей поверхности оксидную пленку, которая надежно защищает от воздействия агрессивных агентов окружающей среды. Такие металлы называ-ются самопассивирующимися. К ним относятся: алюминий (с термодинамической точки зрения активный металл, но за счет поверхностной оксидной пленки коррозионностойкий), титан, ванадий, молибден, хром, никель и др.
II
Каждая шестая доменная печь работает на коррозию — таков итог действия коррозии, приводящей к разрушению конструкций, понижению качества продук ции, а также к авариям и несчастным случаям на производстве. Это наносит на-родному хозяйству огромный ущерб.
Любой метод защиты изменяет ход коррозионного процесса, уменьшая его скорость. Однако, выбирая способ защиты металла, необходимо учитывать кон-роль коррозионного процесса.
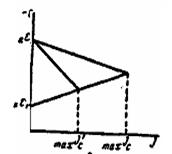
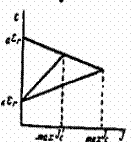
Разрушение металла — совместное протекание двух процессов: окисления (анодный процесс) и восстановления (катодный процесс) и общая скорость кор-розии определяется скоростью более медленнотекущего процесса (медленно текущая реакция называется л и м и т и р у ю щ е й). Катодный контролькоррозионного процесса имеет место, если лимитирующей является катодная реакция. Анодный контроль —если лимитирующей является анодная реак-ция. При выборе метода защиты это необходимо учитывать. Если разрушение металла протекает с анодным контролем, необходимо подобрать метод защиты усиливающий анодную поляризацию. Если разрушение металла протекает с ка-тодным контролем — метод усиливающий катодную поляризацию. Напомним, что п о л я р и з а ц и е й называется смещение потенциала электрода при протекании через систему электрического тока. Анодная поляризация — сме- щение потенциала в положительную сторону. Нижеприведенные иаграммы ил-люстрируют снижение скорости коррозии при усилении анодной (рис. 1) и катодной (рис. 2) поляризации.
Рис. 1. Анодный контроль Рис. 2. Катодный контроль
Все методы защиты условно делятся на четыре группы:
1) электрохимические методы;
2) методы, связанные с изменением свойств корродирующего металла;
3) методы, связанные с изменением свойств коррозионной среды;
4) комбинированные методы.
Электрохимические методы защиты основаны на изменении электро- химических свойств металла под действием поляризующего тока. Катодная защита применяется для повышения коррозионной стойкости металлов в ус-ловиях почвенной, морской коррозии, при контакте металла с агрессивными хи-мическими средами. Защита обеспечивается в этом случае наложением тока от внешнего источника питания (защищаемая поверхность соединяется с отрица-тельным полюсом этого источника) — на защищаемой поверхности протекают только восстановительные процессы. Протекторная защита ( частный слу-чай катодной защиты) — создание макрогальванической пары с менее благород-ным металлом-протектором. П р о т е к т о р играет роль анода и растворяется со скоростью, достаточной для создания в системе тока необходимой силы. В качестве протектора могут быть использованы цинк, алюминий, магний и их сплавы. Анодная защитаприменима к металлам и сплавам, способных пасси-вироваться при смещении их электродного потенциала в положительную сторо-ну и достижения состояния полной пассивации (здесь защищаемая поверхность соединяется с положительным полюсом внешнего источника питания). Элек-трохимические методы защиты можно использовать только в хорошо проводи- мой среде — в морской воде, почве, растворах электролитов.
Группа методов защиты,основанная на изменении свойств металлов, осуществляется либо специальной обработкой их поверхности, либо легированием. Легированиемназыва-ется введение в защищаемый металллегирующих эле-ментов, повышающих термодинамическую устойчивость анодной фазы (напри-мер: легирование стали – никелем, никеля – медью, меди – золотом и т. д.), либо содействующих пассивированию анодной фазы (легирование сталей хро-мом или кремнием, никеля – хромом). Кроме того, для увеличения коррозионной стойкости металлов широко используются различные покрытия. Предназначение защитного покрытия — создание барьерного слоя, препятствующе-го проникновению коррозионной среды к поверхности металла. Материал пок-рытия прежде всего должен обладать высокой химической устойчивостью, сла- бой проницаемостью для воды, газов, агрессивных ионов (Cl — , SO4 -2 ), хорошей адгезией к металлу, механической прочностью и др. Покрытия делятся на две группы: металлические и неметаллические. Неметаллические покрытия, в свою очередь,бывают неорганические (оксидные, солевые, силикатные, асбоце-
ментные и др.) и органические (лакокрасочные, битумные, резиновые, поли-мерные). Металлические покрытиябывают анодными и катодными. Анодное металлическое покрытие имеет место в случае нанесения на защищаемый металл другого металла с более отрицательным электродным потенциалом, например, железо (-0,44 В), покрытое цинком (-0,76 В). Катодное металли-ческое покрытие — на защищаемый металл наносят другой металл с более положительным электродным потенциалом, например, железо (-0,44 В),покртое медью (+0,345 В). Если нарушается целостность защитного металлического покрытия в процессе эксплуатации, начинают работать гальванопары. В случае анодного покрытия — разрушается металл покрытия (анод), защищаемый металл (катод) остается без изменения. В случае катодного покрытия – разрушается защищаемый металл (анод, т.к. его электродный потенциал отрицательнее по-тенциала покрытия), металл покрытия (катод) не изменяется.
Для повышения защитного эффекта часто используют системы из не-скольких покрытий: фосфатное покрытие перед нанесением лакокрасочного, цинковое покрытие с последующим фосфатированием и нанесением лака, мно- гослойные металлические покрытия, лакокрасочные покрытия с наполнителем из металлического порошка и др.
Скорость коррозии можно уменьшить также изменением свойств корро-зионной среды, в результате которой уменьшается ее агрессивность, или введением в коррозионную среду небольших добавок замедлителей коррозии — ингибиторов. Обработка среды заключается в уменьшении влажности и запы-ленности воздуха производственного помещения, деаэрировании (уменьшении концентрации кислорода) жидких сред и т. д. Ингибиторы коррозии в зависимости от условий их применения делят на летучие и жидкостные, кото-рые, в свою очередь, бывают кислотные, щелочные и нейтральные (замедля-ющие скорость коррозии соответственно в кислых, щелочных или нейтраль-ных средах). Ингибиторы широко исполь-зуются для защиты от разрушений внешних и внутренних поверхностей труб и аппаратов, в циркуляционных охла-дительных системах, коммуникационных системах, в различных емкостях для хранения жидких продуктов и др.Их большое преимущество состоит в том, что они пригодны при защите уже пораженных коррозией систем без замены мате-риала или конструкции. Механизм действия ингибиторов обусловлен их ад-сорбцией на границе раздела «металл – коррозионная среда». Защитное дейст-вие ингибитора тем больше, чем больше размер ингибирующей молекулы. Кро-ме того, защитный эффект наступает при более низких концентрациях, если мо-лекулы ингибитора полярны, чем в случае неполярных молекул. Здесь, при растворении ингибитора образуются положительно заряженные ионы. При рас-творении металла его положительно заряженные ионы переходят в раствор, а на поверхности металла скапливается избыток отрицательных зарядов. Отрица-тельно заряженная поверхность металла притягивает положительные ионы ингибитора, которые адсорбируясь блокируют дальнейшее его растворение. В настоящее время в качестве ингибиторов используются глицерин (СН2ОН-СНОН- СН2ОН), ацетальдегид (СН3СОН), анилин (С6Н6NН2), уротропин и многие другие.
Видео:Гальванический элементСкачать

Как рассчитать ЭДС гальванического элемента
Видео:Гальванические элементы. Практическая часть. 10 класс.Скачать

Решение задач на составление схемы гальванического элемента
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод — в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni 2+ , получим:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb 2+ ] = [Мg 2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема гальванического элемента
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg 0 — 2 
Свинец, потенциал которой -0,127 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Если концентрацию каждого из ионов Mg 2+ и Pb 2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 
Никель, потенциал которой -0,25 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Ni 2+ = Mg 2+ + Ni 0
б) Схема гальванического элемента, в котором никель является анодом:
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Медь, потенциал которой (+0,34 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu 2+ + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
Fe 0 → Fe 2+ + 2
На катоде серебряной пластинке будут разряжаться ионы водорода:
2Н + + 2 
(-) Fe | Fe 2+ || 2H + | H2, Ag ( + )
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg 2+ ] = [Cd 2+ ] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 — 2 
Кадмий, потенциал которой (-0,403 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
🌟 Видео
Разбор схемы гальванического элементаСкачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Электролиз. 10 класс.Скачать

Гальванические элементыСкачать
Продукты в ОВР. Ч.2-3. Гальванический элемент.Скачать

Гальванические элементы. 2 часть. 10 класс.Скачать

Коррозия металловСкачать

ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТСкачать

Покрытие серебром - простой метод гальванического серебрения (Electroplating with silver)Скачать

Гальванический карандаш Нанесение слоя золота и серебраСкачать

Строение атома. Как составить электронную и электронно-графическую формулы?Скачать

Гальванический элементСкачать

Электрохимическая коррозияСкачать