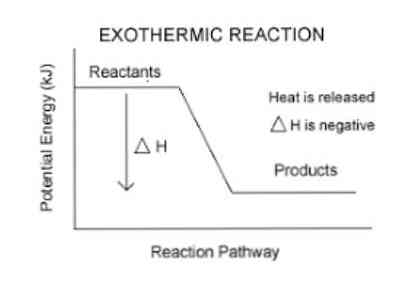
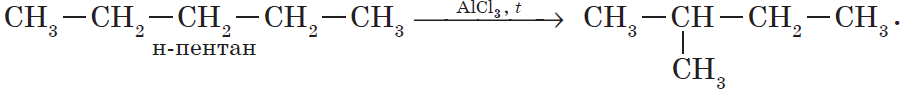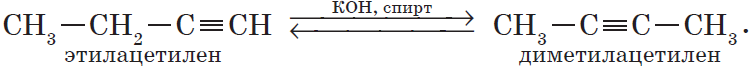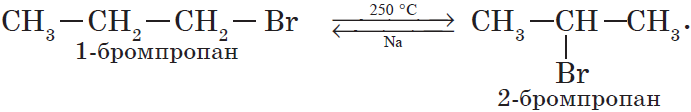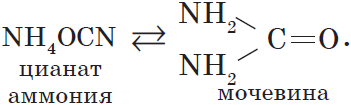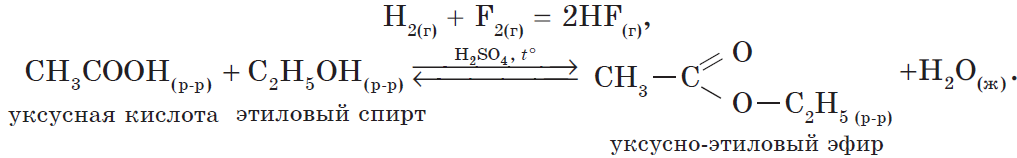экзотермическая реакция это тип химической реакции, при которой происходит передача энергии, главным образом в форме выделения тепла или света. Название происходит от греческого префикса экзо, что означает «за границей»; и термин «термический», который относится к теплу или температуре.
В этом смысле экзотермические реакции могут передавать другие виды энергии в окружающую среду, где они генерируются, например, при взрывах и способе передачи кинетической и звуковой энергии, когда вещества, находящиеся в газовой фазе при высоких температурах, расширяются. насильственный путь.
Таким же образом, в случае использования батарей, также проводится экзотермическая реакция, только в этом случае транспортируется электрическая энергия..
- 1 процесс
- 2 типа
- 2.1 Реакции горения
- 2.2 Нейтрализующие реакции
- 2.3 Реакции окисления
- 2.4 Термитная реакция
- 2.5 Реакционная полимеризация
- 2.6 Ядерная реакция деления
- 2.7 Другие реакции
- 3 примера
- 4 Ссылки
- процесс
- тип
- Реакции горения
- Реакции нейтрализации
- Реакции окисления
- Термитная реакция
- Реакция полимеризации
- Реакция ядерного деления
- Другие реакции
- примеров
- Классификация химических реакций в неорганической и органической химии
- Теория к заданию 19 из ЕГЭ по химии
- Классификация химических реакций в неорганической и органической химии
- Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
- Реакции, идущие с изменением состава вещества
- Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
- Классификация химических реакций по тепловому эффекту
- Эндотермические реакции
- Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
- Классификация химических реакций по участию катализатора
- Классификация химических реакций по направлению
- Тепловой эффект химической реакции. Термохимические уравнения
- 🔥 Видео
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

процесс
Ранее было упомянуто, что когда происходит экзотермическая реакция, происходит выделение энергии, которое можно легче визуализировать в следующем уравнении:
Реагенты (ы) → Продукт (ы) + Энергия
Таким образом, для количественного определения энергии, поглощаемой или выделяемой системой, используется термодинамический параметр, называемый энтальпией (обозначается буквой «H»). Если в системе (в данном случае, химической реакции) происходит выделение энергии в окружающую среду, то изменение энтальпии (выраженное как ΔH) будет иметь отрицательное значение.
В противном случае, если изменение этой меры является положительным, оно отражает поглощение тепла из окружающей среды. Кроме того, величина изменения энтальпии системы является выражением количества энергии, передаваемой в окружающую среду или из нее..
Чем больше величина ΔH, тем больше выделение энергии из системы в окружающую среду.
Это происходит потому, что в этих реакциях чистая энергия, которая выделяется при создании новых связей, больше, чем чистая энергия, используемая при фрагментации связей.
Из вышесказанного можно сделать вывод, что такого рода реакции очень распространены, поскольку продукты реакции имеют количество энергии, запасенное в связях, больше, чем то, что содержится в реагентах..
Видео:Видеоурок по химии "Типы химических реакций в органической химии"Скачать

тип
Существуют различные виды экзотермических реакций в различных областях химии, будь то в лаборатории или в промышленности; некоторые выполняются спонтанно, а другие требуют особых условий или какого-либо типа вещества, такого как катализатор, который будет произведен.
Ниже приведены наиболее важные виды экзотермических реакций:
Реакции горения
Реакции горения представляют собой реакции окислительно-восстановительного типа, которые происходят, когда одно или несколько веществ вступают в реакцию с кислородом, обычно приводя к выделению света и тепловой энергии, то есть света и тепла, когда возникает пламя..
Реакции нейтрализации
Реакции нейтрализации характеризуются взаимодействием между кислотой и щелочным веществом (основанием) с образованием соли и воды, которые проявляют экзотермическую природу..
Реакции окисления
Существует много реакций такого типа, которые демонстрируют экзотермическое поведение, потому что окисление кислорода вызывает выделение большого количества энергии, как это происходит при окислении углеводородов..
Термитная реакция
Эта реакция может давать температуру около 3000 ° C, и из-за высокого сродства алюминиевого порошка с большим количеством оксидов металлов его используют при сварке стали и железа.
Реакция полимеризации
Этот тип реакции возникает тогда, когда реагирует определенное количество химических веществ, называемых мономерами, которые представляют собой единицы, которые при объединении повторяются в цепочках с образованием макромолекулярных структур, называемых полимерами..
Реакция ядерного деления
Этот процесс относится к разделению ядра атома, считающегося тяжелым, то есть с массовым числом (А), превышающим 200, для получения фрагментов или ядер меньшего размера с промежуточной массой..
В этой реакции, где образуются один или несколько нейтронов, выделяется большое количество энергии, потому что ядро с большим весом имеет более низкую стабильность, чем его продукты..
Другие реакции
Существуют также другие экзотермические реакции, имеющие большое значение, такие как обезвоживание некоторых углеводов при взаимодействии с серной кислотой, поглощение воды, в которой гидроксид натрия находится на открытом воздухе, или окисление металлических частиц во многих реакциях коррозии..
Видео:ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

примеров
Ниже приведены некоторые примеры экзотермических реакций, которые вызывают изменение энтальпии, которое имеет отрицательное значение из-за того, что они выделяют энергию, как упомянуто выше..
Например, сгорание пропана является спонтанной экзотермической реакцией:
Другой случай экзотермического поведения показан реакцией нейтрализации между карбонатом натрия и соляной кислотой:
Представлено также окисление этанола в уксусную кислоту, используемое в алкотестерах, полная реакция которых показана в следующем уравнении:
Другим классом экзотермической реакции является так называемая термитная реакция, в которой алюминий объединяется с оксидом металла, как показано ниже:
В дополнение к объясненным выше примерам существует множество различных реакций, которые также считаются экзотермическими, такие как разложение определенных органических отходов для компостирования..
Это также подчеркивает окисление люциферинового пигмента под действием фермента люциферазы, чтобы произвести биолюминесценцию, характерную для светлячков, и даже дыхание, среди многих других реакций.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Классификация химических реакций в неорганической и органической химии
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
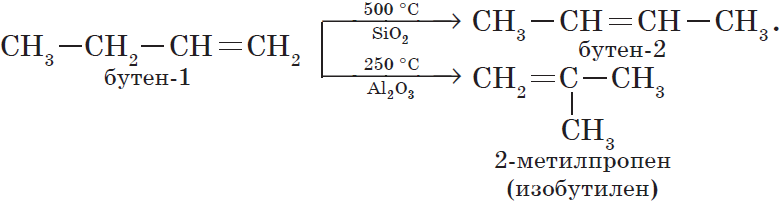
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2↖2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO↖2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3↖2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4↖K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
3) реакция крекинга (расщепления) пропана:
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
или в ионном виде:
2) реакция между щелочью и солью, идущая с образованием газа:
или в ионном виде:
3) реакция между щелочью и солью, идущая с образованием осадка:
или в ионном виде:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
- многие реакции разложения:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
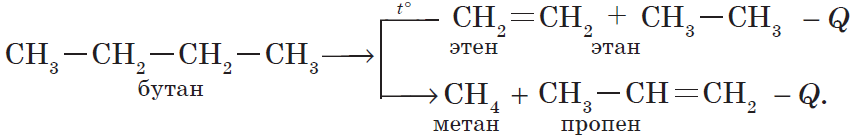
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
🔥 Видео
Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Все типы химических реакций на ОГЭ по химии | Это попадется на экзамене | Химия ОГЭ 2023 | УмскулСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химия 11 класс (Урок№5 - Классификация химических реакций.)Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Экзотермический процессСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Классификация химических реакций в органической химииСкачать

Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Все типы неорганических реакций | Химия с Юлией ВишневскойСкачать