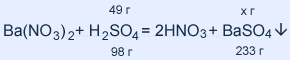- Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
- Зачем нужны ионные уравнения
- Алгоритм написания ионных уравнений
- Как составить молекулярное уравнение реакции
- Как превратить молекулярное уравнение в полное ионное уравнение
- В виде ионов записывают:
- В виде молекул записывают:
- Окислительно восстановительные реакции
- Взаимосвязь между отдельными классами неорганических соединений
- Окислительно восстановительные реакции ОВР
- Электролиз , как окислительно-восстановительный процесс
- Допишите уравнения следующих процессов образования ионов ca 2e fe s fe
- 🔍 Видео
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Видео:Как решать 1 задание из ЕГЭ по химии "Электронная конфигурация атома"Скачать

Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Окислительно восстановительные реакции
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Взаимосвязь между отдельными классами неорганических соединений

Металлы → Основные окислы → Гидроокиси → Соли
Неметаллы → Кислотные окислы → Кислоты → Соли
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Окислительно восстановительные реакции ОВР
Что такое ОВР — это химические реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, входящих в состав реагирующих веществ.
Значительная часть химических реакций, с которыми до сих пор нам приходилось иметь дело, была так называемого обменного типа, т. е. молекулы сложных веществ в процессе реакции обменивались своими составными частями. Например:
AgNO3 + NaCl = AgCl + NaNO3
или в ионном виде
Ag + + NO3 — + Na + + Cl — = AgCl + Na + + NO3 —
В таких реакциях величина валентности каждого атома или, как правильнее говорить в этом случае, величина степени окисления каждого атома остается неизменной. В отличие от валентности понятие степень окисления более условное, формальное. При ее определении мы предполагаем, что все атомы в молекуле соединены друг с другом ионными связями и, в зависимости от значения электроотрицательности, имеют либо положительный, либо отрицательный заряд. Например, атом водорода обычно бывает электроположительным, его степень окисления + 1, кислород всегда в соединениях имеет отрицательный заряд —2 и т. д. Это и является их степенями окисления. Для подсчета степени окисления каждого элемента, например азота в азотной кислоте HNO3, надо исходить из того, что всякая молекула в целом всегда электронейтральна.
Расставим над знаками водорода и кислорода значение их степеней окисления: HNО3(+1 -2). Теперь рассчитаем, какой должна быть степень окисления азота. В молекуле три атома кислорода, каждый имеет степень окисления —2. Следовательно, общее число отрицательных зарядов —2 х 3 = —6. Атом водорода со степенью окисления +1 только один. Следовательно, отрицательных зарядов оказывается на 5 больше, чем положительных. Этот избыток отрицательных зарядов должен быть уравновешен зарядом атома азота, который равен этому избытку по абсолютной величине, но противоположен по знаку, т. е.
степень окисления азота равна +5: HNО3(+ 1+5—2). Таким образом, в молекуле оказывается 6 положительных и 6 отрицательных зарядов, вследствие чего она электронейтральна.
■ 130. Определите степень окисления элементов в следующих соединениях: H2SO4, KNО3, H2SO3, H2S, FeSO4, CaSiO3. (См. Ответ)
Если требуется определить степени окисления элементов в солях более сложного состава, например в молекуле фосфата кальция Са3(РО4)2, то поступают следующим образом. Для определения степени окисления центрального атома фосфора пишут формулу кислоты, соль которой рассматривается (Н3РО4), и по ней определяют степень окисления фосфора: Н3РО4(+ 1 +5-2) . В солях фосфорной кислоты (как и других кислот) степень окисления фосфора (как и всякого центрального атома) та же, что и в самой кислоте. Степень окисления кальция (или другого металла) в составе соли определить несложно, она равна его валентности.
■ 131. Определите степени окисления элементов в следующих соединениях: сульфат железа (III), нитрат алюминия, сульфат магния, фосфат бария, карбонат натрия, силикат алюминия. (См. Ответ)
При окислительно-восстановительных процессах степень окисления элементов до и после реакции меняется. Поэтому в отличие от обменных реакций, которые называются электростатическими из-за того, что степень окисления элементов в них постоянна, окислительно-восстановительные реакции называют электродинамическими.
Для окислительно-восстановительных реакций составление уравнений сложнее. Их составляют на основе так называемого электронного баланса. Для этого условно считают, что всякое изменение степени окисления элемента связано с отдачей или принятием определённого числа электронов. Процесс отдачи электронов называют окислением, а принятия— восстановлением. Следовательно, атом или ион, которые отдают электроны, окисляются и одновременно являются восстановителями. Если атом или ион принимают электроны, то они восстанавливаются и одновременно являются окислителями. Окисление и восстановление — это две стороны одного процесса, они всегда протекают одновременно и не могут существовать независимо друг от друга. Для того чтобы атом отдал электроны, обязательно должен существовать другой атом, который у него эти электроны примет. Необходимо также знать, что в окислительно-восстановительных процессах число отданных электронов всегда равно числу принятых.
Всегда следует помнить, что при химических реакциях может изменяться только число электронов в атоме. Число положительных зарядов в ядре всегда остается неизменным. В нейтральном атоме электроны всегда полностью уравновешивают положительный заряд ядра. Если атом теряет часть своих электронов, то столько же положительных зарядов в ядре остаются неуравновешенными. Тогда и возникает положительная степень окисления. Например, если нейтральный атом алюминия отдаст 3 электрона, то три положительных заряда ядра при этом останутся неуравновешенными. Следовательно, атом перестает быть электронейтральным. Его заряд равен +3, т. е. степень окисления становится Аl(+3).
■ 132. Сколько электронов отдано атомами при следующих превращениях:
а) Cu 0 — ? e — → Cu +2
б) Fe 0 — ? e — → Fe +3
в) S 0 — ? е — → S +6
г) N 0 — ? е — →N +2
Какой процесс — окисление или восстановление — при этом происходит? (См. Ответ)
Если нейтральный атом принимает дополнительно к 1 своим еще несколько электронов, то у него появляется избыточный отрицательный заряд (отрицательная сте- I пень окисления), равный числу принятых электронов. 1 Например, если нейтральный атом серы примет два электрона, то они придадут ему заряд —2, т. е. степень окисления становится S -2 .
■ 133. Сколько электронов принято атомами при следующих превращениях:
а) N 0 + ? e — → N -3
б) Cl 0 + ? e — → Cl -1
в) С 0 + ? e — →С -4
г) О 0 + ? e — → О -2
Какой процесс — окисление или восстановление — при этом происходит? (См. Ответ)
Если уже имеется положительная степень окисления, то отдача или принятие электронов ее соответственно 1 изменяют. Например, если в процессе реакции степень окисления марганца изменилась с Мn +7 до Мn +4 , то это значит, что атом марганца принял три электрона, они урав-новесили три положительных заряда марганца, а четыре остались неуравновешенными. Происходит процесс восстановления.
Таким образом, процесс восстановления всегда сопровождается понижением степени окисления. (Запишите это правило.)
■ 134. Сколько электронов принято атомами при следующих превращениях:
а) Мn+4 + ? e — → Mn +2
б) Cr +6 + ? e — → Cr +3
в) Fe +3 + ? e — → Fe +2
г) Cu +2 + ? e — → Cu 0
д) Ag +1 + ? e — → Ag 0 (См. Ответ)
В другом случае, когда степень окисления хрома меняется от Сr +3 до Сr +6 , это значит, что Сr +3 , имея три неуравновешенных положительных заряда, отдал три электрона, и теперь неуравновешенными оказались 6 положительных зарядов. Произошел процесс окисления.
Другими словами, возрастание величин степени окисления свидетельствует о том, что происходит процесс окисления. (Запишите.)
■ 135. Сколько электронов отдано атомами при следующих превращениях:
а) S -2 — ? e — → S 0 ;
б) S-2 — ? e — → S +6 ;
в) Мn +2 — ? e — → Мn +6
г) Мn +2 — ? e — → Мn +7
д) N +2 — ? e — → N +5 (См. Ответ)
Если обозначить схематически связь величины степени окисления с окислительно-восстановительными процессами, то схема будет выглядеть следующим образом:
Окисление
→
возрастание степени окисления
(отдача электронов)
Восстановление
←
убывание степени окисления
(принятие электронов)
В отдельных случаях изменение степени окисления бывает столь значительным, что она переходит из положительной в отрицательную или наоборот. Например, сера может изменить степень окисления с S +6 до S -2 . В этом случае сера принимает 8 электронов: 6 уравновешивающих положительный заряд и еще 2, придающих избыточный отрицательный заряд. Происходит восстановление. Или наоборот: азот из степени окисления N -3 может перейти в N +2 . В этом случае происходит отдача 5 электронов: атом азота отдает 3 избыточных электрона и еще 2, уравновешивающих два положительных заряда ядра.
■ 136. Как меняется число электронов в атомах при следующих изменениях степеней окисления:
а) N +2 → N -3
б) S +4 → S -2
в) S +6 → S +4
г) S-2 → S +6
д) N -3 → N +5
е) N +4 → N +2
ж) Mn +4 → Mn +7 (См. Ответ)
В каких из приведенных случаев происходит окисление, а в каких восстановление?
Учтя сказанное, можно перейти к составлению уравнений окислительно-восстановительных реакций. Как и во всех случаях составления уравнения реакции, для написания уравнения окислительно-восстановительных реакций необходимо знать исходные вещества и полученные продукты. Исходные вещества обычно даются, а полученные вещества определяют, исходя из условий реакции, на основе знания свойств элементов.
Сначала научимся составлять уравнения окислительно-восстановительных реакций с заранее известными продуктами. Рассмотрим схему реакции:
H2SО3 + Вr2 → H2SO4 + HBr
(Запишите)
1. Прежде всего необходимо над каждым элементом расставить степень окисления (Запишите).
После расстановки степеней окисления схема будет иметь следующий вид:
2. Затем следует найти и подчеркнуть элементы, меняющие степень окисления (Запишите). Следует помнить, что в молекулах простых веществ степень окисления атомов равна нулю.
3. Затем следует разобраться, какой элемент окисляется, какой восстанавливается и сколько при этом отдается и принимается электронов (Запишите). Это означает, что атом серы со степенью окисления S +4 отдал 2 электрона и превратился в S +6 , т. е. сера является восстановителем. Записывается это следующим образом:
S +4 — 2е — → S +6
Атом брома принял один электрон, так как был нейтральным, а после реакции приобрел степень окисления —1. Схематически это изображается так:
Вr 0 + е — → Br -1
Бром является окислителем, но поскольку молекула брома состоит из двух атомов, а электроны принимаются
обоими атомами, схема видоизменяется:
2Вr 0 +2е — → 2Вr -1
Соединим схемы отдачи и принятия электронов и рассмотрим полученный электронный баланс:
S +4 — 2e — → S +6
2Вr 0 + 2е — → 2Вr -1
(Запишите)
Количество отданных электронов должно быть равно количеству принятых. Их нужно уравнять, но наше уравнение не требует особого уравнивания, за исключением количества атомов брома. Поскольку мы вели расчет- на двухатомную молекулу, а в правой части равенства в молекуле НВr только один атом брома, то перед НВr необходимо поставить коэффициент 2:
Если реакция протекает в растворе, то в ней может принять участие и вода. Мы видим, что в левой части равенства имеется два атома водорода, а в правой четыре. Следовательно, нужно добавить к левой части уравнения молекулу воды. Уравнение примет следующий вид:
Количество атомов кислорода в левой и правой частях равенства тоже должно совпадать. Подсчетом числа атомов кислорода в левой и в правой частях равенства производится проверка равнениям Уравнение данной реакции является весьма простым, оно не требует сложной расстановки коэффициентов.
Однако могут быть случаи, когда приходится рассчитывать довольно сложные коэффициенты, например:
После расстановки степеней окисления обнаруживаем, что они меняются у серы и азота. Составляем электронный баланс.
Дополнительные множители для азота 40, для серы 3. Проставляем в уравнении коэффициенты для окислителя и восстановителя:
3As2S6 + 40HNO3 → H3AsО4 + 40NO + 15H2SО4
Подсчитываем количество атомов мышьяка:
3As2S6 + 4OHNO3 → 6Н3АsO4 + 40NO + 15H2SO4
В левой части равенство 40 атомов водорода, а в правой — 48. Следовательно, в левую часть следует поме стить еще 4 молекулы воды.
4Н2О + 3As2S6 + 40НNO3 → 6H3AsO4 + 40NO + 15H2SO4
Проверка подсчетом числа кислородных атомов показывает, что как в левой, так и в правой части по 124 атома кислорода.
Могут быть случаи, когда для протекания реакции требуется создать определенную среду, обусловливающую поведение окислителя и восстановителя. Примером может служить уравнение окислительно-восстановительной реакции, протекающей между хлоридом натрия и пермангана-том калия в кислой среде. Кислая среда обычно создается серной кислотой как наиболее устойчивой.
NaCl + KMnO4 + H2SO4 → Na2SO4 + K2SO4 + MnSO4 + Cl2
После определения степеней окисления схема будет иметь следующий вид:
Марганец меняет степень окисления от Мn +7 до Мn +2 , следовательно, принимает 5 электронов:
Mn +7 + 5e — → Мn +2
Следовательно, марганец восстанавливается и является окислителем.
Атом хлора отдает электрон и становится нейтральным.
Поскольку нейтральные атомы хлора соединяются в молекулу, состоящую из двух атомов хлора, схема изменится следующим образом:
Cl -1 — 2e — → Cl 0
Хлор окисляется и является восстановителем. Рассмотрим полученный электронный баланс:
Уравняем количество электронов, найдя для них наименьшее общее кратное и дополнительные множители. Наименьшим общим кратным является 10. Дополнительные множители для марганца —2 и для хлора—5. Они и будут основными коэффициентами для окислителя и восстановителя. Расставляем их и получаем следующую схему.
10NaCl + 2KMnО4 + H2SО4 → Na2SО4 + K2SО4 + 2MnSО4 + 5Cl2
Коэффициент 5, найденный для хлора, вычисляют, исходя из двухатомной молекулы хлора. Поэтому в левой части равенства, где хлора один атом в молекуле NaCl, ставят коэффициент 10, а не 5. Исходя из полученных коэффициентов, путем простых арифметических подсчетов находят и расставляют остальные коэффициенты и количество молекул воды. В результате получается следующее уравнение:
10NaCl + 2КМnO4 + 8H2SO4 → 5Na2SO4 + K2SO4 + 2MnSO4 + 5Сl2 + 8Н2O
Рассмотренная окислительно-восстановительная реакция протекает фактически между двумя; веществами: перманганатом и поваренной солью. Какую же роль играет серная кислота? Всякая реакция может протекать лишь в том случае, если для нее создается определенная благоприятная среда — кислая, щелочная или нейтраль-ная. Есть реакции, которые протекают только в кислой среде, а есть реакции, протекающие только в щелочной среде. Кислая среда чаще всего создается серной кислотой как наиболее устойчивой, а щелочная — едким натром NaOH или едким кали КОН. В данной реакции, которая протекает в кислой среде, серная кислота играет роль среды. Кроме того, поскольку серная кислота в результате реакции образует сернокислые соли металлов, участвующих в реакции, ее называют также солеобразователем.
■ 137. Напишите уравнения следующих реакции, протекающих в кислой среде:
а) К2Cr2O7 + KI + H2SO4 → Cr2(SО4)3 + I2 + K2SO4
б) NaNO3 + NaI + H2SO4 → NO + I2 + Na2SO4
в) KBrO3 + NaCl + H2SO4 → Cl2 + KBr + Na2SO4
г) K2CrO7 + FeSO4 + H2SO4 → Cr(SO4)3 + Cr(SO4)3 + Fe2(SO4)3 + K2SO4
д) NaN2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 (См. Ответ)
Рассмотрим еще один пример, где окислитель является одновременно и средой, а именно взаимодействие азотной кислоты с медью:
Сu + HNO3 → Cu(NO3)2 + NO
Сначала определим степень окисления элементов:
Затем найдем элементы, меняющие степень окисления. Здесь мы видим, что не весь азот азотной кислоты меняет степень окисления, а только часть его. Некоторое количество атомов азота остается со степенью окисления +5. Составим электронный баланс:
Здесь мы учитываем лишь те атомы азота, которые меняют степень окисления. Находим дополнительные множители, с их учетом схема приобретает следующий вид:
3Cu + 2HNO3 → 3Cu(NO3)2 + 2NO
Однако в этой схеме учтен лишь расход азота как окислителя. Нужно учесть еще азот, израсходованный на образование 3 молекул нитрата меди 3 Cu(NO3)2. Для этого нужно еще 6 атомов азота. Следовательно, перед формулой азотной кислоты нам следует поставить коэффициент 8:
3Cu + 8HNO3 → 3Сu(NO3)2 + 2NO
Теперь определим количество молекул воды в правой части равенства по числу водородных атомов:
3Cu + 8HNО3 → 3Cu(NО3)2 + 2NO + 4Н2О
Проверка равенства подсчетом кислородных атомов показывает, что равенство справедливо.
■ 138. Составьте уравнения окислительно-восстановительных реакций:
а) Zn + HNO3 → Zn(NО3)2 + N2
б) Sn + HNO3 → Sn(NО3)2 + N2O;
в) Cu + HNO3 → Cu(NО3)2 + NO2;
г) KMnО4 + HCl → MnCl2 + Cl2 + KCl;
д) K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 (См. Ответ)
Окислительно-восстановительные реакции, как уже сказано, могут протекать и в щелочной среде, например:
Na2SO3 + Cl2 + NaOH → NaCl + Na2SO4
Определяем степени окисления атомов элементов в уравнении и находим те, у которых степень окисления меняется:
Составляем электронный баланс:
Электронный баланс показывает, что S+4 в данной реакции является восстановителем, а Сl0— окислителем. Поскольку коэффициентов перед окислителем и восстановителем не требуется, следует поставить коэффициент 2 лишь перед формулой NaCl, так как в электронном балансе учитывался хлор в молекуле Сl2:
Na2SO3 + Cl2 + NaOH → 2NaCl + Na2SO4
После этого рассчитываем по числу атомов натрия расход молекул едкого натра:
Na2SO3 + Cl2 + 2NaOH → 2NaCl + Na2SO4
Наконец, учитываем число образовавшихся молекул воды:
Na2SO3 + Cl2 + 2NаOH = 2NaCl + Na2SO4+ H2O
Таким образом, щелочь в окислительно-восстановительной реакции посредством входящего в ее состав атома щелочного металла связывает все образующиеся в процессе реакции анионы в соли этого металла.
■ 139. Расставьте коэффициенты в следующих уравнениях:
а) МnО2 + КClO3 + КОН → К2МnO44 + KCl;
б) КСrО2 + РbО2 + КОН → К2СrO4 + К2РbО2;
в) Cr2(SO4)3 + NaOH + Сl2 → NaCl + Na2CrO4 + Na2SO4;
г) MnCl2 + КBrO + КОН → MnO2 + КВr. (См. Ответ)
Особого внимания заслуживают окислительно-восстановительные реакции, протекающие с участием перекиси водорода, которая довольно широко применяется в химии, в частности и в аналитической.
Перекись водорода в зависимости от условий может вести себя как окислитель или как восстановитель. При составлении электронного баланса получается, что степень окисления каждого кислородного атома в перекиси водорода равна —1, что не совпадаете величиной валентности кислорода, которую он в действительности проявляет в этом соединении. Если два атома кислорода, входящие в состав перекиси водорода, примут еще по одному электрону, то получаются атомы кислорода с обычной степенью окисления —2. В этом случае перекинь водорода проявляет свойства окислителя. Однако электроны могут быть отданы и тогда образуется нейтральный кислород. В этом случае перекись водорода функционирует как восстановитель. Рассмотрим оба случая.
Ясно, что в этом случае перекись водорода проявляет восстановительные свойства.
В расставляем коэффициенты у окислителя и восстановителя:
Н2О2 + 2КМnO4 + КОН → 2K2MnO4 + Н2О + О2
По числу атомов калия определяем число молекул щелочи, пошедшее на реакцию, а затем определяем и число молекул воды:
Н2О2 + 2КМnO4 + 2КОН → 2К2МnO4 + 2Н2О + О2
Составим электронный баланс, из которого явствует, что перекись водорода в данном случае является окис-ль:
Расставляем коэффициенты для окислителя и восстановителя:
2КI + H2O2 + H2SO4 = I + 2Н2O + K2SO4
Проверив уравнение подсчетом числа кислородных атомов в левой и правой частях равенства, убеждаемся, что оно справедливо.
■ 140. Расставьте коэффициенты в следующих уравнениях:
а) СrСl3 + Н2O2 + КОН → К2СrO4 + КСl + Н2O
б) H2S + Н2O2 → H2SO4 + Н2O
в) I2 + H2O2 → HIO3 + H2O
г) HIO3 + H2O2 → I2 + O2
д) H2O2 + HClO → HCl + O2 (См. Ответ)
Однако научиться находить коэффициенты в уравнениях окислительно-восстановительных реакциях — еще не значит уметь их составлять. Нужно знать поведение веществ в окислительно-восстановительных реакциях. Необходимо уметь предусмотреть ход реакций,mопределять состав образующихся продуктов в зависимости от условий реакции.
Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких — как восстановители, нужно обратиться к периодической системе элементов Д. И. Менделеева.
Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус, небольшое число (1—3) электронов на внешнем слое и в связи с этим могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп периодической системы, например натрий, калий, кальций и др.
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI — VII группы например фтор, хлор, бром, кислород, сера и др. Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявить восстановительные свойства.
Элементы в разных степенях окисления могут вести себя по-разному. Элементы в высшей положительной степени окисления не могут проявлять восстановительных свойств, а проявляют только окислительные. Например: N(+5) (HNO3, КNO3 и др.), Cl(+7) (HClO4),S(+6)(H2SO4) и т. д.
С точки зрения понятия «степень окисления» это объяснить несложно. У атомов элементов в высшей степени окисления с внешнего слоя как бы отдано максимальное число электронов; больше они отдать не могут, могут лишь принимать.
На внешнем электронном слое у N(+5). электроны отсутствуют.
Элементы в отрицательных степенях окисления, наоборот, имеют максимально завершенный внешний электронный слой. Например: S(+16) 2, 8, 6 и S(+16) 2, 8, 8. При рассмотрении внешнего электронного слоя атома серы мы видим, что он максимально завершен. Следовательно, атом S(-2) больше электронов принимать не может, а может лишь отдавать. Это говорит о том, что S(-2) может проявлять лишь восстановительные свойства, а окислительных — не может.
Элементы в не максимальных положительных степенях окисления, имеющие некоторое число электронов на внешнем слое, могут как отдавать, так и принимать электроны и, следовательно, вести себя как окислитель и как восстановитель в зависимости от условий. Например: N, S, имеющие, соответственно, структуры N(+7) 2,2 и S(+16) 2, 8, 2, попадая вереду, где присутствует сильный окислитель, ведут себя как восстановители. И наоборот, в восстановительной среде они ведут себя как окислители.
■ 141. Составьте уравнения следующих окислительно-восстановительных реакций, если известны конечные степени окисления элементов:
а) С + HNO3 → (C +4 ; N +2 )
б) Р + HNO3 → (P +5 ;N +2 )
в) РН3 + KMnO4 + H2SO4 → (Mn +2 ; P +5 ) (См. Ответ)
Грамм-эквивалент окислителя или восстановителя вычисляется делением моля на число отданных или принятых электронов.
Видео:Решение цепочек превращений по химииСкачать

Электролиз , как окислительно-восстановительный процесс
Окислительно-восстановительные реакции могут происходить и при участии электрического тока.
Например, если расплавить поваренную соль, то происходит расщепление кристаллической решетки на ионы:
2NaCl ⇄ Na+ + Cl-
При этом образуются катион натрия и анион хлора. Если затем опустить в расплав электроды постоянного электрического тока, происходит следующее. Направляясь к катоду, катион натрия получает с него один электрон, т. е. происходит восстановление:
Na + + e — →Na 0
Следовательно, катод, на котором имеется постоянный избыток электронов, является восстановителем. К аноду направляется анион хлора. Поскольку на аноде постоянный недостаток электронов, атом хлора отдает электрон, т. е. окисляется: Сl — — е — → Сl 0
Таким образом, а н о д, на котором постоянный недостаток электронов, является окислителем. Итак, всякий электролиз есть окислительно-восстановительный процесс, протекающий под действием электрического тока.
(Запишите)
В связи с тем что при электролизе в реакции принимает участие электрический ток, окислительно-восстановительный процесс приобретает ряд особенностей. Например, при электролизе водных растворов солей в процессе принимает участие вода. Так, электролиз раствора поваренной соли протекает по несколько иной схеме, нежели электролиз расплава. В растворе, помимо диссоциации, соли, протекает весьма слабо диссоциация воды:
Н2O ⇄ Н + + OH —
Таким образом, в растворе образуется два вида катионов (Na + и Н + ) и два вида анионов (Сl — и ОН — ).
В ряду напряжений металлов натрий стоит намного левее водорода. Следовательно, он активнее, а значит, и легче отдает электроны. Если же речь идет (как в данном случае) о принятии электронов на катоде, то ион натрия, наоборот, будет труднее принимать электроны, чем ион водорода, и, следовательно, на катоде будет восстанавливаться не металлический натрий, а водород:
Н + + е — → Н (0)
Ионы же натрия будут находиться в растворе до тех пор, пока полностью не разрядятся ионы водорода.
К аноду направятся анионы Сl — и ОН — . Эти анионы также неодинаковы. Анион Сl — легче отдает свой электрон, чем анион ОН-, поэтому на аноде будет окисляться хлор, превращаясь в нейтральные атомы хлора:
Сl — — е — → Сl 0
В большинстве случаев анионы, состоящие из атомов одного элемента, такие, как Сl — , Вr — , I — , S 2- и т. п., окисляются на аноде быстрее, чем гидроксильная группа.
Таким образом, при электролизе раствора поваренной соли на электродах получаются водород и хлор, а в растворе остаются ионы Na + и ОН — . Эти ионы представляют собой в диссоциированном виде едкий натр NaOH.
■ 142. Почему при электролизе расплава NaCl можно получить металлический натрий, а при электролизе раствора NaCl era получить нельзя?
143. Чем объяснить, что в растворе при электролизе NaCl образуется щелочь NaOH?
144. Как осуществляется электролиз раствора KI?
145. В чем отличие процесса электролиза раствора СuСl2 от электролиза раствор а NaCl? (См. Ответ)
Если электролизу подвергается раствор сульфата натрия Na2SO4, который диссоциирует по уравнению:
Na2SO4 ⇄ 2Na + + SO 2 4
то в растворе образуется опять-таки два вида катионов (Na+ и Н+) и два вида анионов (SO42- и ОН-).
В этом случае, как и в предыдущем, на катоде происходит восстановление водорода Н+ + е—> Н0, а на
аноде — окисление гидроксила, так как сложные анионы (SO 2 4 — NO3 — и т. п.) окисляются с большим трудом (стр. 395. табл. 5). На аноде идет процесс
2OН — — 2е — → [2OН] → Н2О + [О] ↑
и выделяется чистый кислород. Таким образом, процесс фактически сводится к электролизу воды, а соль в неизменном количестве остается в растворе.
Процесс электролиза широко применяется в ряде производств, частности, это единственный экономически выгодный промышленный путь получения активных металлов, таких, как калий, натрий, алюминий, а также активных неметаллов, например хлора, фтора и т. п.
Электролиз широко применяется при покрытии одного металла другим для защиты от коррозии. Например, при никелировании, хромировании и т. д. покрываемое изделие помещают в ванну с раствором никеля или хрома, подключают к катоду и ждут, когда на нем появится слой металла нужной толщины. Скорость протекания процесса зависит от силы и напряжения тока, а также от ряда других причин, зная которые, можно вычислить количество образующегося металла.
Способ наращивания металла на поверхности изделия электролитическим путем позволяет снимать точнейшие слепки и копии. Этот способ называется гальванопластикой.
Статья на тему Окислительно восстановительные реакции
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Допишите уравнения следующих процессов образования ионов ca 2e fe s fe

Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.

Ca(NO3)2 = Ca 2+ + 2NO3 − нитрат кльция
Na3PO4 = 3Na + + PO4 3− фосфат натрия
Кислые соли
Ca(HSO4)2 = Ca 2+ + 2HSO4 − гидросульфат кальция
NaH2PO4 = Na + + H2PO4 − дигидрофосфат натрия
Основные соли
(CaOH)2SO4 = 2CaOH + + SO4 2− гидроксосульфат кальция
MgOHNO3 = MgOH + + NO3 − гидроксонитрат магния

а) HCl + Na2SO4 →
б) H3PO4 + CaCl2 →
в) FeCl3 + AgNO3 →
г) KNO3 + NaCl →
д) NaOH+ FeS →
е) KOH + Al2(SO4)3 →
ж) Ca + CuCl2 →
з) Cu + AgNO3 →
и) Mg + ZnS →
к) Cu + Fe(NO3)2 →
Если реакция не может быть осуществлена, объясните почему.

а) 2HCl + Na2SO4 = H2SO4 + 2NaCL 2H + +2Cl − + 2Na + + SO4 2− = 2H + + SO4 2− + 2Na + + 2Cl −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
г) KNO3 + NaCl = KCl + NaNO3 K + + 2NO 3 − + Na + + Cl − = K + + Cl − + Na + + NO 3 −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
ж) Cu + CuCl2 = CaCl2 + Cu
Ca 0 + Cu 2+ + 2Cl − = Ca 2+ + 2Cl − + Cu 0
Ca 0 + Cu 2+ = Ca 2+ + Cu 0
з) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu 0 + 2Ag + + 2NO 3 − = Cu 2+ + 2 NO 3 − + 2Ag 0
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
и) Mg + ZnS ≠ MgS + Zn Реакция не идет т.к. ZnS и MgS нерастворимые соли
к) Cu + Fe(NO3)2 ≠ Реакция не идет т.к. в электрохимическом ряду напряжений Cu расположена правее Fe и не может вытеснять железо из его солей

| Дано: H2SO4, Ba(NO3)2 mр-ра= 980 г ω( H2SO4) = 0,05 mосад. =? | Решение: m(H2SO4) = mр-ра • ω( H2SO4) = = 980 • 0,05 = 49 г M(H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 г / моль M(BaSO4) = 137 + 32 + 16 • 4 = 233г / моль 49 : 98 = х : 233; х = 116,5 г BaSO4 |


1. Fe + H2SO4 = FeSO4 + H2↑
2. FeO + H2SO4 = FeSO4 + H2O
3. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4. CuSO4 + Fe = FeSO4 + Cu
5. FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O

🔍 Видео
Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

КАК РАБОТАЮТ ЧИСЛА С ПЛАВАЮЩЕЙ ТОЧКОЙ | ОСНОВЫ ПРОГРАММИРОВАНИЯСкачать

Закон Харди — Вайнберга | НОВАЯ тема ЕГЭ по Биологии | Популяционная генетикаСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Классификация реакций: нуклеофилы, электрофилы, радикалыСкачать