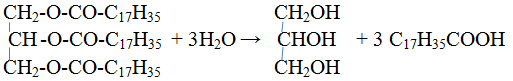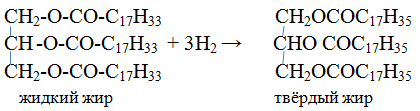Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Определение непредельности жиров
Жидкие жиры, например, подсолнечное масло, в своем составе содержат остатки непредельных карбоновых кислот. Докажем это. Воспользуемся бромной водой. К подсолнечному маслу прибавим бромную воду и энергично перемешаем содержимое пробирки. Происходит обесцвечивание бромной воды. Мы доказали, что жидкие жиры содержат остатки непредельных карбоновых кислот.
СН 3 – (СН 2 ) 7 – СН=СН – (СН 2 ) 7 – СО – + В r 2 = СН 3 – (СН 2 ) 7 – СН Br – СН Br – (СН 2 ) 7 – СО –
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с бромом (бромной водой).
Выделение свободных жирных кислот из мыла
Мыла представляют собой растворимые соли высших карбоновых кислот. Чаще используется натриевая соль стеариновой кислоты. Так как, карбоновые кислоты слабые кислоты, то их легко выделить из раствора при действии сильных неорганических кислот. К раствору хозяйственного мыла прибавим раствор серной кислоты. Сразу же выделяется стеариновая кислота.
2С 17 Н 35 СОО Na + H 2 SO 4 =2 C 17 H 35 COOH + Na 2 SO 4
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с кислотами.
Образование нерастворимых кальциевых солей жирных кислот
Кальциевые соли жирных кислот нерастворимы в воде. Это можно наблюдать в следующем опыте. К раствору мыла прильем немного раствора хлорида кальция. Выпадает обильный осадок нерастворимого стеарата кальция.
2С 17 Н 35 СОО Na + СаС I 2 =( C 17 H 35 COO ) 2 Ca + 2 NaCI
Такой процесс происходит при мытье в жесткой воде. Поэтому мыло в жесткой воде плохо мылится.
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Опыт безопасен.
Окисление муравьиной кислоты раствором перманганата калия
Муравьиная кислота отличается по строению от всех остальных карбоновых кислот. Поэтому она совмещает свойства и кислоты и альдегида. Альдегиды, как известно, легко окисляются. Прильем к раствору муравьиной кислоты раствор перманганата калия. Нагреем смесь. Происходит обесцвечивание раствора. Муравьиная кислота окислилась до углекислого газа и воды.
НСООН + [О]= H 2 О + CO 2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с кислотами и нагревательными приборами.
Гидролиз ацетата натрия
Уксусная кислота – слабый электролит. Ацетат натрия – соль образованная сильным основанием и слабой кислотой. При растворении этой соли в воде создается щелочная среда. Особенностью кристаллогидрата ацетата натрия является то, что он при нагревании легко плавится и ацетат натрия растворяется в своей кристаллизационной воде. Смешает ацетат натрия с сухим индикатором фенолфталеином. Полученную смесь нагреем. Появляется малиновая окраска. Соль частично расплавилась, в расплаве появились гидроксид- ионы.
CH 3 COONa + HO Н = СН 3 СООН + Na ОН
CH 3 COO — + HO Н = СН 3 СООН + ОН —
При охлаждении соль кристаллизуется, равновесие смещается в сторону образования ацетата натрия, гидроксид-илны исчезают, и окраска пропадает. Опыт доказывает, что уксусная кислота является слабой кислотой.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu 2 O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН 2 ОН – (СНОН) 4 – СОН + С u (ОН) 2 = СН 2 ОН – (СНОН) 4 – СООН + С u 2 О↓+ Н 2 О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Качественная реакция глюкозы
с аммиачным раствором оксида серебра ( I )
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН 2 ОН – (СНОН) 4 – СОН + Ag 2 O = СН 2 ОН – (СНОН) 4 – СООН + 2 Ag ↓
Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений.
Оборудование: колба круглодонная, горелка, стакан, штатив, прокладка огнезащитная.
Техника безопасности. Аммиачный раствор оксида серебра нельзя хранить. После опыта неиспользованный раствор нейтрализуют соляной кислотой.
Окисление глюкозы кислородом воздуха
в присутствии метиленового голубого
Окисление глюкозы до глюконовой кислоты особенно легко протекает в щелочной среде в присутствии индикатора метиленового голубого. В колбе с водой растворим гидроксид натрия. Добавим туда глюкозу и затем немного раствора метиленового голубого. Через некоторое время раствор становится бесцветным. Перемешаем раствор. Он вновь окрашивается в голубой цвет.такие изменения окраски можно наблюдать много раз подряд. Под действием щелочи в водной среде глюкоза дегидрируется, превращаясь в глюконовую кислоту.
СН 2 ОН(СНОН) 4 СОН + Н 2 О = СН 2 ОН(СНОН) 4 СООН + 2Н
В отсутствии метиленового голубого отщепляющийся при дегидрировании водород окисляется кислородом воздуха очень медленно и реакция практически не идет. Метиленовый голубой присоединяет водород, превращаясь в бесцветное соединение. Это бесцветное соединение окисляется кислородом воздуха в метиленовый голубой, и вновь появляется голубая окраска. В процессе реакции индикатор практически не расходуется. Он является типичным катализатором окисления глюкозы до глюконовой кислоты.
Оборудование: шпатель, плоскодонная колба с пробкой.
Соблюдать правила работы со щелочами и их растворами.
Определение глюкозы в виноградном соке
Многие фрукты и ягоды содержат глюкозу. Определить наличие глюкозы можно с помощью гидроксида меди (II). Из ягоды винограда выжмем сок. Прильем к соку несколько капель раствора сульфата меди (II) и раствор щелочи. Нагреем раствор. Цвет раствора начинает изменяться. При кипячении раствора образуется желтый осадок Cu 2 O, который постепенно превращается в красный осадок CuO. Это доказывает наличие глюкозы в виноградном соке.
СН 2 ОН – (СНОН) 4 – СОН + С u (ОН) 2 = СН 2 ОН – (СНОН) 4 – СООН + С u 2 О↓+ Н 2 О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Доказательство наличия гидроксильных групп в сахарозе
Докажем, что в состав молекулы сахарозы входят гидроксильные группы.
Прильем к раствору сахарозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае сахароза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Продукт реакции – сахарат меди (II).
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с растворами щелочей
Отсутствие восстанавливающей способности сахарозы
Экспериментально проверим отсутствие альдегидной группы у сахарозы. Приготовим сахарат меди (II). В пробирку с раствором сахарозы добавим раствор сульфата меди (II), воду и раствор щелочи. Образуется ярко синий сахарат меди (II). Раствор сахарата меди (II) нагреваем до кипения. Красного осадка оксида меди (I) не образуется. Следовательно, сахароза не имеет в своем составе свободную альдегидную группу и не обладает восстанавливающими свойствами.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Кислотный гидролиз сахарозы
В присутствии кислот дисахариды гидролизуются. При гидролизе сахарозы образуется глюкоза и фруктоза. Экспериментально проверим это. Прокипятим смесь растворов сахарозы и серной кислоты. Через несколько минут проверим наличие глюкозы в полученном растворе.
С 12 Н 22 О 11 + Н 2 О = С 6 Н 12 О 6 + С 6 Н 12 О 6
Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе сахарозы образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Кислотный гидролиз целлюлозы
При кислотном гидролизе целлюлозы образуется глюкоза. Проведем гидролиз в присутствии серной кислоты. В фарфоровой ступке разотрем вату с концентрированной серной кислотой. Полученную смесь разбавим водой и перенесем в стакан. Прокипятим смесь. Через несколько минут проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе целлюлозы образовалась глюкоза. Кислотный гидролиз целлюлозы имеет важное промышленное значение. Брожением полученной глюкозы получают этиловый спирт.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, фарфоровая ступка с пестиком.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами.
Получение и свойства нитроцеллюлозы
Целлюлоза с азотной кислотой образует азотнокислые эфиры. Эфиры получают действием на целлюлозу смесью безводной азотной кислоты и концентрированной серной кислоты. Целлюлоза в нашем опыте — хлопковая вата.
Приготовим такую смесь и опустим в нее кусочек ваты. Через 15 минут процесс нитрования целлюлозы заканчивается. Промоем полученную нитроцеллюлозу водой. Высушим. Нитроцеллюлоза при поджигании быстро сгорает. Нитроцеллюлоза используется для приготовления бездымного пороха.
Оборудование: стакан, палочка, фильтровальная бумага, мерная пробирка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила работы с концентрированными кислотами.
Растворение целлюлозы в аммиачном растворе гидроксида меди (II)
Целлюлоза нерастворима в воде и в большинстве растворителей. Однако в аммиачном растворе гидроксида меди (II) целлюлоза растворяется хорошо. Продемонстрируем это. В концентрированный аммиачный раствор опускаем небольшие порции ваты. Вата хорошо растворяется в данном растворе. Получается густой вязкий раствор целлюлозы в аммиачном растворе гидроксида меди (II). Раствор целлюлозы используют в промышленности для получения медноаммиачного шелка.
Оборудование: пробирка или стакан, стеклянная палочка.
Техника безопасности. Соблюдать правила работы с концентрированным раствором аммиака.
Пенопласты — легкие пористые материалы. Получим пенопласт реакцией поликонденсации. Растворим мочевину в формалине. Формалин – это 40% водный раствор формальдегида. В другой пробирке смешиваем немного шампуня с соляной кислотой. Шампунь содержит пенообразующие вещества. Смешаем содержимое двух пробирок. Сильно взболтаем смесь и нагреем ее на слабом огне. Образовавшаяся пена быстро затвердевает. Мы получили пенопласт.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с кислотами и нагревательными приборами.
Получение пластмасс на примере резорцинформальдегидной смолы
Для получения многих пластмасс используют реакцию поликонденсации. Проведем такую реакцию. В пробирку нальем немного раствора формалина. Затем растворим в нем резорцин. Резорцин – это вещество, относящееся к классу фенолов, но в отличие от фенола резорцин содержит две гидроксильные группы. К полученному раствору прибавим несколько капель соляной кислоты. Опустим в пробирку термометр.
Через некоторое время начинается реакция поликонденсации. Реакция протекает с выделением теплоты. Полученный полимер имеет розовый цвет.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Изучение физических свойств анилина
Анилин – бесцветная маслянистая жидкость. При хранении анилин постепенно окисляется и приобретает вначале желтую, затем бурую окраску. Изучим растворимость анилина в воде. Прибавим анилин к воде и перемешаем раствор. Анилин мало растворим в воде. При 18 о С в 100 мл воды растворяется всего 3,6г. анилина. Раствор анилина не изменяет окраски индикаторов.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами.
Получение диметиламина и его горение
Получим диметиламин действием гидроксида натрия на хлорид диметиламина. Смешаем в пробирке хлорид диметиламина со щелочью и прибавим воды. При легком нагревании выделяется газ диметиламин.
[(СН 3 ) 2 NH 2 ] CI + NaOH = (СН 3 ) 2 NH + NaCI + H 2 O
При поджигании диметиламин сгорает с образованием углекислого газа, водяных паров и азота.
4( СН 3 ) 2 NH +15 O 2 = 8CO 2 + 14H 2 O + 2N 2
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, газоотводная трубка.
Техника безопасности. Соблюдать правила работы со щелочами и нагревательными приборами.
Видео:Определение непредельности жировСкачать

ПОЛУЧЕНИЕ И СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
Теоретическая часть
Карбоновые кислоты – органические вещества, молекулы которых содержат одну или несколько карбоксильных групп –СООН, соединённых с углеводородным радикалом или водородным атомом.
Физические свойства
Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Муравьиная кислота – средней силы, уксусная – слабая.
Химические свойства
6. Диссоциация (слабые кислоты, меняют окраску индикаторов)
CH3COOH CH3COO — + H +
7. Взаимодействие с металлами
9. С гидроксидами
10. С солями более слабых и летучих кислот
11. Со спиртами (реакция этерификации)
В лаборатории карбоновые кислоты, как и неорганические, можно получить из их солей, действуя на них серной кислотой при нагревании:
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить свойства уксусной кислоты.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, стружки магния, гранулы цинка, концентрированная серная кислота, раствор уксусной кислоты, раствор хлорида натрия, оксид меди (II), этанол, спиртовка.
ОПЫТ 1. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С МЕТАЛЛАМИ.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, во вторую – несколько гранул цинка.
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ОКСИДОМ МЕДИ (II).
В сухую пробирку помещаем 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли раствора серной кислоты. Осторожно нагреваем содержимое пробирки над пламенем спиртовки.
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ЭТАНОЛОМ (РЕАКЦИЯ ЭТЕРИФИКАЦИИ).
В пробирку налейте 1 мл ледяной уксусной кислоты, затем 0,5 мл концентрированной серной кислоты. Далее прилейте 1 мл этанола. Встряхните содержимое пробирки и осторожно подогрейте. Влейте жидкость в пробирку с насыщенным раствором хлорида натрия.
Что наблюдаете? Напишите уравнение реакции.
Задания.
1. Какие органические вещества называются карбоновыми кислотами? Как их классифицируют?
2. Напишите структурные формулы возможных изомерных кислот и сложных эфиров, соответствующих формуле С4Н8О2. Назовите их.
3. Дайте сравнительную характеристику органических и неорганических кислот. В чем сходство и различие?
4. Что такое реакция этерификации? Напишите реакцию взаимодействия изоамилового спирта и уксусной кислоты.
5. Укажите основные способы получения карбоновых кислот.
ЛАБОРАТОРНАЯ РАБОТА № 14
РАСТВОРИМОСТЬ ЖИРОВ,
ДОКАЗАТЕЛЬСТВО ИХ НЕПРЕДЕЛЬНОГО ХАРАКТЕРА.
Теоретическая часть
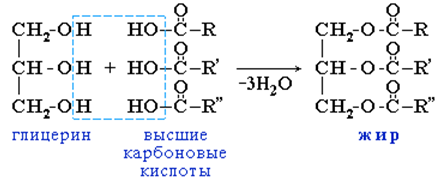
Жиры – сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
Жиры – легкоплавкие вещества, легче воды, нерастворимы в воде, растворимы в органических растворителях, имеют низкую теплопроводность. Животные жиры – твёрдые, растительные жиры (масла) – жидкие. В состав животных жиров входят преимущественно насыщенные кислоты: стеариновая С17Н35СООН, пальмитиновая С15Н31СООН, в состав растительных масел входят ненасыщенные кислоты: олеиновая С17Н33СООН, линолевая С17Н31СООН.
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
1. Гидролиз жиров. Жиры гидролизуются с образованием глицерина и карбоновых кислот:
2. Гидрирование масел. Жидкие растительные масла превращаются в твёрдые
3. Получение мыла. Мыла – соли щелочных металлов высших карбоновых кислот
Применение — жиры – ценный продукт питания, служат для получения глицерина, карбоновых кислот, мыла, гидрированный жир служит для получения маргарина.
Жиры в природе. Жиры входят в состав животных и растительных организмов, служат источником энергии. При пищеварении жиры под действием ферментов распадаются на глицерин и карбоновые кислоты.
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить растворимость жиров в различных растворителях. Обнаружить непредельность жиров, выделение свободных жирных кислот из мыла.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, хлороформ, этанол, концентрированная серная кислота, дистиллированная вода, подсолнечное масло, йодная вода, бензол, разбавленный раствор мыла, раствор серной кислоты.
ОПЫТ 1. РАСТВОРИМОСТЬ ЖИРОВ.
В одну пробирку налейте 2 мл воды, во вторую – хлороформа, в третью – этанола, в четвертую — бензола. Во все пробирки с веществами прилейте 2 мл подсолнечного масла.
Опишите свои наблюдения.
ОПЫТ 2. ОПРЕДЕЛЕНИЕ НЕПРЕДЕЛЬНОСТИ ЖИРОВ.
В пробирку помещаем 2 мл подсолнечного масла и добавляем 2 мл бромной воды.
Что наблюдаете? Напишите уравнение реакции.
ОПЫТ 3. ВЫДЕЛЕНИЕ СВОБОДНЫХ ЖИРНЫХ КИСЛОТ ИЗ МЫЛА.
В пробирку налейте 2 мл раствора хозяйственного мыла, затем добавим 2 мл раствора серной кислоты.
Что наблюдаете? Напишите уравнение реакции.
Задания.
1. Что такое жиры?
2. Какое различие существует в строении твердых и жидких жиров?
3. Назовите важнейшие ВКК, входящие в состав жиров.
4. Каковы химические свойства жиров? Приведите уравнения реакций на примере тристеарина.
5. Составьте уравнения реакций получения: а) триолеина; б) олеолинолеопальмитина.
6. Что такое мыла?
7. Что такое твердое мыло, жидкое мыло?
8. Какими недостатками обладают мыла?
ЛАБОРАТОРНАЯ РАБОТА № 15
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ.
Теоретическая часть
Белки – это природные полимеры, состоящие из большого числа остатков α-аминокислот, связанных между собой пептидными связями.
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы, то есть ее пространственной структуры. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: сни- жается растворимость, способность к гидратации, теряется биологическая актив-ность. Меняется форма белковой макромолекулы, происходит агрегирование. В то же время увеличивается активность некоторых групп, облегчается воздействие на белки протеолитических ферментов, а, следовательно, он легче гидролизуется.
Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) Ксантопротеиновая–происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски;
Белок +HNO3(конц) → жёлтая окраска
в) Биуретовая – происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu 2+ и полипептидами. Реакция сопровождается появлением фиолетово–синей окраски;
Раствор белка +NaOH + CuSO4 → фиолетовая окраска
г) Цистеиновая реакция – происходит при нагревании белков со щелочью в присутствии солей свинца выпадает черный осадок, который содержит серу.
Раствор белка +NaOH+Pb(CH3COO)2 → черное окрашивание
Белок + Н2О → смесь аминокислот
Функции белков в природе:
Ферментативная функция белков заключается в том, что они служат катализаторами различных химических реакций, протекающих в организме. Ферментативную функцию по-другому называют каталитической. При катализе происходит ускорение химических реакций, причем это ускорение может быть даже в миллионы раз.
Белков-ферментов тысячи, каждый из них обслуживает свою химическую реакции или группу схожих реакций. По типу обслуживаемых реакций ферменты делят на классы. Например, оксидоредуктазы катализируют окислительно-восстановительные реакции, гидролазы обеспечивают гидролиз химических связей и т. д.
Реакцию катализирует не вся молекула фермента, а только ее так называемый активный центр. Он включает часть молекулы, которая связывает субстрат (молекулу, которая подвергается превращению), и несколько аминокислот (часто не вместе расположенных), которые обеспечивают саму реакцию.
Белки выполняют структурную функцию. Они входят в состав клеточных мембран и органоидов, межклеточного вещества (белки коллаген и эластин), волос, ногтей и т. п. (кератин).
Двигательная функция белков заключается в сокращении мышц (актин и миозин), обеспечении движения клеток, их ресничек и жгутиков.
Существуют белки, которые обеспечивают перенос различных веществ как внутри клетки, так и по всему организму. Такие белки обеспечивают транспортную функцию. Они легко связываются с субстратом, когда его концентрация высока, и легко высвобождают его при низкой концентрации. К транспортным белкам относится гемоглобин. В легких он связывает кислород и высвобождает углекислый газ, а в тканях наоборот.
Ряд белков, входящих в состав мембран клеток, обеспечивают транспорт малых молекул через мембрану. Такой транспорт может быть как пассивным (белки-каналы), так и активным (белки-переносчики).
Регуляторная и сигнальная функции белков разнообразны. Многие внутриклеточные процессы (клеточный цикл, транскрипция и трансляция, активация или подавление активности других белков и т. д.) регулируются белками.
Многие гормоны — это белки, переносимые кровью. Когда гормон связывается с определенным рецептором, то клетка получает сигнал, в результате чего в ней запускается ответная реакция. Гормоны регулируют концентрации веществ, процесс роста, период размножения и др.
Клетки взаимодействуют между собой посредством сигнальных белков, которые передаются через межклеточное вещество. Например, такие сигналы могут стимулировать или подавлять рост клеток. Таким образом обеспечивается согласованность работы клеток той или иной системы органов.
Выделяют рецепторную функцию белков. Белки-рецепторы могут находиться как в цитоплазме, так и в мембранах. Когда на рецептор действует химическое вещество или физический стимул (свет, давление и др), то он изменяется. Это изменение молекулы передается в другие части клетки, посредством катализа определенной реакции, прохождения ионов или связывания молекул-посредников.
Защитная функция белков также весьма разнообразна. Коллаген и кератин обеспечивают не только структурную функцию, но и физическую защиту организма. Также физически организм защищают фибриногены и тромбины, свертывающие кровь в местах ранения (контакта с воздухом).
Белки обеспечивают химическую защиту, связывая и расщепляя чужеродные токсины или вырабатывая свои (для защиты от других организмов).
Защитными белками являются антитела, которые обезвреживают микроорганизмы и чужеродные белки. Так белки обеспечивают иммунную защита.
Если в организме возникает дефицит углеводов и жиров, то белки, распадаясь до конечных продуктов, могут выполнять энергетическую функцию.
Белки могут запасаться как источник энергии и источник аминокислот (например, в яйцеклетках). Это запасающая функция белков.
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: изучить основные свойства белков.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, спиртовка, этанол, концентрированная азотная кислота, дистиллированная вода, яичный белок, раствор гидроксида натрия, раствор сульфата меди (II).
ОПЫТ 1. СВЕРТЫВАНИЕ БЕЛКОВ ПРИ НАГРЕВАНИИ.
В пробирку налейте 2 мл раствора яичного белка и осторожно нагрейте до кипения.
Опишите свои наблюдения.
ОПЫТ 2. ДЕНАТУРАЦИЯ БЕЛКОВ.
В пробирку помещаем 2 мл раствора яичного белка и добавляем 2 мл неразбавленного этанола.
Опишите свои наблюдения.
ОПЫТ 3. ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ.
В пробирку налейте 2 мл раствора яичного белка, затем добавьте 2 мл раствора гидроксида натрия, а затем немного раствора сернокислой меди.
Отметьте в какой цвет окрашивается белок.
В пробирку налейте 2 мл раствора яичного белка и прибавьте осторожно несколько капель концентрированной азотной кислоты, затем смесь нагрейте.
Отметьте цвет образовавшегося осадка. Укажите, содержание каких остатков аминокислот можно обнаружить в белках этой реакцией.
Задания.
1. Что такое белки?
2. Опишите физические и химические свойства белков.
3. Что такое денатурация белка? Чем она может быть вызвана?
4. Какие качественные реакции на белки вы знаете? Опишите их выполнение и визуальный эффект.
5. Охарактеризуйте функции белков в организме.
Видео:Опыты по химии. Растворимость жировСкачать

Опыты по химии. Эфиры. Жиры
Выделение свободных жирных кислот из мыла
Мыла представляют собой растворимые соли высших карбоновых кислот. Чаще используется натриевая соль стеариновой кислоты. Так как, карбоновые кислоты слабые кислоты, то их легко выделить из раствора при действии сильных неорганических кислот. К раствору хозяйственного мыла прибавим раствор серной кислоты. Сразу же выделяется стеариновая кислота.
2С17Н35СООNa + H2SO4 =2C17 H35COOH + Na2SO4
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Определение непредельности жиров
Жидкие жиры, например, подсолнечное масло, в своем составе содержат остатки непредельных карбоновых кислот. Докажем это. Воспользуемся бромной водой. К подсолнечному маслу прибавим бромную воду и энергично перемешаем содержимое пробирки. Происходит обесцвечивание бромной воды. Мы доказали, что жидкие жиры содержат остатки непредельных карбоновых кислот.
СН3 – (СН2)7 – СН=СН – (СН2)7 – СО – + Вr2 = СН3 – (СН2)7 – СНBr – СНBr – (СН2)7 – СО –
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с бромом (бромной водой).
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение борноэтилового эфира
Неорганическая борная кислота, как и другие карбоновые кислоты, способна образовывать летучие эфиры. Смешаем борную кислоту с этиловым спиртом. Добавим концентрированную серную кислоту. Нагреем смесь. Легкокипящий борноэтиловый эфир испаряется. При поджигании он горит красивым зеленым пламенем.
Оборудование: штатив, пробирка, горелка, газоотводная трубка, шпатель.
Техника безопасности. Соблюдать правила работы с кислотами и горючими жидкостями.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение уксусноэтилового эфира
Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу поместим этиловый спирт, уксусную кислоту и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир. Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
СН3СООН + С2Н5ОН = H2О + CH3COOС2Н5
Оборудование: прибор для получения галоидоалканов, штатив, горелка, огнезащитная прокладка, мерный цилиндр, мерная пробирка.
Техника безопасности. Соблюдать правила работы с кислотами и правила работы с горючими жидкостями.
Постановка опыта и текст – к.п.н. Павел Беспалов.
🔍 Видео
Опыты по химии. Омыление жировСкачать

Опыт к теме "Растворимость жиров"Скачать

Жиры. 2 часть. 11 класс.Скачать

ЛЕКЦИЯ 3. ЛИПИДЫСкачать
Химия 10 класс (Урок№9 - Жиры. Моющие средства.)Скачать

Жиры. 1 часть. 11 класс.Скачать

Химия, 11-й класс, Идентификация непредельных углеводородовСкачать

ЖирыСкачать

Высшие жирные кислоты и жиры | ЕГЭ по химии 2023Скачать

Омыление твёрдого жираСкачать

Сложные эфиры ЖирыСкачать

Жиры и углеводы. Видеоурок по химии 9 классСкачать

Химические свойства жиров. Мыла. Урок 23. Химия 10 классСкачать

Химия. 11 класс. Жиры /12.02.2021/Скачать

Анализ жиров и жирных маселСкачать

Опыты по химии. Получение сложного эфираСкачать

Растворимость и эмульгирование жиров лабы биохимияСкачать

Вывод уравнений движения идеальной жидкости - Лекция 2Скачать