- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Реакция термического разложения гидроксида меди (II)
- Реакция термического разложения гидроксида меди (II)
- Реакция взаимодействия свинца и селена
- Реакция взаимодействия индия и оксида углерода (IV)
- Реакция взаимодействия карбоната рубидия и гидроксида кальция
- Выбрать язык
- Популярные записи
- Предупреждение.
- Гидроксид меди (II)
- Содержание
- Получение
- Химические свойства
- Токсичность
- 🎦 Видео
Гидроксид меди (II)
Гидроксид меди (II) Сu(OН)2 — голубое аморфное или кристаллическое вещество. Практически нерастворим в воде.
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Видео:Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

Реакция термического разложения гидроксида меди (II)
Видео:Разбор, детальное объяснение цепочек превращений, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Реакция термического разложения гидроксида меди (II)
Уравнение реакции термического разложения гидроксида меди (II):
Реакция термического разложения гидроксида меди (II).
В результате реакции образуются оксид меди (II) и вода.
Реакция протекает при условии: при температуре около 200 °C.
Формула поиска по сайту: Cu(OH)2 → CuO + H2O.
Реакция взаимодействия свинца и селена
Реакция взаимодействия индия и оксида углерода (IV)
Реакция взаимодействия карбоната рубидия и гидроксида кальция
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Качественная реакция с Cu(OH)2Скачать

Гидроксид меди (II)
| Гидроксид меди (II) | |
|---|---|
 | |
| Хим. формула | Cu(OH)2 |
| Состояние | синие кристаллы |
| Молярная масса | 97,561 г/моль |
| Плотность | 3,37 г/см³ |
| Температура | |
| • разложения | >70 °C |
| Энтальпия | |
| • образования | -444,4 кДж/моль |
| Рег. номер CAS | [20427-59-2] |
| PubChem | 164826 |
| Рег. номер EINECS | 243-815-9 |
| SMILES | |
| ChEBI | 81907 |
| ChemSpider | 144498 и 21171179 |
| ЛД50 | 1000 мг/кг (крыса, орально), кожа, глаза, дыхательные пути |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидроксид меди (II) — Cu(ОН)2, голубое аморфное или кристаллическое вещество. Кристаллы образуют решётку ромбической сингонии, параметры ячейки a = 0,2949 нм , b = 1,059 нм , c = 0,5256 нм , Z = 4 . Cu(ОН)2 практически не растворим в воде. При нагревании до 70—90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и H2O.
Видео:Making Cu(OH)2 (a precipitation reaction) #shortsСкачать

Содержание
Видео:Решение цепочек превращений по химии, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Получение
В лаборатории получают действием на холоде растворимых гидроксидов, кроме NH4OH, на растворимые соли меди, например:
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

Химические свойства
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Как и все нерастворимые основания, гидроксид меди (II) при нагревании разлагается на оксид и воду, в данном случае образуется оксид меди (II):
При длительном стоянии на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом, образуя грязно-красный оксид меди (III):
Равновесие в этой реакции сдвинуто влево.
При избытке влаги может образоваться гидроксид куприла (III):
Очень легко растворяется в избытке аммиака с образованием дигидроксотетрааммиаката меди:
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu 2+ в растворе.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Токсичность
Как и большинство соединений меди, гидроксид меди (II) токсичен, но токсичность невысокая.
🎦 Видео
Решение цепочек превращений по химииСкачать

Цветные осадки и другие признаки протекания реакции.Скачать
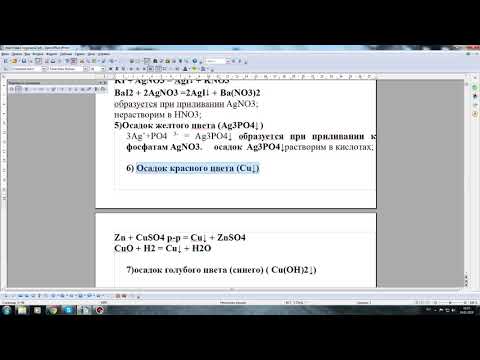
Вторая часть экзамена по химииСкачать
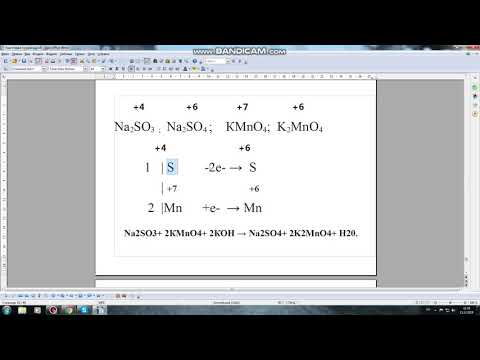
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

How to Write the Equation for Cu(OH)2 + H2OСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Fe + CuSO4 = FeSO4 + Cu; FeSO4 + NaOH = Na2SO4 + Fe(OH)2 Химия Подготовка ЕГЭ ОГЭ Соединения железаСкачать

Самые красивые химические реакции - образование Сu(OH)₂Скачать

8 класс. Составление уравнений химических реакций.Скачать

ОВР. Mn(OH)2+Cl2+KOHСкачать

Реакции ионного обмена. Часть 1Скачать

Как получить гидроксиды металла в 2 стадии?Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать



