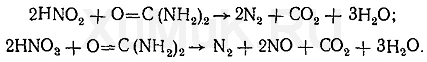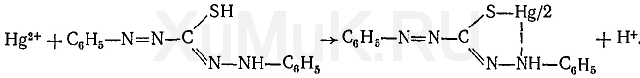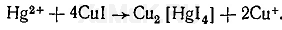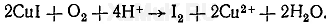Применение и токсичность ртути и ее соединений. Ртуть и ее соединения применяются в технике, химической промышленности, медицине. Металлическая ртуть применяется в медицине для приготовления мази. В технике она используется при изготовлении ламп, термометров и ряда приборов. При поступлении металлической ртути в желудок она малотоксична. Токсичными являются большинство ее соединений. Желтый оксид ртути (II) входит в состав глазной мази и мазей для лечения кожных заболеваний. Красный оксид ртути (II) применяется для получения красок. Хлорид ртути (I), который называется каломель, используется в пиротехнике, а также в качестве фунгицида. В ряде стран каломель используется в качестве слабительного. Токсическое действие каломели проявляется особенно тогда, когда после приема ее внутрь не наступает слабительное действие и организм долгое время не освобождается от этого препарата. Хлорид ртути (II), который называется сулема, является очень токсичным. Сулема применяется в медицине как дезинфицирующее средство, в технике она используется для обработки дерева, получения некоторых видов чернил, травления и чернения стали. В сельском хозяйстве сулема применяется как фунгицид. Амидохлорид ртути (белый преципитат ртути) входит в состав некоторых мазей. В ветеринарии амидохлорид ртути применяется как средство против паразитарных заболеваний кожи. Нитрат ртути (II) применяется для отделки меха и получения других соединений этого металла. Токсичность нитрата ртути (II) примерно такая же, как и токсичность сулемы. Многие органические соединения ртути используются в качестве пестицидов и средств для обработки семян. Отдельные органические соединения ртути применяются как диуретические средства. Незначительные количества ртути содержатся в тканях организма (см. табл. 7).
Пары металлической ртути и пыль, содержащая соединения этого металла, могут поступать в организм с вдыхаемым воздухом. При этом поражается центральная нервная система (в первую очередь кора головного мозга). Поступившая в организм металлическая ртуть и ее соединения связываются с сульфгидрильными группами ферментов и других жизненно важных белков. В результате этого нарушаются физиологические функции некоторых клеток и тканей организма. Соединения ртути, поступившие в организм через пищевой канал, поражают желудок, печень, почки, железы, через которые выделяется ртуть из организма. При этом ощущаются боли в пищеводе и желудке, появляется рвота и кровавый понос. В организме ртуть откладывается главным образом в печени и почках.
Ртуть медленно выводится из организма. Еще через две недели после острого отравления ртутью определенные количества ее можно обнаружить в отдельных тканях. Ртуть выводится из организма с мочой и калом, а также потовыми, слюнными и молочными железами.
При патологоанатомическом вскрытии трупов лиц, отравленных соединениями ртути, обнаруживается покраснение и набухание (а иногда и некроз) слизистых оболочек пищевода и желудка, воспаление или некроз тканей в толстой кишке и в нижнем отделе тонкой кишки, наличие язв. Если при отравлении ртутью смерть наступает через 10—14 сут, то на вскрытии обнаруживается поражение почек (так называемый сулемовый нефроз).
Деструкция биологического материала. При описании методов разрушения биологического материала азотной и серной кислотами, серной и хлорной кислотами, пергидролем и серной кислотой указано, что эти методы непригодны для исследования объектов биологического происхождения на наличие ртути и ее соединений. Пользуясь этими методами, в процессе разрушения биологического материала улетучиваются значительные количества ртути. В связи с недостатками указанных методов А. А. Васильева предложила метод деструкции биологического материала, содержащего ртуть. Этот метод усовершенствовала А. Н. Крылова.
Деструкция — нарушение структуры биологического материала под влиянием азотной, серной и других кислот, обладающих окислительными свойствами, без полного разрушения органических веществ, переходящих в деструктаты. При деструкции твердых частиц биологического материала он разлагается и переходит в жидкую фазу (деструктат). При деструкции в качестве продуктов разложения твердых частиц биологического материала, переходящих в деструктат, являются молекулы белковых веществ и продукты их частичного кислотного гидролиза (пептиды и аминокислоты), липиды и некоторые другие вещества, входящие в состав тканей организма.
Ртуть в биологическом материале находится в связанном виде с сульфгидрильными и некоторыми другими функциональными группами белковых веществ. В процессе деструкции под влиянием сильных кислот при нагревании происходит разрыв прочных ковалентных связей между ртутью и сульфгидрильными или другими функциональными группами белковых веществ. В результате деструкции ртуть переходит в деструктат в виде ионов, которые можно обнаружить и определить с помощью соответствующих реакций и физико-химических методов. Таким образом, после деструкции биологического материала в деструктате в различных количествах находятся ионы ртути, белки, пептиды, аминокислоты, липиды и др.
Для ускорения деструкции к биологическому материалу прибавляют этиловый спирт, который является катализатором этого процесса. Для удаления из деструктата азотной, азотистой кислот и оксидов азота, образующихся в процессе деструкции, прибавляют мочевину.
Оксиды азота окисляются кислородом воздуха до оксида азота (IV), при взаимодействии которого с водой образуются азотная и азотистая кислоты, разлагающиеся мочевиной, как указано выше.
Предложено два варианта метода деструкции биологического материала, подлежащего исследованию на наличие ртути. Описание одного из этих вариантов приводится ниже.
Для деструкции берут по 20 г измельченных органов трупов (печень, почки). Эти пробы подвергают деструкции раздельно, не смешивая их. Каждый деструктат на наличие ртути исследуют раздельно.
Методика деструкции органов трупов. 20 г измельченных органов трупов вносят в коническую колбу вместимостью 200 мл, в которую прибавляют 5 мл воды, 1 мл этилового спирта и 10 мл концентрированной азотной кислоты. Затем в колбу малыми порциями прибавляют 20 мл концентрированной серной кислоты с такой скоростью, чтобы оксиды азота не выделялись из колбы. После окончания прибавления концентрированной серной кислоты колбу оставляют на 5—10 мин при комнатной температуре (до прекращения выделения оксидов азота). Затем колбу устанавливают на кипящую водяную баню и нагревают в течение 10—20 мин. Если после нагревания колбы на кипящей водяной бане останутся неразрушенными кусочки биологического материала, то их осторожно растирают стеклянной палочкой о стенки колбы. При бурном протекании реакции с выделением оксидов азота в колбу прибавляют 30—50 мл горячей воды. Полученный горячий деструктат смешивают с двойным объемом кипящей воды и, не охлаждая жидкость, фильтруют ее через двойной увлажненный фильтр. Фильтр, через который фильтровали деструктат, и остатки жира на нем 2—3 раза промывают горячей водой. Промывные воды присоединяют к профильтрованному деструктату. Полученную при этом жидкость собирают в колбу, содержащую 20 мл насыщенного раствора мочевины, предназначенной для денитрации деструктата. Затем деструктат охлаждают, доводят водой до определенного объема и исследуют его на наличие ртути.
Деструкция органических веществ в моче. В моче здоровых людей ртуть и ее соединения отсутствуют. Однако при отравлении ртутью она может поражать почки и выделяться из организма с мочой в виде соединений с белками, аминокислотами и другими органическими веществами. Некоторое количество ртути может переходить в мочу и в виде ионов. Поэтому для обнаружения ртути в моче необходимо производить деструкцию белковых и других ртутьсодержащих соединений, переходящих в мочу.
А. Ф. Рубцов и А. Н. Крылова разработали два способа деструкции органических веществ в моче:
1. В колбу Къельдаля вместимостью 500 мл вносят пробу нефильтрованной суточной мочи объемом 200 мл. К моче прибавляют 35 мл концентрированной азотной кислоты, 2 мл этилового спирта и небольшими порциями в колбу вносят 25 мл концентрированной серной кислоты. Прибавляют эту кислоту так, чтобы не вспенивалась жидкость в колбе и не выделялись из нее оксиды азота. После окончания прибавления концентрированной серной кислоты содержимое колбы нагревают на кипящей водяной бане в течение 40 мин, затем прибавляют 20 мл насыщенного раствора мочевины. Если в деструктате имеется осадок, то его отфильтровывают, фильтр промывают горячей водой. Промывные воды присоединяют к деструктату, который подвергают исследованию на наличие ртути.
2. В колбу Къельдаля вместимостью 500 мл вносят 200 мл нефильтрованной суточной мочи, к которой небольшими порциями прибавляют 25 мл концентрированной серной кислоты, а затем малыми порциями прибавляют 7 г перманганата калия. Содержимое колбы оставляют на 40 мин при комнатной температуре периодически взбалтывая, затем в колбу небольшими порциями прибавляют насыщенный раствор щавелевой кислоты до исчезновения окраски перманганата калия. Полученный деструктат используют для обнаружения и количественного определения ртути.
Этот способ деструкции белковых веществ в моче более быстрый, чем описанный выше.
Деструкция органических веществ в крови. Для этой цели применяют методику, которая используется для деструкции органов трупов (см. выше), с той лишь разницей, что к пробе крови не прибавляют воду. На исследование берут по 50—100 мл крови.
Обнаружение ртути в деструктате
Для обнаружения ртути в деструктате применяют реакции со взвесью иодида меди (I) и с дитизоном. Реакцию с дитизоном также применяют для фотоколориметрического определения ртути, а реакцию со взвесью иодида меди (I) используют и для визуального колориметрического определения ионов этого металла в деструктате.
Реакция с дитизоном. Эта реакция основана на том, что при взаимодействии ионов ртути (II) с дитизоном образуется однозамещенный дитизонат этого металла:
В кислой среде дитизонат ртути имеет оранжево-желтую окраску, а в щелочной или слабокислой — пурпурно-красную. Указанные дитизонаты ртути хорошо экстрагируются четерыххлористым углеродом и хлороформом. Для маскировки мешающих ионов применяют сульфат гидроксиламина, аскорбиновую кислоту и др.
Выполнение реакции. Около половины деструктата вносят в делительную воронку, прибавляют 10 мл хлороформа и взбалтывают в течение 1 мин. Хлороформный слой, в который могут переходить различные примеси из деструктата, отбрасывают. Взбалтывание деструктата с новыми порциями хлороформа (по 10 мл) проводится до тех пор, пока не перестанет окрашиваться хлороформный слой. После этого к очищенному от примесей деструктату прибавляют 10 мл 10 %-го раствора сульфата гидроксиламина или 10 мл 10 %-го раствора аскорбиновой кислоты, 5 мл хлороформа, 0,3 мл и 0,01 н. раствора дитизона в хлороформе, который имеет зеленую окраску, и взбалтывают. Появление желтой или оранжево-желтой окраски хлороформного слоя указывает на наличие ртути в деструктате.
Реакция со взвесью иодида меди (I) основана на том, что при взаимодействии ионов ртути со взвесью иодида меди (I) образуется красный или оранжево-красный осадок Cu 2 [HgI 4 ]:
Различные варианты этой реакции для обнаружения и количественного определения ртути в биологическом материале разработали А. А. Васильева, А. Ф. Рубцов, А. Н. Крылова и др.
Указанной реакции мешают окислители, которые при взаимодействии с CuI выделяют свободный иод, окрашивающий суспензию в бурый или коричневый цвет:
Выполнение реакции. К определенному объему деструктата прибавляют 10 мл взвеси иодида меди (I). Появление красного или оранжево-красного осадка указывает на наличие ртути в деструктате.
Приготовление взвеси иодида меди (I) (см. Приложение 1, реактив 17).
Видео:Этот Металл ВЕДЕТ СЕБЯ ОЧЕНЬ СТРАННО!Скачать

Хлорид ртути (сулема): получение, свойства и применение
Не секрет, что соединения ртути являются очень ядовитыми и токсичными. В США они запрещены для применения в большей части косметических товаров, а в Канаде включены в список наиболее опасных веществ. Вместе с тем, их широко используют в химической промышленности для изготовления красок, фунгицидов, пластика, а также в медицине и технике. Одним из представителей этого класса веществ является хлорид ртути (II), который более известен под своим вторым названием – сулема. Давайте рассмотрим это соединение поподробнее.
Формула и свойства
Хлорид ртути 2-валентный обозначается HgCl2. Это соединение представляет собой белый кристаллический порошок. При температуре 277˚ С он начинает плавиться, а при 304˚С — кипеть. В нормальных условиях (25˚С) его плотность составляет 5,43 г/см 3 . Возгоняется хлорид ртути легко, отличается заметной летучестью. Растворимость сулемы в воде во многом зависит от ее температуры. Так, при 20° С этот показатель составляет всего лишь 6,6%, но стоит довести воду до кипения (100° С) и он достигает 58,3%. Кроме того, хлорид ртути способен растворяться в эфире, кислотах, пиридине; в растворе NaCl этот процесс сопровождается образованием комплексных соединений. Как электролит HgCl 2 довольно слаб. При дневном свете, особенно при контакте с органическими соединениями, это вещество легко восстанавливается до одновалентного хлорида Hg 2Cl 2 (каломели) и металлической ртути.
В больших количествах хлорид ртути (II) в настоящее время производится лишь посредством прямого синтеза из ртути и хлора. Второй способ получения сулемы заключается в растворении HgO в концентрированной соляной кислоте (HCl). На практике он используется реже, в основном – в ходе проведения лабораторных опытов. В первом случае ртуть нагревается в атмосфере хлора до очень высокой температуры (около 340˚С), после чего воспламенятся и сгорает с образованием синевато-белого пламени. Образовавшиеся пары по мере охлаждения сгущаются и, в зависимости от технологии получения, образуют мелкий порошок или твердые куски.
Стоит отметить, что хлорид ртути был первым веществом на основе Hg, которое начали использовать в качестве антисептического и дезинфицирующего средства. В этом отношении сулема отличается высокой эффективностью, но в то же время является очень токсичной. Она способна всасываться через кожу и слизистые оболочки и накапливаться в человеческом организме. Раньше, когда люди еще не знали о той опасности, которую несет хлорид ртути, его использовали для того, чтобы излечить кожные заболевания. Сейчас же в медицине его применяют больше для дезинфекции одежды, белья, предметов ухода за больными и т.д. Поскольку это вещество очень ядовито, его растворы часто специально окрашивают для того, чтобы по неосторожности его не перепутали с другими лекарствами.
В промышленности хлорид ртути используется в гальванопластике, для консервирования древесины, при термической металлизации и бронзировании. Сулема применяется для изготовления аккумуляторов, красок для подводной части корпусов морских судов. Ее используют при дублении кожи, в литографии, фотографии, как инсектицид и т.д.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Хлорид ртути I
| Хлорид диртути 2+ | |
|---|---|
 | |
| Систематическое название | Хлорид диртути 2+ |
| Другие названия | Каломель, дихлорид диртути, хлорид ртути I, хлористая ртуть |
| Химическая формула | Hg2Cl2 |
| Внешний вид | твёрдое вещество белого цвета |
| Молярная масса | 472,09 г/моль |
| Температура плавления | 525 °C (при избыточном давлении) |
| Температура возгонки | 383,7 °C |
| Температура разложения | 400 °C |
| Плотность | 7,15 г/см³ |
| Твёрдость по Моосу | 1,5—2 |
| Растворимость в воде | 3,4⋅10 −5 г/100 мл |
| Произведение растворимости | 1,3⋅10 −18 |
| LD 50 | 210 мг/кг |
| ПДК | в воздухе рабочей зоны 0,2 мг/м³ в атмосферном воздухе 0,0003 мг/м³ в воде водоёмов 0,001 мг/л |
| Кристаллическая решётка | тетрагональная |
| Стандартная энтальпия образования | −266 кДж/моль |
| Стандартная молярная энтропия | +192 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −211 кДж/моль |
| Регистрационный номер CAS | 10112-91-1 |
| Регистрационный номер EC | 233-307-5 |
| R-фразы | R22 , R36/37/38 , R50/53 |
| S-фразы | S13 , S24/25 , S46 , S60 , S61 |
| H-фразы | H302; H315; H319; H335; H410 |
| P-фразы | P273; P302+P352; P304+P340; P305+P351+P338 |
| Пиктограммы опасности |    |
| Пиктограммы опасности СГС |   |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Хлорид ртути I, также каломель, дихлорид диртути, Хлорид диртути 2+ — неорганическое вещество с формулой Hg2Cl2 , соединение ртути и хлора. Относится к классу бинарных соединений, может рассматриваться как димер соли одновалентной ртути и соляной кислоты (см. кластер). Кристаллическое вещество белого цвета.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 6 Токсичность
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Нахождение в природе
Хлорид ртути I в природе встречается в виде минерала каломели (устаревшее название — роговая ртуть). Цвет минерала от светло-жёлтого до коричневого, твёрдость по шкале Мооса 1,5 — 2.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Физические свойства
Хлорид ртути I — кристаллическое вещество белого цвета, на свету темнеет. Легколетучий, нерастворим в воде (растворимость 3,4⋅10 −4 г/л), этаноле, эфире; растворяется в бензоле, пиридине. Не образует кристаллогидратов. Возгоняется с разложением при температуре 383—400 °C
Кристаллическая решётка тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,445 нм , c = 1,089 нм , Z = 2 .
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства
Хлорид ртути I не реагирует со щелочами.
Окисляется до соединений ртути II:
Восстанавливается до металлической ртути сильными восстановителями, например хлоридом олова II в соляной кислоте:
Под действием хлора каломель окисляется с образованием сулемы:
Дисмутирует на металлическую ртуть и соединения ртути II:
- в разбавленных кислотах (медленно) или при нагревании выше 400 °C
Hg2Cl2 ⟶ HgCl2 + Hg
- в растворе аммиака образуется так называемый белый неплавкий преципитат
Hg2Cl2 + 2 (NH3 ⋅ H2O) ⟶ [Hg(NH2)Cl] ↓ + Hg ↓ + NH4Cl + 2 H2O
При температуре возгонки в газовой фазе частично разлагается с образованием мономера:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Получение
Хлорид ртути I может быть получен:
- с помощью реакций ионного обмена, например осаждением хлоридом калия из раствора динитрата диртути I в разбавленной азотной кислоте
Hg2(NO3)2 + 2 KCl ⟶ Hg2Cl2 ↓ + 2 KNO3
- взаимодействием хлорида ртути II и металлической ртути при высокой температуре
HgCl2 + Hg → 250−300∘C Hg2Cl2
- взаимодействием хлорида ртути II с цианидом ртути II:
HgCl2 + Hg(CN)2 → 70−120∘C Hg2Cl2 + C2N2
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение
Хлорид ртути I используется для изготовления каломельного электрода сравнения, как антисептик, в качестве катализатора, для синтеза ртуть органических соединений.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Токсичность
Хлорид ртути I является среднетоксичным веществом для теплокровных существ: LD50 для крыс 210 мг/кг (пероральная), 1500 мг/кг (дермальная). Вызывает раздражение кожи, слизистых оболочек, сильное раздражение глаз. При попадании внутрь организма главным образом поражаются печень, почки, ЖКТ, ЦНС. Очень токсичен для водных организмов: LC50 для Daphnia magna составляет 0,002 мг/л в течение 48 ч
ПДК (в пересчёте на ртуть) составляет: в воздухе рабочей зоны 0,2 мг/м³, в атмосферном воздухе 0,0003 мг/м³, в воде водоёмов 0,001 мг/л.
📸 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

СОЛЯНАЯ КИСЛОТА | HCl | Химические свойства СОЛЯНОЙ КИСЛОТЫ | Хлороводород | Нитрат серебра | ХимияСкачать

Электроотрицательность химических элементов. 8 класс.Скачать
ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Реакция цинка с соляной кислотой. Химический опытСкачать

Соли ртути . Цинк + соляная кислота .Скачать

Действие кислот на индикаторыСкачать

Реакция оксида цинка с соляной кислотой. Химический опытСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать