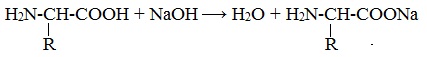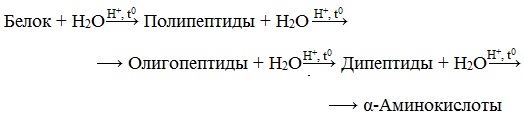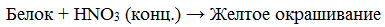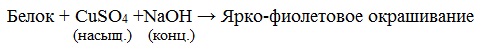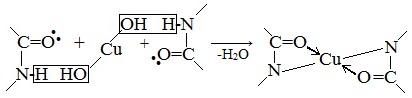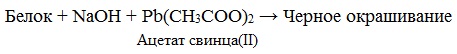Реакции осаждения белков
4. Реакции осаждения белков
Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором — глобулиновая фракция.
Сущность реакции заключается в дегидратации молекул белка.
1) неразведенный яичный белок;
2) насыщенный раствор сульфата аммония;
3) NaOH, 10% раствор,
4) CuSO 4 , 1% раствор;
5) дистиллированная вода;
6) сульфат аммония в порошке.
Ход определения. В пробирку наливают 30 капель неразведенного яичного белка и добавляют равное количество насыщенного раствора сульфата аммония. Содержимое пробирки перемешивают. Получают полунасыщенный раствор сульфата аммония, при этом глобулиновая фракция осаждается, а альбуминовая остается в растворе. Последнюю отфильтровывают, затем смешивают с порошком сульфата аммония до тех пор пока не прекратится растворение соли, при этом выпадает осадок — глобулины.
Необратимое осаждение белков.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами — в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором — отрицательный заряд, что повышает их устойчивость в растворе.
1) яичный белок, 1% раствор;
2) уксусная кислота, 1% и 10% растворы;
3) NaOH, 10% раствор.
Ход определения. В 4 пронумерованные пробирки приливают по 10 капель раствора яичного белка. Затем 1-ю пробирку нагревают до кипячения, при этом раствор мутнеет, но т.к. частицы денатурированного белка несут заряд, они в осадок не выпадают. Это связано с тем, что яичный белок имеет кислые свойства (его изоэлектрическая точка 4,8) и в нейтральной среде заряжен отрицательно; во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипячения. Белок выпадает в осадок, т.к. его раствор приближается к изоэлектрической точке и белок теряет заряд (один из факторов устойчивости белка в растворе); в 3-ю пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения. Осадка не образуется, т.к. в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе); в 4-ю пробирку наливают 1 каплю раствора NaOH, нагревают до кипения. Осадок не образуется, поскольку в щелочной среде отрицательный заряд белка увеличивается.
Осаждение концентрированными минеральными кислотами.
Концентрированные кислоты (серная, хлористоводородная, азотная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки). Однако при избытке хлористоводородной и серной кислоты выпавший осадок денатурированного белка снова растворяется. По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. При добавлении избытка азотной кислоты растворения осадка не происходит. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота.
1) яичный белок,1% раствор;
2) концентрированная серная кислота;
3) концентрированная хлористоводородная кислота;
4) концентрированная азотная кислота.
Ход определения. В три пробирки наливают по 5 капель концентрированной серной, хлористоводородной и азотной кислот. затем, наклонив пробирку под углом 45 градусов, осторожно по стенке наслаивают такой же объем яичного белка. На границе двух слоев появляется осадок белка в виде белого кольца. Осторожно встряхивают пробирки, наблюдают растворение белка в пробирках с серной и хлористоводородной кислотами, в пробирке с азотной кислотой растворения белка не происходит.
Осаждение органическими кислотами.
Трихлоруксусная кислота осаждает только белки, а сульфосалициловая осаждает не только белки, но и высокомолекулярные пептиды. Сульфосалициловой кислотой пользуются при определении белка в моче.
1) яичный белок, 1% раствор;
2) трихлоруксусная кислота, 10% раствор;
3) сульфосалициловая кислота, 10% раствор.
Ход определения. В две пробирки вносят по 5 капель раствора белка. В одну из них прибавляют 2 капли сульфосалициловой кислоты, а в другую — 5 капель трихлоруксусной кислоты. В пробирках выпадает осадок белка.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
Ход определения. В три пробирки вносят по 5 капель белка. В первую добавляют 1 каплю ацетата свинца, в третью — 1 каплю нитрата серебра. Во всех пробирках выпадает осадок. Затем в первую пробирку добавляют 10 капель нитрата серебра — растворения осадка нет.
Видео:Опасно для здоровья! ⚠️ Опыты с серной кислотойСкачать

Белок и серная кислота уравнение
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
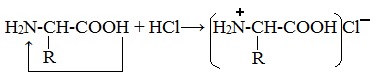
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
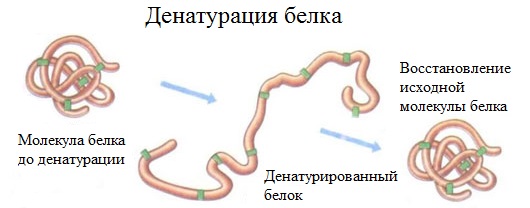
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
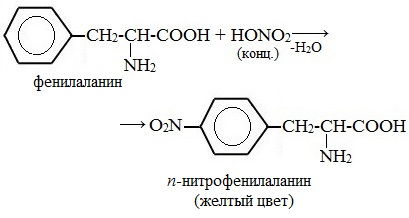
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
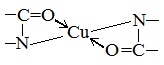
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Видео:Серная кислота и ее соли. 9 класс.Скачать

Денатурация белка яйца серной кислотой
Как известно, белки состоят из аминокислот. Молекулы аминокислот NH2-R-COOH одновременно содержат карбоксильные группы -COOH и аминогруппы -NH2. Аминогруппа одной молекулы аминокислоты может прореагировать с карбоксильной группой другой аминокислоты:
в результате аминокислоты связываются пептидной связью -С(=O)-NH- ,
образуя дипептид (при этом отщепляется молекула воды). Нетрудно видеть,
что дипептид также имеет аминогруппу и карбоксил, которые способны
взаимодействовать с другими молекулами аминокислот. Таким образом можно
объединить тысячи и десятки тысяч молекул аминокислот в одну
полипептидную цепь. Каждый белок имеет свою неповторимую
последовательность аминокислот, которая называется первичной структурой белка.
Однако не следует думать, что аминокислотная цепь подобна прямой нити.
За счет образования водородных связей цепь скручивается в спираль
(альфа-спираль), образует складчатые слои или другие локальные
структуры, которые получили название вторичная структура белка.
Однако белки имеют более сложное строение, которое определяется
положением аминокислотной цепи в пространстве. Например, полипептидная
спираль может скручиваться в клубок. Пространственное расположение
полипептидной цепи называется третичной структурой белка.
Если первичная структура белка – последовательность аминокислот в
цепи, вторичная структура – локальное положение фрагментов
полипептидной цепи, то третичная структура – это положение всех атомов
белка в пространстве. Третичная структура белка стабилизируется с
помощью ковалентных, водородных и ионных связей, а также
гидрофильно-гидрофобного взаимодействия.
Существует еще более высокий уровень организации молекул белка – четвертичная структура,
которая возникает, когда несколько полипептидных цепей образуют сложные
агрегаты в пространстве. Объединяться могут как одинаковые, так и
различные молекулы белка. Образование таких агрегатов отвечает за
важнейшие процессы жизнедеятельности организмов и обусловлено теми же
силами, что и образование третичной структуры белка.
Структура белка: 1 – первичная, 2 – вторичная, 3 – третичная, 4 – четвертичная
Возникает вопрос: а что будет, если разрушить четвертичную, третичную, вторичную и первичную структуры белка?
Ответ на последнюю часть вопроса самый простой. При гидролизе
белка полипептидные связи разрушаются, и белок превращается сначала в
полипептиды с меньшей молекулярной массой, затем – в смесь аминокислот.
Белок перестает существовать. Такой процесс идет во время переваривания
пищи в желудке под действием соляной кислоты и ферментов.
Разрушение четвертичной, третичной и вторичной структуры белка
происходит при денатурации белка, которая ведет к потере белком
растворимости, гидрофильности и ряда других важных свойств. Денатурация
белка происходит под действием химических веществ (кислоты, соли
тяжелых металлов, органические растворители и др.), при нагревании или
облучении ионизирующим излучением. Хорошо знакомые примеры денатурации
белка – скисание молока и “сворачивание” белка при жарке яичницы. В
некоторых случаях денатурация белка может быть обратимой, но чаще всего
этот процесс необратим. Именно разрушением структуры белков объясняется
губительное действие многих ядовитых веществ.
Приступим к эксперименту. Отделите белок одного куриного яйца и
поместите его в стакан. Яичный белок в основном представляет собой
раствор протеинов в воде, это бесцветная вязкая жидкость. Добавьте к
яйцу разбавленный раствор серной или соляной кислоты и перемешайте.
Жидкость превратится в белую творожистую массу, похожую на скисшее
молоко. Под действием кислоты белок денатурирует и выпадает в осадок.
Когда мы использовали 50% серную кислоту (см. фотографии), образовался
осадок, который по консистенции соответствовал плавленому сырку или
сваренному вкрутую яйцу. Предлагаем читателям самостоятельно
поэкспериментировать с другими кислотами разной концен трации (азотной,
уксусной, муравьиной, лимонной и т.д.).
Чтобы наблюдать денатурацию белка совсем не обязательно
использовать сильные кислоты. Например, белок молока быстро
сворачивается даже от небольших количеств уксусной (подойдет столовый
уксус) или лимонной кислот. Этот процесс используют для приготовления из
молока творога.
📹 Видео
СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Концентрированная серная кислота. Получаем. Измеряем. Храним.Скачать

Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

Не повторять! ⚠️ Если серная кислота попадет на кожу #shortsСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Изучаем химические свойства концентрированной серной кислоты!Скачать

Решаем два варианта Добротина за 2 часаСкачать

Что если РОЗУ ОПУСТИТЬ В КИСЛОТУ: СЕРНУЮ, СОЛЯНУЮ, АЗОТНУЮ и ПЛАВИКОВУЮ?Скачать

Серная кислота. Химические свойства. Реакции с металлами.Скачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Опыты по химии. Денатурация белков: нагреванием; взаимодействие с кислотой, солями тяжелых металловСкачать

Витамин D: вред или пользу определяет доза. Найди правильную!Скачать

Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

PROСТО О СЛОЖНОМ. Белки и их структуры. Биохимия №1Скачать

Соединения серы. 9 класс.Скачать

Животный и Растительный белок: Кратко и по СутиСкачать

Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать