Химия | 5 — 9 классы
ALCL3 + 3NH4OH = 3NH4Cl + AL(OH)3 Полное и сокращённое ионное.
AlCl3 + 3NH4OH = 3NH4Cl + Al(OH)3 осадок
в полном ионном виде : Al(3 + ) + 3Cl( — ) + 3NH4OH = 3NH4( + ) + 3Cl( — ) + Al(OH)3
в сокращённом ионном виде : Al(3 + ) + NH4OH = NH4( + ) + Al(OH)3.
- Напишите полное ионное и сокращённое ионное уравнение?
- ПРОШУ ПОМОГИТЕ СОСТАВИТЬ УРАВНЕНИЯ РЕАКЦИЙ в молекулярной, полной ионной и сокращённой ионной форме?
- Составьте полное ионное и сокращённое ионное уравнение реакций Ca(NO3)2 + HCl?
- Напишите пожалуйста полное ионное и сокращённое ионное к K + H2O?
- 3Ag + PO4 = Ag3PO4?
- Вот фотка нужно составить полное уравнение, ионное, сокращённая?
- Cl2O7 + H2O — > НСlO4полное и сокращённое ионное уравнение?
- Помогите пожалуйста?
- Составьте молекулярную формулу, затем полную ионную и сокращённую ионную формулу данных уравнений ?
- CaCl2 + Na2co3 молекулярной, полное ионное, сокращённое ионное уравнение реакции?
- Как протекают различные химические процессы
- Уравнения реакций хлорида алюминия с аммиаком и щелочью
- Расчет энергии Гиббса
- Определение массы электрода гальванического элемента
- Гидроксид алюминия: получение и свойства
- Гидроксид алюминия
- Способы получения
- Химические свойства
- 🎥 Видео
Видео:How to Balance AlCl3 + NH4OH = NH4Cl + Al(OH)3Скачать

Напишите полное ионное и сокращённое ионное уравнение?
Напишите полное ионное и сокращённое ионное уравнение.
Видео:AlCl3+NH4OHСкачать

ПРОШУ ПОМОГИТЕ СОСТАВИТЬ УРАВНЕНИЯ РЕАКЦИЙ в молекулярной, полной ионной и сокращённой ионной форме?
ПРОШУ ПОМОГИТЕ СОСТАВИТЬ УРАВНЕНИЯ РЕАКЦИЙ в молекулярной, полной ионной и сокращённой ионной форме.
Видео:Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Составьте полное ионное и сокращённое ионное уравнение реакций Ca(NO3)2 + HCl?
Составьте полное ионное и сокращённое ионное уравнение реакций Ca(NO3)2 + HCl.
Видео:Решение цепочек превращений по химииСкачать

Напишите пожалуйста полное ионное и сокращённое ионное к K + H2O?
Напишите пожалуйста полное ионное и сокращённое ионное к K + H2O.
Видео:NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

3Ag + PO4 = Ag3PO4?
3Ag + PO4 = Ag3PO4.
Полное и сокращённое ионное уравнение нужно.
Видео:How to Balance AlCl3 + NaOH = Al(OH)3 + NaCl | Aluminum chloride + Sodium hydroxideСкачать

Вот фотка нужно составить полное уравнение, ионное, сокращённая?
Вот фотка нужно составить полное уравнение, ионное, сокращённая.
Видео:Амфотерные свойства гидроксида алюминияСкачать

Cl2O7 + H2O — > НСlO4полное и сокращённое ионное уравнение?
Cl2O7 + H2O — > НСlO4
полное и сокращённое ионное уравнение.
Видео:ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

Помогите пожалуйста?
Как составлять молекулярные, полные ионные и сокращённо ионные уравнения?
Видео:Аммиак, химические свойства аммиака. NH3 + HCl → NH4Cl и FeCl3 + 3NH3 + 3H2O → Fe(OH)3 + 3NH4ClСкачать

Составьте молекулярную формулу, затем полную ионную и сокращённую ионную формулу данных уравнений ?
Составьте молекулярную формулу, затем полную ионную и сокращённую ионную формулу данных уравнений :
Видео:How to Balance AlN + H2O = Al(OH)3 + NH3 (Aluminum nitride + Water)Скачать

CaCl2 + Na2co3 молекулярной, полное ионное, сокращённое ионное уравнение реакции?
CaCl2 + Na2co3 молекулярной, полное ионное, сокращённое ионное уравнение реакции.
На этой странице сайта, в категории Химия размещен ответ на вопрос ALCL3 + 3NH4OH = 3NH4Cl + AL(OH)3 Полное и сокращённое ионное?. По уровню сложности вопрос рассчитан на учащихся 5 — 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Видео:Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

Как протекают различные химические процессы
Видео:NaOH+H2O+Al=Na(Al(OH)4)+H2+Q Гидроксид натрия реагирует с алюминием выделяется водородСкачать

Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: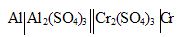
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Видео:AlOH3 NaOH → NaAlOH4 Получение гидроксида алюминия и растворение его в иСкачать

Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
🎥 Видео
How to Write the Net Ionic Equation for NaOH + AlCl3 = NaCl + Al(OH)3Скачать

CHEMISTRY: Cation Test for Al3+ (using NaOH and NH4OH)Скачать

Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O | Реакция взаимодействия алюминия и азотной кислотыСкачать

Электролиты и неэлектролитыСкачать

How to write Equation for Al(OH)3 + H2O (Aluminum hydroxide + Water)Скачать

MgCl2 + 2 NH4OH → 2 NH4Cl + Mg(OH)2 | NH4OH+MgCl2Скачать

17.5.10 Solubility of Al(OH)3 in 15 M NH3Скачать








