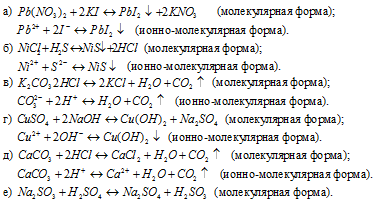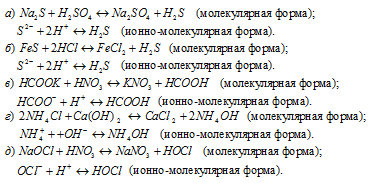AlBr3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора бромида алюминия
- Cоставление ионно-молекулярных форм уравнений реакций
- Школе NET
- Register
- Login
- Newsletter
- Суррикат Мими
- Обменные реакции в растворах электролитов.Написать в молекулярной и ионной форме:KHCO3(р) Ba(OH)2(р) ->AlCl3(р) K2CO3(р) H2O(ж) ->Написать в молекулярной и ионной форме уравнения реакций гидролиза солей и укажите реакцию их водных растворов (область pH):NaNo2Уравнение метод электронно-ионных уравнений реакции, протекающие в водном растворе, укажите окислитель и восстановитель:Na2Cr2O7 NaNO2 H2SO4 -> NaNO3 Cr2(SO4)3 Na2SO4 H2ONa2[Cr(OH)6] Cl2 NaOH -> Na2CrO4 NaCl H2O
- Лучший ответ:
- Васян Коваль
- 📽️ Видео
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlBr3 + HOH ⇄ AlOHBr2 + HBr
Полное ионное уравнение
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:How to Balance Al(OH)3 + HBr = AlBr3 + H2OСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHBr2 + HOH ⇄ Al(OH)2Br + HBr
Полное ионное уравнение
AlOH 2+ + 2Br — + HOH ⇄ Al(OH)2 + + Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Видео:How to Balance Al + Br2 = AlBr3 (Aluminum + Bromine gas)Скачать

Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Br + HOH ⇄ Al(OH)3 + HBr
Полное ионное уравнение
Al(OH)2 + + Br — + HOH ⇄ Al(OH)3 + H + + Br —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:Метод электронно-ионного балансаСкачать

Среда и pH раствора бромида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 3ч. 10 класс.Скачать

Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Видео:Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 2370227
Суррикат Мими
Видео:КАК УРАВНЯТЬ Al + O2 = Al2O3 ЭЛЕКТРОННЫМ БАЛАНСОМ / Реакция алюминия и кислородаСкачать

Обменные реакции в растворах электролитов.Написать в молекулярной и ионной форме:KHCO3(р) Ba(OH)2(р) ->AlCl3(р) K2CO3(р) H2O(ж) ->Написать в молекулярной и ионной форме уравнения реакций гидролиза солей и укажите реакцию их водных растворов (область pH):NaNo2Уравнение метод электронно-ионных уравнений реакции, протекающие в водном растворе, укажите окислитель и восстановитель:Na2Cr2O7 NaNO2 H2SO4 -> NaNO3 Cr2(SO4)3 Na2SO4 H2ONa2[Cr(OH)6] Cl2 NaOH -> Na2CrO4 NaCl H2O
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 2ч. 10 класс.Скачать

Лучший ответ:
Васян Коваль
2KHCO3 Ba(OH)2 = BaCO3↓ K2CO3 2H2O
2K 2HCO3 Ba 2OH = BaCO3↓ 2K CO3 2H2O
Ba 2OH 2HCO3 = BaCO3↓ CO3 2H2O
2AlCl3 3K2CO3 3H2O = 2Al(OH)3↓ 3CO2↑ 6KCl
2Al 6Cl 6K 3CO3 3H2O = 2Al(OH)3↓ 3CO2↑ 6K 6Cl
2Al 3CO3 3H2O = 2Al(OH)3↓ 3CO2↑
NaNO2 H2O ⇄ NaOH HNO2
Na NO2 H2O ⇄ Na OH HNO2
NO2 H2O ⇄ HNO2 OH
pH>7
Na2Cr2O7 NaNO2 H2SO4 = NaNO3 Cr2(SO4)3 Na2SO4 H2O
Уравнения полуреакций:
Cr2O7 14H 6e = 2Cr 7H2O | 1 — окислитель, процесс восстановления
NO2 H2O — 2e = NO3 2H | 3 — восстановитель, процесс окисления
Na2Cr2O7 3NaNO2 4H2SO4 = 3NaNO3 Cr2(SO4)3 Na2SO4 4H2O
Na3[Cr(OH)6] Cl2 NaOH = Na2CrO4 NaCl H2O
Уравнения полуреакций:
[Cr(OH)6] 2OH — 3e = CrO4 4H2O | 2 — восстановитель, процесс окисления
Cl2 2e = 2Cl | 3 — окислитель, процесс восстановления
2Na3[Cr(OH)6] 3Cl2 4NaOH = 2Na2CrO4 6NaCl 8H2O
📽️ Видео
(a) SO2F2 (b) AlBr3 (c) HClO3Скачать

Гидроизоляция пруда из бентонитовых матов. Лучше бутилкаучука? Преимущества и недостатки материалаСкачать

Хренова М.Г. - Квантовая химия - 2. Атом водородаСкачать

How to Balance Al + HBr = AlBr3 + H2 (Aluminum + Hydrochoric acid)Скачать

Is AlBr3 (Aluminum bromide) Ionic or Covalent/Molecular?Скачать

Химические уравнения. Как составлять химические уравнения.Скачать

Якуб Худадатов: Восхваление Всевышнего:Скачать

Balancing Chemical Equations Practice ProblemsСкачать

How To Write Net Ionic Equations In Chemistry - A Simple Method!Скачать

How to Write the Net Ionic Equation for Ba(OH)2 + NH4Cl = BaCl2 + NH3 + H2OСкачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

How to Draw the Lewis Dot Structure for AlBr3: Aluminum bromideСкачать