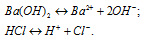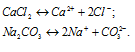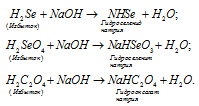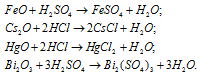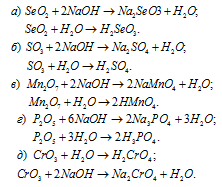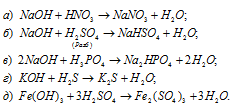Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba 2+ и Cl – не связываются с ионами H + и OH – с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca 2+ и CO3 – связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl – и OH – , которые не связываются друг с другом, молекулами CaCO3 и ионами воды H + и OH — . Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ag + и Cl — связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na + и NO3 — , которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K + + Cl — ;
NaNO3 ⇔ Na + + NO 3 — .
Образовавшиеся ионы K + , Na + , Cl — и NO 3 — не связываются друг с другом и ионами воды H + и OH — и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
В присутствии избытка кислорода в воде образуется только азотная кислота:
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0 С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag + и NO3 — , а соляная кислота как электролит распадается на ионы H + и Cl — . Ионы Ag + и Cl — , соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Ионы PO4 3- , SO4 2- , H + и Cl — не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu 2+ + SO4 2- ;
NaOH ⇔ Na + + OH —
Ионы Cu 2+ и OH — связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6] 4- :
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
б) Действием кислоты на основание:
в) Действием кислоты на соль:
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена). При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Фосфорная кислота: получение и свойства
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Зная свойства оксидов и оснований приведите по два уравнения реакций получения а ва3 ро4
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие общие свойств лежат в основе объединения металлов в группу щелочных?
Щелочные металлы ― элементы IА-группы периодической таблицы, физические свойства их простых веществ: серебристо-белые металлы, хорошо проводящие теплоту и электрический ток, мягкие; химически активные вещества, взаимодействуют с водой.
Какие закономености наблюдаются в этой группе с ростом относительной атомной массы металла? Плотность металлов возрастает (от лития к цезию), а температура плавления уменьшается.
Задание 2
Какие общие свойства лежат в основе объединения металлов в группу щелочноземельных?
Щелочноземельные металлы ― элементы IIА-группы периодической таблицы, начиная с кальция, физические свойства их простых веществ: серебристо-белые металлы, легкие, тверже щелочных металлов. Взаимодействуют с кислородом и водой.
Какие закономерности наблюдаются в этой группе с ростом относительной атомной массы металла? Плотность возрастает, а температура плавления уменьшается.
Задание 3
Какие общие свойства лежат в основе объединения элементов в группу галогенов?
Галогены ― фтор, хлор, бром, иод, астат, теннессин. Простые вещества – двухатомные молекулы. Активные неметаллы.
Какие закономерности наблюдаются в этой группе с ростом относительной атомной массы галогена? Плотность, температуры плавления и кипения возрастают, , цвет простых веществ становится более интенсивным.
Фтор имеет цвет светло-жёлтый, хлор — жёлто-зелёный, бром — буровато-коричневый, а иод — чёрно-серый.
Задание 4
Какие общие свойства лежат в основе объединения элементов в группу инертных газов?
Инертные газы ― элементы VIIIА-группы периодической таблицы. Простые вещества существуют в форме атомов. Химически инертные, то есть почти не вступают в соединения с другими химическими элементами.
Почему эту группу правильнее называть благородными газами? По аналогии с благородными металлами, так как они образуют соединения с другими химическими элементами с большим трудом и существуют в виде одноатомных молекул.
Какие закономерности наблюдаются в этой группе с ростом относительной атомной массы газа? Повышается температура кипения.
Задание 5
Что такое амфотерность? Амфотерность — это свойство веществ проявлять кислотные или основные свойства в зависимости от природы второго реагента, принимающего участие в реакции.
Приведите примеры амфотерных оксидов и гидроксидов.
Оксиды и гидроксиды бериллия — ВеО и Ве(ОН)2, цинка — ZnO и Zn(OH)2, хрома (III) — Сг2O3 и Сг(ОН)3, алюминия — Al2O3 и Al(OH)3 и других металлов.
Запишите уравнения химических реакций, иллюстрирующие свойства оксида и гидроксида выбранного вами элемента.
Оксид и гидроксид бериллия — ВеО и Ве(ОН)2
BeO + 2HCl = BeCl2 + H2O
BeO + 2NaOH + H2O = Na2[Be(OH)4] — тетрагидроксобериллат натрия.
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Оксид и гидроксид цинка — ZnO и Zn(OH)2
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] — тетрагидроксоцинкат натрия.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Задание 6
Напишите формулы высших оксидов (т.е. оксидов, в которых элемент проявляет свою высшую валентность) и соответствующих им гидроксидов следующих химических элементов: натрий, магний, алюминий, азот, сера, углерод. Укажите характер каждого вещества, подтвердите его уравнением соответствующих реакций.
Оксид натрия Na2O, гидроксид натрия NaOH
Основный оксид Na2O + H2O = NaOH
Оксид магния MgO, гидроксид магния Mg(OH)2
Основный оксид MgO + H2O = Mg(OH)2
Оксид алюминия Al2O3, гидроксид алюминия Al(OH)3
Основный оксид Al2O3 + 3H2O = 2Al(OH)3
Оксид азота (V) N2O5, азотная кислота HNO3
Кислотный оксид N2O5 + H2O = 2HNO3
Оксид серы (VI) SO3, серная кислота H2SO4
Кислотный оксид SO3 + H2O = H2SO4
Оксид углерода (IV) CO2, угольная кислота H2CO3
Кислотный оксид CO2 + H2O = H2CO3
Задание 7
Запишите уравнения химических реакций между веществами:
а) оксид стронция и вода;
SrO + H2O = Sr(OH)2
б) оксид марганца (VII) и вода;
Mn2O7 + H2O = 2HMnO4
в) гидроксид калия и сульфат меди(II);
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4
г) гидроксид цинка и серная кислота;
Zn(OH)2↓ + H2SO4 = ZnSO4 + 2H2O
д) гидроксид цинка и гидроксид натрия.
Zn(OH)2↓ + NaOH = Na2[Zn(OH)4]
Задание 8
Образуется ли осадок при добавлении 50 г 2%-ного раствора сульфата цинка к 40 г 8%-ного раствора гидроксида калия? Ответ обоснуйте расчётами.
Дано: m1(р-ра)=50 г, ω(ZnSO4)=2%, или 0,02,
m2(р-ра)=40 г, ω(KOH)=8%, или 0,08
Найти: образуется ли осадок Zn(OH)2↓ ?
Решение
1. Найдём массы сульфата цинка и гидроксида калия в растворах:
m(ZnSO4) = m(р-ра) • ω(ZnSO4) = 50 г • 0,02=1 г
m(KOH) = m(р-ра) • ω(KOH) = 40 г • 0,08=3,2 г
2. Находим количество вещества сульфата цинка и гидроксида калия.
M(ZnSO4)=161 г/моль, M(KOH)=56 г/моль
n(ZnSO4) = m(ZnSO4)/M(ZnSO4)=1 г : 161 г/моль=0,0062 моль
n(KOH)=m(KOH)/M(KOH)=3,2 г : 56 г/моль=0,057 моль
3. Составим химическое уравнение:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
1 моль 2 моль
По уравнению реакции для образования осадка количество вещества гидроксида калия должно быть в 2 раза больше, чем количества вещества сульфата цинка, то есть n1(KOH)=2•n(ZnSO4)=2•0,0062 моль=0,0124 моль, а по условию задачи n(KOH)=0,057 моль, то есть гидроксид натрия в избытке, следовательно, образующийся осадок амфотерного гидроксида Zn(OH)2↓ растворится.
Zn(OH)2↓ + NaOH = Na2[Zn(OH)4] — растворимая соль
Ответ: осадок не образуется.
Задание 9
Массовая доля марганца в основном оксиде равна 77,46 %, а в кислотном — 49,55 %. Определите формулы оксидов.
Дано: ω1(Mn)=77,46%, или 0,7746, ω2(Mn)=49,55%, или 0,4955
Найти: формулы оксидов MnхОу -?
Решение.
І способ
1. Вычисляем массовые доли кислорода в оксидах.
ω1(О)=1-ω1(Mn)=1-0,7746=0,2254
ω2(О)=1-ω2(Mn)=1-0,4955=0,5045
2. Отношение количества атомов находят как деление числовых значений массовых долей химических элементов, входящих в состав данного соединения, на их относительные атомные массы:
x:у=ω1(Mn)/Ar(Mn) : ω1(О)/Ar(О)=0,7746/55 : 0,2254/16=0,014084:0,014084=1:1
С вычисления видно, что в данном веществе на один атом марганца приходится один атом кислорода, следовательно химическая формула основного оксида MnO.
x:у= ω2(Mn)/Ar(Mn) : ω2(О)/Ar(О)=0,4955/55 : 0,5045/16=0,00900909:0,03153125
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что меньшее число (0,03153125) равно единице и большее число делим на него:
х:у=(0,00900909/0,00900909) : (0,03153125/0,00900909)=1:3,5
Приведем к ближайшему целому числу соотношение, умножив его на 2, получим:
х:у=(1•2) : (3,5•2)=2:7
С вычисления видно, что в данном веществе на два атома марганца приходится семь атомов кислорода, следовательно химическая формула кислотного оксида Mn2O7.
ІІ способ
1. С формулы вычисления массовой доли элемента ω(Mn)=xAr(Mn):M(MnxOу) выражаем молярную массу для основного оксида:
M(MnxOу)=xAr(Mn)/ω(Mn)=55х/0,7746=71х
По определению M(MnxOу)=xAr(Mn)+yAr(O)=55x+16y
Приравняем левую и правую части выражений, получим уравнение:
71х=55х+16у, отсюда х=у=1, что соответствует формуле MnO
2. С формулы вычисления массовой доли элемента ω(Mn)=xAr(Mn):M(MnxOу) выражаем молярную массу для кислотного оксида:
M(MnxOу)=xAr(Mn)/ω(Mn)=55х/0,4955=111х
По определению M(MnxOу)=xAr(Mn)+yAr(O)=55x+16y
Приравняем левую и правую части выражений, получим уравнение:
111х=55х+16у,
111х-55х=16у
56х=16у
у=56х:16
у=3,5х
Приведем к ближайшему целому числу соотношение, умножив его на 2, получим:
2у=7х, отсюда по свойству пропорции х:у=2:7, что соответствует формуле Mn2O7
Ответ: формула основного оксида MnO и формула кислотного оксида Mn2O7.
📺 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

45. Химические свойства оксидов. (часть 1)Скачать

Химические свойства оксидов, оснований, кислот и солейСкачать

ВСЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ ДЛЯ ЕГЭ ПО ХИМИИ 2024! | Химический сериал, 2 выпускСкачать

Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Оксиды. Химические свойства оксидов. Урок 8. Химия 8 класс.Скачать

Оксиды. 1 часть. 8 класс.Скачать
Типы оксидов за 2 минуты (8 классам)Скачать
Характеристика и химические свойства оксидов | Химия ЕГЭ 10 класс | УмскулСкачать

Важнейшие классы неорганических соединений. Тема 11. Получение и применение оксидовСкачать

Получение оксидовСкачать

8 класс.Основные оксиды.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать