- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Составление электронных и молекулярных уравнений реакций. Уравнение Нернста (Nernst)
- Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
- Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
- 📺 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

We are checking your browser. gomolog.ru
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:MgCO3, Zn(NO3)2, карбонат магния, нитрат цинка, разложение, баланс, коэффициентыСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702427ab09020119 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составление электронных и молекулярных уравнений реакций. Уравнение Нернста (Nernst)
Видео:Zn(NO3)2 + 2 KOH → 2 KNO3 + Zn(OH)2Скачать

Решение задач по химии на составление электронных и молекулярных уравнений реакций окисления
Задание 241.
В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярные уравнения соответствующей реакции.
Решение:
Стандартные электродные потенциалы цинка, меди и серебра соответственно равны -0,76 В, +0,34 В и +0,80 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка:
Zn0 + Cu 2+ = Zn 2+ + Cu 0
Zn + CuSO4 = ZnSO4 + Cu
Серебро, имея более электроположительный потенциал, чем медь не способно вытеснять ионы меди из сульфата меди, поэтому раствор медного купороса, с опущенной в него серебряной пластинкой, не обесцвечивается.
Задание 242.
Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) МgSO4; в) Рb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы цинка и меди соответственно равны -0,76 В и +0,34 В. Исходя из того, что цинк имеет более электроотрицательный потенциал, чем медь, то между цинком и медным купоросом проходит реакция (цинк вытесняет медь из соли), и раствор соли при этом обесцвечивается, так как образуется бесцветный сульфат цинка, а цинковая пластинка будет уменьшаться по массе:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Так как стандартный электродный потенциал цинка (-0,76 В) больше, чем стандартный электродный потенциал магния (-2,36 В), то цинк не способен вытеснять магний из растворов его солей, поэтому цинковая пластинка останется без изменений.
в) Так как стандартный электродный потенциал цинка (-0,76 В) меньше, чем у свинца (-0,13 В), то металлический цинк будет обладать большими восстановительными способностями чем ионы Pb 2+ , и реакция будет протекать с растворением цинковой пластинки, т. е. её масса будет уменьшаться.
Zn 0 + Pb 2+ = Zn 2+ + Pb 0
Задание 243.
При какой концентрации ионов Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л.
Решение:
Найдём значение электродного потенциала цинка в растворе его соли:
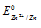
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов цинка в растворе:
Ответ: 0,30 моль/л.
Задание 244.
Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами:
а); AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Стандартные электродные потенциалы кадмия и серебра соответственно равны -0,403 В и +0,80 В. Исходя из того, что кадмий имеет более электроотрицательный потенциал, чем серебро, то между кадмием и нитратом серебра проходит реакция (кадмий вытесняет серебро из соли), и кадмиевая пластинка при этом будет уменьшаться по массе.
Cd 0 + 2Ag + = Cd 2+ + 2Ag 0
б) Так как стандартный электродный потенциал кадмия (-0,403 В) больше, чем стандартный электродный потенциал цинка (-0,76 В), то кадмий не способен вытеснять цинк из растворов его солей, поэтому кадмиевая пластинка останется без изменений.
в) Так как стандартный электродный потенциал кадмия (-0,403 В) меньше, чем у никеля (-0,25 В), то металлический кадмий будет обладать большими восстановительными способностями чем ионы Ni 2+ , и реакция будет протекать с растворением кадмиевой пластинки, т. е. её масса будет уменьшаться.
Cd 0 + Ni 2+ = Cd 2+ + Ni 0
Задание 245.
Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (моль/л). Ответ. 1,89 . 10-2 моль/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn 2+ в растворе:
Ответ. 1,89 . 10 -2 моль/л.
Видео:Разбор, детальное объяснение цепочек превращений, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
|
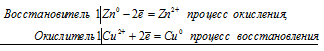
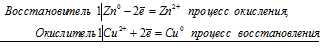
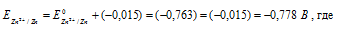

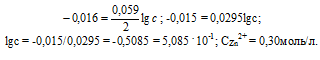
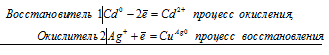

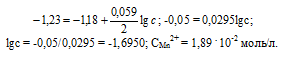






 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5













