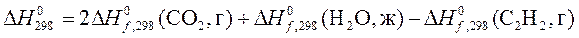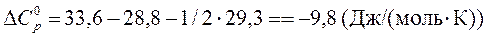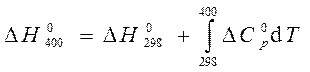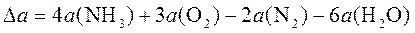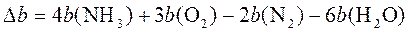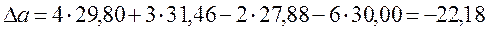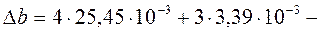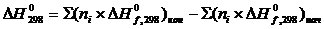- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 1 страница. Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж)
- Примеры решения типовых задач.
- Примеры выполнения задания
- 📹 Видео
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

We are checking your browser. gomolog.ru
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 706a2c65dac24c92 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:2 2 Закон Гесса, тепловой эффект реакцииСкачать
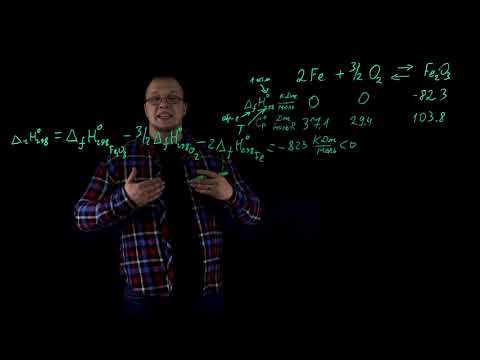
1 страница. Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж)
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРОЦЕССЫ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПРИ ПОСТОЯННОМ
ОБЪЕМЕ
Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции
С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж) , протекающей при 298 К. Чему равна эта разница, если температуру повысить до 400 К и спирт перевести в газообразное состояние?
Решение. 1-й закон термодинамики можно выразить уравнением
где ΔU — изменение внутренней энергии системы (U2-U1) при переходе системы из состояния «1» в состояние “2″; Q — теплота; Aмех — работа механическая, равная рΔV, где р — давление, а ΔV- изменение объема (V2-V1).
Тепловой эффект процесса, протекающего при р=const
Qp= ΔH = ΔU+pΔ , (1.1.2)
ΔH — изменение энтальпии.
Тепловой эффект процесса, протекающего при р = const
где R — газовая постоянная = 8,3144 Дж/моль *К; Δn=n2-n1 ;
n1 и n2 — количество молей реагентов и продуктов реакции газообразных веществ; T — температура, К.
Отсюда: 1) при 298 К Qр — Qv = ΔnRT = (0-2) 8,3144-298 = -4955,38 Дж;
2) при 400 К и газообразном С2Н5ОН Qp – Qv = (1-2) 8,3144-400 = -3325,76 Дж.
Ответ при 298 К Qp-Qv = -4955,38 Дж;
Пример 2. Определить стандартную энтальпию образования
ацетилена по энергиям связей отдельных его атомов:
Решение. Стандартная энтальпия (теплота) образованиям Δ H о обр — тепло, поглощенное или выделенное в процессе синтеза 1 моля соединения из простых веществ при условии, что все компоненты системы находятся в стандартных состояниях.
Верхний индекс Δ H о здесь и в последующих случаях Δ G о, Δ S о, Δ F о обозначает, что реагирующие вещества находятся в своих стандартных состояниях. Стандартное состояние для газов — это состояние идеального газа при давлении 1 атм (101330 Па) и определенной температуре. Для жидкости — это состояние чистой жидкости, а для твердых веществ — это кристаллическое состояние при тех же условиях. Строго говоря, температура должна быть точно указана в виде индекса.
Например, Δ H о 273 , однако, если не оговорено, то стандартное состояние относится к 298 К. Образование молекулы ацетилена Н – С ≡С- Н сопровождается образованием двух связей Н — С (358,2 кДж/моль) и одной связи С ≡ С (536 кДж/моль); разрушением связи H – H (430 кДж/моль) и переходом 2C(rp) → 2-С(г) (525 кДж/моль).
Образование связи сопровождается выделением энергии, разрушение — поглощением.
1.Вычислить разность между Qp и Qv при 298 К для реакции полного сгорания бензола С6Н6, нафталина С10 Н8 и этилена C2H4 с образованием диоксида углерода и воды в жидком состоянии.
2. Найти разность между Qp и Qv при 298 К для следующих реакций:
3. Тепловой эффект реакции 1/2 N2(r)+3/2 H2(г) ⇄NH3(г) при постоянном давлении, при температуре 298 К Qp = Δ H= = -46,26 кДж/моль.
Определить Qv для этой реакции при этой же температуре.
4. Тепловой эффект изобарного процесса, протекающего по реакции
2Fe(кр)+3/2 О2(г)=Fe2O3 (кр) , при 291 К равен -82З,З кДж/моль. Определить тепловой эффект для изохорного процесса, протекающего по этой реакции при той же температуре.
6. Энергия диссоциации H2 , Cl2 и стандартная энтальпия образования HCl соответственно составляют 436,243 и -92 кДж/моль. Вычислить энергию связи H-Cl .
7. Рассчитайте тепловой эффект сгорания метилацетата по энергиям связей при 298 К. Реакция сгорания метилацетата протекает по уравнению
Структурная формула метилацетата
8. Рассчитать стандартную энтальпию образования этилена
получаемого по уравнению
2C(гр) + 2H2(г)— C2H4(г) ; ΔH
по величинам энергии связей. Сравнить полученный результат с табличным (см. табл. 1).
9. Вычислить стандартную энтальпию образования H — бутана
H H H H
по энергиям связей.
Уравнение образования бутана
10. Вычислить стандартную энтальпию образования метанола по величинам энергий связи
Сравнить полученную величину с табличным значением (см. табл. З).
11. Рассчитайте тепловой эффект (ΔH° ) дегидратации этилового спирта по уравнению реакции
H — C— C — OH(ж) → C = C + H — O — H ; ΔH°
Энергии соответствующих связей взять в табл. 1, теплоты испарения спирта
и воды — в табл. 2.
12. Рассчитать тепловой эффект ( ΔH° ) сгорания этилацетата
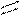
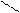
по энергиям разрыва связей при 298 К. (Энергию связей см. в табл. 1, теплоту испарения этилацетата и H2 O — в табл. 2).
1.2. ЗАКОН ГЕССА. РАСЧЕТ ТЕПЛОПРОИЗВОДИТЕЛЬНОСТИ ТОПЛИВА. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ КИРХГОФА
Пример 1. Определить при 298 К тепловой эффект (ΔH°) реакции
Решение. Если ΔH реакции > О — реакция эндотермическая, идет с поглощением тепла; если ΔH реакции о обр продуктов реакции и реагентов с учетом их стехиометрических коэффициентов νj, νi) :
Из табл. 3 выпишем значения стандартных энтальпий образования:
Тепловой эффект реакции находим по (1.2.1):
= -3439,0+1672+3*395,7 = -580,8 кДж
Пример 2. Определить тепловой эффект ΔΗ° реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению
если стандартные энтальпии сгорания (см. табл. 5)
ΔH o cгop (СН3ОН) = -727,59 кДж/моль;
Решение. По следствию из закона Гесса имеем: тепловой эффект реакции равен разности между суммой энтальпий сгорания реагентов и суммой энтальпий сгорания конечных продуктов с учетом их стехиометрических коэффициентов:
Энтальпия сгорания Н20 (а также CO2 ) равны нулю.
Ответ. ΔH o = -26,79 кДж.
Пример 3. Определить стандартную энтальпию образования (Δ H о 298 обр) этилена, если тепловой эффект реакции горения этилена равен — 1412,99 кДж/моль, а стандартные энтальпии образования (Δ H о 298 обр) CО2 и H2O(ж) равны соответственно — 394,07 и — 286,26 кДж/моль.
Решение. Горение этилена происходит по реакции
ΔΗ = -1412,99 кДж/моль
По следствию из закона Гесса (1.2.1):
Δ H о =2Δ H о 298 Н2О + 2Δ H о 298 СО2 — Δ H о 298 С2Н4 — Δ H о 298 О2
Стандартные энтальпии образования простых веществ равны нулю, отсюда Δ H о 298 О2= 0. Тогда
Пример 4. Рассчитать теплотворную способность метана. Реакция горения метана протекает по уравнению
ΔH o cгop метана равна -891,63 кДж/моль.
Решение. Теплотворной способностью топлива называется количество тепла, выделяющееся при сгорании одного килограмма топлива (топливо состоит из горючего и окислителя).
По формуле (1.2.2) имеем
Поэтому ΔΗ 0 = ΔH o cгop CH4 = -891,632 кДж/моль. Это количество тепла выделяется при сгорании 80 г топлива (вес 1-го моля метана и 2-х молей кислорода). Следовательно, теплотворная способность метана
Ответ. т.С. метана равна 1114,54 кДж/кг.
Пример 5. Определить тепловой эффект реакции
Решение. Зависимость теплового эффекта реакции от температуры выражается уравнением Кирхгофа (если в данном процессе отсутствуют фазовые превращения)
ΔΗΤ = ΔΗ 0 Т0 + 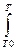
где ΔС°р -разность сумм молярных изобарных теплоемкостей продуктов реакций и реагентов с учетом их стехиометрических коэффициентов. Приняв, что ΔС°р не зависит от температуры в данном температурном интервале(T0 до T), уравнение (1.2.3) запишем в виде
Для решения этого уравнения необходимо знать тепловой эффект реакции при какой-либо температуре Т0. Удобно воспользоваться тепловым эффектом, вычисленным по закону Гесса- при Т0=298 К. Стандартные энтальпии образования компонентов берем из табл. 3. По формуле (1.2.1)
Далее находим ΔС°рпо табличным значениям Ср (табл.4):
= 16,31·10 — 3 кДж/моль*К, отсюда по формуле (1.2.4)
δΗ°500 = -676,4+16,31·10 — 3 (500-298) = -676,4 + 3,29 = -673,11 кДж.
13. Вычислить тепловой эффект реакции дегидрирования этана
Расчет произвести по стандартным энтальпиям сгорания компонентов табл. 5 и по стандартным энтальпиям образования табл. 3. Ответы сравнить.
14. Опpедeлить теплоту cгopания фocфopиcтогo водорода
Cтандapтныe энтальпии образования компонентов взять в табл. 3.
15. Опpедeлить тепловой эффект peaкции:
16. При cοединении 2,1 г железа c ceρой выдeлилocь
3,77 кДж. Pаccчитать cтандаpтнyю энтальпию oбpазoвания сульфида железа.
17. Найти кoличecтво теплоты, выделяющейся при взрыве
8,4 л гpeмучeгo газа, взятого при ноpмaльныx ycлoвияx.
18. Определить cтандаρтнyю энтальпию (Δ H о 298 ) обpазoвания
РH3 , иcxoдя из ypавнения
19. Cpавнить Δ H о 298 peакций воccтановления оксида железа (III) различными вoccтановителями при 298 K:
20. Bычиcлить Δ H о 298 обpaзования MgCO3(кр) при 298 K, пользуясь cледyющими данными:
2 . Bычиcлить Δ H298 pеaкций :
Cтандаpтные энтальпии обpазοвания Li + (водн), Na + (водн) и OH — (водн) принять cooтвeтcтвeннo paвными — 278,5: -239 и 228,9 кДж/моль.
22. Bычиcлить, какое кoличеcтвo тепла выделяeтcя при протекающих в opганизмe pеакциях пpевpaщения глюкозы:
Какая из этих реакций πocтавляeт оpганизмy больше энергии?
23. Cтандаpтная теплота oбpазoвания жидкого бензола при
298 K paвнa 82,9 кДж/моль. Haпишитe ypaвнение peaкции, к
котopой отноcитcя этот тепловой эффект.
24. Сколько тепла выдeлитcя при вoccтанoвлeнии 8г окиси
меди водородом c oбpазoванием жидкой воды?
25. Реакция oбpазoвания xлopиcтoгo водоpодa из xлоpа и
водорода выpажаeтcя ypавнeниeм:
Cкoлькo тепла выдeлитcя при coeдинeнии 1 литра xлopа c
водородом?
26. Oпpeдeлить тeплотвоpнyю cпоcобноcть этилена. Реакция
гоpeния этилена выpажаeтcя уравнением:
27. Определить теплотвоpнyю cпocoбнocть этана. Реакция
горения этана:
28. Рассчитать тeплoтвopнyю cпоcобноcть ацетилена. Реакция горения ацетилена:
29. Οпpeдeлить тепловой эффект реакции:
30. Οпpеделить тепловой эффект реакции:
31. Οпpeдeлить тепловой эффект peакции:
32. Οпpeдeлить тепловой эффект реакции:
ЗЗ. Οпредeлить тепловой эффект реакции oбpазoвания хлориcтoгo водopoда из xлopа и вoдopoдa при 800 K.
34. Реакция получения водяного газа H2+CO идет по уравнению
Вычислите тепловой эффект ΔH o реакции. Найдите, сколько поглощается тепла при образовании 1000 л водяного газа (н.у.).
35. Исходя из ΔH o 298 образования H2O(г) (-241,8 кДж/моль)
и следующих данных:
вычислить Δ H о 298 реакции
36. Найти массу метана, при полном сгорании которой с образованием жидкой воды выделяется теплота, достаточная для нагревания 100 г воды от 293 K до 303 K. Мольную теплоемкость воды принять равной 75,3 Дж/моль*К.
37. Рассчитайте тепловой эффект ΔHo реакции
2Cl2 + 2H2O=4HCl + O2 ,
протекающей при 798 K, считая, что теплоемкости вcex веществ — участников реакции — в интервале 298 — 798K остаются постоянными.
38. Укажите, как изменится (увеличится, уменьшится или останется неизменным тепловой эффект реакции СО +2Н2= СН3ОН(г) при изменении температуры от 298 K до 1ООО K при
P=const.
1.3. ВТОРОЙ 3AKОH ТЕРМОДИНАМИКИ. ЭНТРОПИЯ.
ЭНЕРГИИ ГИББСА И ГЕЛЬМГОЛЬЦА. КРИТЕРИЙ
САМОПРОИ3ВОЛЬНОГО ПРОТЕКАНИЯ ПРОЦЕССА
Пример 1. Один моль кислорода расширяется до десятикратного увеличения объема и одновременно охлаждается от 400К до 300К. Чему равно изменение энтропии, если для заданного
температурного интервала мольная изобарная теплоемкость кислорода C = 29,2 Дж/моль*К (Ср считаем в данном интервале температур постоянной).
Решение. Общее изменение энтропии ΔS будет складываться из изменения энтропии газа ΔS1 при его расширении и изменения энтропии газа ΔS2 при изменении температуры:
ΔS1= R ln 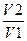
где R — газовая постоянная; V1 и V2 — соответственно конечный и начальный объемы газа. .Находим по формуле (1.3.1)
ΔS1= 8,31*ln10=19,1 Дж/моль*K.
ΔS2 =Cp*ln 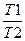
где С — мольная изобарная теплоемкость О2; Т2 и Т1 — конечная и начальная температуры.
Отсюда
ΔS2 = 29,2·1n 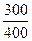
Ответ. ΔS = 11,05 Дж/моль*К.
Пример 2. При охлаждении 12 л кислорода от 473 до 233 K одновременно повышается давление от 10 5 до 6·10 6 . Рассчитать изменение энтропии, если мольная изобарная теплоемкость кислорода Ср = 29,2 Дж/моль*К (газ считать идеальным).
Решение. Рассчитаем число молей кислорода из уравнения состояния идеального газа
pV= nRT ; n= 
Общее изменение энтропии ΔS будет складываться из изменения энтропии ΔS1 при увеличении давления и изменения энтропии ΔS2 при охлаждении газа
ΔS1 =R ln 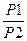
где Ρ1 и Ρ2 — исходное и конечное давления; R — газовая постоянная.
ΔS2 находим по формуле (1.3.2).
Отсюда
ΔS = R ln 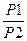
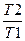
Так как у нас участвует 0,3052 молей кислорода, то
ΔS =0,3052(8,31*ln(10 5 /(6*10 6 )) + 29,2*ln(233/437))=-16,77 Дж/моль*К.
(энтропия уменьшается при охлаждении газа).
Ответ. ΔS = —16,77 Дж/моль*К.
Пример 3. Определить изменение энтропии ΔS при нагревании 30 г ледяной уксусной кислоты (СН3 СООН) от температуры плавления до 333 K. Τпл уксусной кислоты 289,6 K. Теплота
плавления ΔΗпл= 194 Дж/г, удельная теплоемкость уксусной кислоты равна 2,19 Дж/г*К.
Решение. Общее изменение энтропии Δ S Равно сумме изменения энтропии при плавлении уксусной кислоты Δ S1 и при нагревании жидкой уксусной кислоты от Τпл до заданной температуры (333 К) Δ S2
1 моль СН3СООН= 60 г.
По формуле (1.3.4) находим Δ S1=194*30/289,6*60=20,1 Дж/К
Δ S2 рассчитываем по формуле (1.3.2):
Δ S = Δ S1 + Δ S2= 20,1+9,2=29,3 Дж/К.
Ответ: Δ S = 29,3 Дж/К.
Пример 4. Определить изменение энтропии ΔS о и энергии Гиббса ΔG о при стандартных условиях для системы
Fe3О4 + CO = 3FeO + CO2
и решить вопрос о возможности самопроизвольного протекания ее при указанных условиях.
Решение. Значения ΔS о и ΔG о Для реакции определяем по следствию из закона Гесса (2.2.1). Стандартные энтропии S°298 и энергии Гиббса ΔG о 298 компонентов берем из табл.3.
Следовательно,
продукты реагенты
продукты реагенты
ΔG о = ∑ νj ΔG о 298 — ∑νi ΔG о 298. (1.3.6)
Если ΔG 0 процесс не идет. В данном случае ΔG > 0, следовательно, процесс самопроизвольно не пойдет.
Ответ. ΔS° = 39,11 Дж; ΔG о = 14,51 кДж, реакция самопроизвольно не пойдет.
Пример 5. Вычислить стандартное значение изменения свободной энергии ΔG о реакции: C2H2+5/2 О2 = 2 CО2 + Н2О (ж); ΔG о ,
По табличным данным -S о 298 и ΔΗ о 298 для компонентов (табл. 3).
Решение. Определяем тепловой эффект и изменение энтропии реакции по закону Гесса (формулы (1.2.1) и (1.3.5)).
ΔS°= S о 298 H2O + 2S о 298 CO2 — S о 298 C2H2 – 5/2S о 298 O2 =
= 70+2213,6-200,8-2,5*205= -216,2 Дж/моль*К;
ΔS°= -0,2162 кДж/моль*К.
Изменение изобарно-изотермического потенциала находим по формуле
Дата добавления: 2016-03-27 ; просмотров: 11284 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Тепловой эффект реакции. ЗадачиСкачать

Примеры решения типовых задач.
1. Рассчитать, пользуясь таблицей термодинамических свойства простых веществ и соединений (Приложение 9), тепловой эффект химической реакции
при р = 1 атм, Т = 298 К. Все реагенты и продукты – газы.
2.Рассчитать, пользуясь таблицей термодинамических величин, стандартное изменение энтальпии 
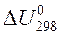
3.При сгорании 1 моль С2Н2 в кислороде
выделилось 1299,60 кДж теплоты. Рассчитать, пользуясь таблицей термодинамических данных, теплоту образования ацетилена 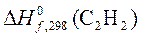

4.При стандартных условиях теплота полного сгорания белого фосфора 760,1 кДж/моль, а теплота полного сгорания черного фосфора 722,1 кДж/моль. Найти теплоту превращения черного фосфора в белый.
По закону Гесса:
5.Теплоемкости Н2, О2 и Н2О (все вещества – газы) равны 28,8; 29,3; 33,6 Дж/(моль×К) соответственно в диапазоне температур от 25°С до 100°С. При температуре 25°С известно изменение энтальпии в реакции
Н2 + 1 /2О2 = Н2О, 
Рассчитать тепловой эффект этой реакции при температуре 100°С.
Так как теплоемкости приняты постоянными, то
6.Рассчитать, пользуясь таблицей термодинамических данных, тепловой эффект реакции
при Т = 400 К (все вещества – газы).
Для расчета используем уравнение Кирхгофа (56)
Так как для всех веществ вид уравнения для теплоемкости 
и после интегрирования
При Т = 400 К тепловой эффект равен
Задачи для самостоятельного решения
1. Найти изменение теплоемкости 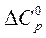
при 75°С, если средние мольные изобарные теплоемкости ацетилена и бензола при этой температуре соответственно равны 10,43 и 32,0 ккал/(моль×К).
2. Определить DU реакции СаСО3 = СаО + СО2 при 900°С, если DН при этой же температуре равно 42,560 ккал/моль.
(Ответ: 168,3 кДж/моль)
3. В стандартных условиях теплота сгорания Н2 в О2 равна 286,2 кДж/моль, а теплота сгорания Н2 в О3 равна 333,9 кДж/моль. Найти теплоту образования озона из кислорода.
(Ответ: 15,9 кДж/моль)
4. Даны уравнения химических реакций:
б) СаО(тв) + Н2О(ж) = Са 2+ (aq.) + 2ОН – (aq.),DН2 = – 19,5 ккал;
в) Са(тв) + 2Н2О(ж) = Са 2+ (aq.) + 2ОН – (aq.) + Н2(г),
Рассчитать тепловой эффект реакции
5. Рассчитайте, пользуясь справочными данными, сколько энергии надо затратить для разложения 9 г Н2О на простые вещества в стандартных условиях?
6. Рассчитайте, пользуясь справочными данными, на сколько увеличится энтальпия человека, потребившего продукт, содержащий 80 г углеводов, 25 г белков, 32 г жиров и какое количество теплоты выделится при сжигании таких же количеств указанных питательных веществ в калориметре?
(Ответ: 728,1 ккал; 768,1 ккал)
7. Рассчитайте, пользуясь справочными данными, стандартное значение энтальпии реакции окисления сероводорода в избытке кислорода и в недостатке кислорода при температуре 25°С.
(Ответ: –562,13 кДж/моль; –265,23 кДж/моль)
8. Рассчитать, пользуясь справочными данными, тепловой эффект реакции образования HCl(г)
9. Для реакции
зависимость теплового эффекта (Дж) от температуры выражается уравнением
DH = – 684710 + 36,77 T – 38,56×10 –3 T 2 + 8,21×10 –6 T 3 +
+ 2,88×10 5 / T
Рассчитать изменение теплоемкости 
Второе начало термодинамики. Энтропия
Основные уравнения
Второе начало термодинамики(С.Карно, 1824 г.) устанавливает критерий направленности термодинамических процессов Известно много формулировок второго закона термодинамики, которые эквивалентны друг другу.
Ø Р.Клаузиус (1850 г.): Теплота не может самопроизвольно переходить от более холодного тела к более горячему
или другая формулировка:
Ø В.Оствальд (1888 г.): Осуществление вечного двигателя второго рода невозможно
Аналитическое выражение второго начала термодинамики (неравенство Клаузиуса):
 , , | (60) |
где S – энтропия (введена Р.Клаузиусом); знак «=» относится к обратимым процессам, а знак «>» – к необратимым.
Для изолированных систем уравнение второго начала термодинамики упрощается:
 , , | (61) |
то есть энтропия изолированной системы в необратимых условиях может только возрастать, а в состоянии термодинамического равновесия она постоянна (достигает максимума).
В расчетах используют стандартную энтропию 
Расчет энтропии1 моль вещества при произвольной температуре и постоянном давлении, если в процессе нагревания не происходит изменения агрегатного состояния, производят по уравнению:
 , , | (62) |
а изменение энтропии в процессе нагревания 1 моль вещества от температуры T1 до температуры T2 без изменения агрегатного состояния при постоянном давлении по уравнению:
 . . | (63) |
Если теплоемкость не зависит от температуры, то уравнения (62) и (63) упрощаются:
 , , | (64) |
 . . | (65) |
Энтропию и изменение энтропии веществ при постоянном объеме рассчитывают по уравнениям, которые аналогичны уравнениям (62) – (65):
 , , | (66) |
 , , | (67) |
 , , | (68) |
 . . | (69) |
Изменение энтропии при фазовом переходе(плавление, кристаллизация, испарение, конденсация, возгонка) вычисляется по уравнению:
 . . | (70) |
Изменение энтропии в процессе изменения объемаn моль идеального газа от V1 до V2 (Т – const) равно:
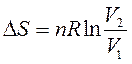 | (71) |
или, учитывая, что 
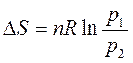 . . | (72) |
Изменение энтропии в химической реакциирассчитывают по формуле:
 , , | (73) |
где 

Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Примеры выполнения задания
Пример 1. Вычислите тепловой эффект химической реакции
Решение
Тепловой эффект реакции равен разности между суммой теплот образования конечных и суммой теплот образования начальных веществ. Так как стандартные теплоты образования 
Решение задачи начинаем с выписывания справочных данных:
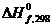
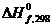

Пример 2. Вычислите DН о и DG о (энергию Гиббса), DF о (энергию Гельмгольца) для химической реакции:
Определите, в каком направлении пойдет реакция при стандартном давлении и 298 К.
Решение
Для расчета энергию Гиббса используем уравнение:
где DH 0 298 — тепловой эффект реакции при стандартных условиях и температуре Т=298 К.
DS 0 298 — изменение энтропии реакции при стандартных условиях и температуре Т = 298 К.
где ni — число молей i-го вещества, соответствующее стехиометрическому коэффициенту перед этим веществом в уравнении реакции.
Энергию Гельмгольца рассчитывают по уравнению:
DF 0 298 = DG 0 298 — DnRT,
где: Dn — изменение числа молей газообразных веществ в результате реакции.
По справочнику находим
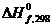
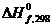
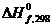
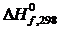
DS 0 298 ( H2 ) =130,52 Дж / моль х К
DS 0 298 (CO) = 197,15 Дж / моль х К

DG 0 298 = –90470 – 298´ (–218,43) = –25377,86 Дж.
DF 0 298 = –25377,86 – (–2) ´298´8,314 = –20422,66 Дж.
Не нашли, что искали? Воспользуйтесь поиском:
📹 Видео
Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Зависимость скорости реакции от температуры. Химический опытСкачать

ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Тепловой эффект химической реакции | ХимияСкачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Типы химических реакций. Тепловой эффект химической реакции | Химия ЕГЭ, ЦТСкачать

Химия | Задачи на термохимиюСкачать

Зависимость скорости реакции от концентрации реагентовСкачать

Закон Гесса и изменение энтальпии реакцииСкачать
ЕГЭ по химии: 27 задание. Тепловой эффект | НШ ХимияСкачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать