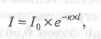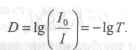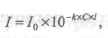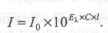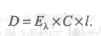При прохождении через слой вещества (в частном случае раствора) светового потока с интенсивностью 10 его интенсивность вследствие поглощения в слое, отражения и рассеяния уменьшается до значения I. Интенсивность падающего светового потока I0 и светового потока I, прошедшего через раствор, можно определить экспериментально.
Связь между интенсивностями световых потоков I0 и I устанавливается законом Бугера-Ламберта, согласно которому однородные слои одного и того же вещества одинаковой толщины поглощают одну и ту же долю падающей на них световой энергии (при постоянной концентрации растворенного вещества). Материалистически этот закон выражается уравнением экспоненциальной зависимости:
где е — основание натуральных логарифмов;
к — коэффициент поглощения;
l — толщина поглощающего слоя.
Отношение I/I0 называют пропусканием (Т); его значения могут изменяться от 0 до 1. Часто эту величину выражают в процентах. Если величина Т отнесена к толщине слоя в 1 см, то ее называют коэффициентом пропускания. Поглощение излучения характеризуют оптической плотностью:
Связь между концентрацией поглощающего раствора и его оптической плотностью lg (I0/I) выражается законом Бера, согласно которому оптическая плотность раствора прямо пропорциональна концентрации растворенного вещества при постоянной толщине слоя:
где к1 — коэффициент пропорциональности;
С — концентрация растворенного вещества.
Зависимость монохроматического светового потока, прошедшего через слой окрашенного раствора, от интенсивности падающего потока света, концентрации окрашенного вещества и толщины раствора определяется объединенным законом Бугера-Ламбера-Бера, который является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа.
где к — коэффициент светопоглощения, зависящий от природы растворенного вещества, температуры, растворителя и длины волны света.
Если концентрация С выражена в молях на литр, a l — в сантиметрах, то к представляет собой молярный коэффициент светопоглощения и обозначается Ел. Основной закон светопоглощения в этом случае будет иметь следующий вид:
При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропорциональна молярному коэффициенту светопоглощения, концентрации поглощающего вещества и толщине слоя раствора:
При графическом изображении зависимость оптической плотности от концентрации (при постоянном значении д) С получается прямая линия. Эта прямая проходит через начало координат при отсутствии поглощения света растворителем и систематических погрешностей (рис. 2.1).
Видео:Плотность вещества | Физика 7 класс #15 | ИнфоурокСкачать

Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.
Видео:Плотность вещества и единицы измерения плотности. 7 класс.Скачать

Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Видео:Плотность вещества и единицы измерения плотности. Практическая часть - решение задачи. 7 класс.Скачать
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10 -ε·С·ι , где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.
Видео:Молярная концентрация вещества в раствореСкачать

Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Видео:Введение в спектрофотометриюСкачать
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.
Видео:Занятие 10. ФотометрияСкачать

Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Видео:Урок 54 (осн). Экспериментальное определение плотности раствора солиСкачать

Модуль 3. Лекция 1. Оптические методы анализа
Модуль 3. Лекция 1. Оптические методы анализа.
Дифференциальный фотометрический анализ. Сущность метода, способы определения концентраций (расчетный метод, метод градуировочного графика).
Дифференциальная спектрофотометрия (фотометрия). Если светопоглощение анализируемого раствора измеряют по отношению к среде сравнения (раствор сравнения, диафрагма, оптический клин), оптическая плотность А которой существенно больше нуля (например, А = 0,1‒1,0), то такой спектрофотометрический метод называют дифференциальной спектрофотометрией, или дифференциальным фотометрическим анализом.
Одно из основных достоинств дифференциальной спектрофотометрии состоит в уменьшении ошибки спектрофотометрических определений. Поэтому дифференциальную спектрофотометрию иногда называют прецизионной спектрофотометрией.
Дифференциальная спектрофотометрия используется, в частности, при получении ИК спектров поглощения таких веществ, у которых наблюдается большое общее рассеивание света, вследствие чего светопропускание в ИК области сильно понижается (иногда до 10−20%), спектры получаются нечеткими, полосы поглощения трудно идентифицируются. Для устранения этого явления в канал сравнения вводят диафрагму, перекрывающую часть светового потока. При этом шкала пропускания расширяется и ИК спектры поглощения получаются более четкими полосы поглощения идентифицируются надежно.
Среди различных вариантов дифференциальной спектрофотометрии в аналитической практике распространен простой способ, когда оптическую плотность анализируемого раствора измеряют по отношению к раствору сравнения, содержащему то же определяемое вещество, что и анализируемый раствор, но с несколько меньшей концентрацией. В этом случае измеряемая относительная оптическая плотность Ах равна разности оптической плотности анализируемого раствора и оптической плотности А0 раствора сравнения.
Метод используют тогда, когда концентрация раствора − большая (десятки процентов) и оптическая плотность − высока. При высокой оптической плотности возрастает ошибка непосредственных спектрофотометрических определений. Применение же раствора сравнения, также содержащего определяемое вещество, позволяет уменьшить измеряемую относительную оптическую плотность Ах анализируемого раствора, расширить протяженность шкалы светопропускания и снизить ошибку определений до нескольких десятых долей процента.
Наименьшую ошибку получают тогда, когда разность оптических плотностей измеряемого раствора и раствора сравнения минимальна, а оптическая плотность раствора сравнения − высокая, вплоть до А = 1. Однако на практике все же приходится избегать применение раствора сравнения с очень высоким светопоглощением, так как при этом уменьшается энергия светового потока, попадающего в приемник излучения, вследствие чего работа приемника излучения становится менее устойчивой, уменьшается отношение сигнал: шум (уровень шумов обусловлен особенностями конструкции спектрофотометра). Для увеличения энергии светового потока приходится увеличивать ширину щели спектрофотометра.
Сущность метода состоит в следующем.
Готовят ряд (пять‒десять) эталонных растворов определяемого вещества с различной, точно заданной концентрацией с0, с1, с2, . сn. Вначале при выбранной длине волны в оба канала спектрофотометра помещают одинаковые кюветы с одним и тем же эталонным раствором (концентраций определяемого вещества равна с0), относительно которого будут проводить последующие измерения, и устанавливают шкалу оптической плотности в положение А = 0.
Затем при той же постоянной аналитической длине волны измеряют оптическую плотность Аi (i = 1; 2; . ; n) каждого эталонного раствора и оптическую плотность Аx анализируемого раствора относительно эталонного раствора с концентрацией с0 и собственной оптической плотностью А0 (относительно чистого растворителя), после чего находят концентрацию с определяемого вещества в анализируемом растворе следующими способами.
Расчетный способ. При этом способе предполагается выполнимость основного закона светопоглощения. В соответствии с этим законом можно написать:
где ε ‒ молярный коэффициент погашения определяемого вещества, l ‒ толщина поглощающего слоя.
Рис. 1. Градуировочный график в методе дифференциальной спектрофотометрии для нахождения концентрации сх определяемого вещества в растворе по измеренной оптической плотности Ах.
Если ввести фактор пересчета F
то последнее уравнение можно переписать в виде:
Это уравнение и используют для расчета концентрации вещества на основании измерения Аx и при известной концентрации с0 эталонного раствора сравнения.
Фактор пересчета F находят по результатам измерений оптических в плотностей Аi эталонных растворов относительно эталонного раствора с концентрацией с0:
Рассчитывают среднее значение фактора пересчета


где n − число измеренных эталонных растворов.
Способ градуировочного графика. По полученным экспериментальным значениям 
Часто строят серию градуировочных графиков, используя каждый раз в качестве раствора сравнения эталонный раствор с постепенно увеличивающейся концентрацией определяемого вещества, с тем чтобы подобрать такой раствор сравнения, концентрация которого была бы наиболее близкой к концентрации анализируемого раствора.
Способом градуировочного графика можно пользоваться и тогда, когда наблюдаются отклонения от основного закона светопоглощения.
Дифференциальная спектрофотометрия в разных вариантах применяется при определении ряда металлов и неметаллов, органических соединений, лекарственных веществ. Так, разработаны варианты анализа методом дифференциальной спектрофотометрии многих двухкомпонентных смесей лекарственных веществ: кофеин и аспирин, кофеин и амидопирин, кофеин и фенацетин, теобромин и барбамил, теофиллин и барбамил, папаверина гидрохлорид и дибазол, папаверина гидрохлорид и кислота никотиновая ‒ и т. д.
Аналогичные методы применяются и в дифференциальной фотоэлектроколориметрии.
Чувствительность и погрешности фотометрического анализа
Чувствительность фотометрического анализа характеризуется минимальной концентрацией cmin определяемого вещества в анализируемом растворе, которую еще можно определить фотометрическим методом. Эту минимальную концентрацию можно оценить следующим образом.
В соответствии с основным законом светопоглощения имеем
где Аmin = 0,01 − минимальное значение оптической плотности, которое можно измерить на обычном спектрофотометре. При толщине поглощающего слоя l =1 см получаем:
Формула (1) позволяет оценить минимальную концентрацию определяемого вещества в анализируемом растворе по его молярному коэффициенту погашения. Максимально возможное значение молярного коэффициента погашения считают равным примерно ε ≈ 105 л∙моль-1∙см-1. Следовательно, минимальная концентрация, определяемая фотометрическим методом, может составлять
cmin ≈ 0,01/105 ≈ 10-7 моль/л
при толщине поглощающего слоя l = 1 см.
Погрешности фотометрического анализа. Ошибки фотометрического анализа зависят от ряда факторов: неточностей определения оптической плотности, толщины кювет и их установки в кюветном отделении прибора, фиксации позиций 0% и 100% пропускания на шкале прибора, нестабильности работы приемника излучения спектрального прибора и т. д. Учет всех источников ошибок фотометрических определений представляет собой сложную задачу.
Основной вклад в систематическую ошибку определения концентрации непосредственным фотометрическим методом вносит погрешность измерения оптической плотности (или пропускания), что обусловлено спецификой фотометрии.
Пусть dА и dс ‒ соответственно бесконечно малая абсолютная ошибка измерения оптической плотности А и концентрации раствора с. Если при аналитической длине волны не наблюдаются отклонения от основного закона светопоглощения в определенных пределах изменения оптической плотности и концентрации анализируемого раствора, то относительная процентная ошибка определения оптической плотности и относительная ошибка определения концентрации





где ε ‒ молярный коэффициент погашения определяемого вещества, l ‒ толщина поглощающего слоя.
Если выполняется основной закон светопоглощения, то относительная ошибка фотометрического определения концентрации будет зависеть от пропускания Т в соответствии с уравнением (2):


Докажем, что это, действительно, так. Как было показано ранее, оптическая плотность A и пропускание Т связаны между собой соотношением:
А = ‒ lgT = lg



Дифференцируя это уравнение по Т, получаем:



Разделим последнее уравнение слева и справа на оптическую плотность А:



поскольку А = ‒ lgT. Учитывая, что 



что совпадает с (2).
Минимуму функции (2) отвечает значение Т = 36,8% или А = 0,434, т. е. минимальная ошибка ∆min бывает тогда, когда фотометрические измерения проводят при A = 0,434, о чем и упоминалось ранее.
Для построения графика функции (2), т. е. зависимости dс/c от Т, приближенно полагают
где ∆Т ‒ конечное небольшое приращение Т. Эту абсолютную ошибку определения Т в расчетах задают равной какой-либо реально приемлемой постоянной величине, например, ∆Т = 0,005 (относительная процентная ошибка при этом будет равна (∆T/1)∙100% = 0,005∙100% = 0,5%).
Приближение dТ ≈ ∆Т = const не соответствует действительности, однако получаемая в результате расчетов кривая ошибок правильно отражает тенденцию в изменении ∆ в зависимости от изменения Т или А и позволяет количественно оценить оптимальный интервал изменения Т или А, в котором можно проводить фотометрические измерения с пониженной величиной ошибки ∆.
На рис. 2 представлен график функции (2), рассчитанный при dТ ≈ ∆Т = 0,005 (относительная процентная ошибка равна 0,5%).
Выше указывалось, что минимальной ошибке ∆min отвечает значение Т = 36,8% или А = 0,434. Обычно ошибку считают приемлемой, если ее величина не превышает 2∆min. Как следует из рассмотрения рис. 2, измерения в этом случае можно проводить при значении пропускания Т от
75%, т. е. в интервале изменения оптической плотности от
1,0. При таких значениях оптической плотности процентная относительная систематическая ошибка фотометрического определения концентрации раствора не превышает
±2%. При значениях А, меньших, чем 0,12, и больших, чем 1,0, относительная ошибка фотометрического определения концентрации раствора возрастает.
Рис. 2. Зависимость относительной систематической ошибки Д фотометрических измерений от величины пропускания Т при dT ≈ ∆T = 0,005
На практике предпочитают проводить измерения так, чтобы оптическая плотность анализируемого раствора лежала в интервале 0,2‒0,6.
Как указывалось ранее, систематическая ошибка понижается при переходе от непосредственной фотометрии к дифференциальной фотометрии ‒ до нескольких десятых долей процента.
Систематическая ошибка фотометрического анализа уменьшается также и в методах производной спектрофотометрии, а случайные погрешности ‒ возрастают. Поэтому тогда, когда систематическая ошибка превышает случайную, предпочтительно применение производной спектрофотометрии, что понизит систематическую ошибку метода.
2.3. Экстракционно-фотометрический анализ.
Сущность метода. Метод сочетает экстракцию и фотометрию. Сущность его состоит в следующем.
Пусть в анализируемом растворе содержится определяемое вещество. Это вещество извлекают из раствора с помощью того или иного экстрагента и получают экстракт, который фотометрируют при аналитической длине волны определяемого вещества, перешедшего в экстракт в той или иной химической форме.
Метод применяют тогда, когда либо прямое измерение светопоглощения анализируемого раствора не дает желаемых результатов, либо исходный анализируемый объект (мази, пасты, суспензии, твердые фазы и др.) невозможно фотометрировать.
Чаще всего экстракционно-фотометрический метод применяют в следующих случаях.
1) При определении компонента сложной смеси, когда другие присутствующие в смеси вещества мешают проведению анализа, например, поглощают свет при той же длине волны, что и определяемый компонент.
Подбирают такой экстрагент, содержащий или не содержащий экстракционный реагент, который селективно извлекает из анализируемого раствора только определяемый компонент, после чего измеряют светопоглощение экстракта при аналитической длине волны определяемого компонента.
2) При определении веществ, малорастворимых в воде, но хорошо растворяющихся в подходящем органическом растворителе, не смешивающемся с водой, с помощью которого и проводят экстракцию определяемых веществ и измерение их оптической плотности в экстракте.
3) При определении веществ, содержащихся в анализируемом растворе в малых концентрациях, недостаточных для измерения их светопоглощения. В таких случаях проводят концентрирование, экстрагируя определяемое вещество из сравнительно большого объема исходного анализируемого раствора в малый объем экстрагента. При этом концентрация определяемого вещества в экстракте повышается, вследствие чего становится возможным измерение оптической плотности экстракта при аналитической длине волны определяемого вещества.
4) При определении бесцветных веществ, содержащихся в анализируемом растворе. В этих случаях селективную экстракцию проводят экстрагентом, содержащим такой экстракционный реагент, который образуется с определяемым веществом окрашенный продукт фотометрической реакции, переходящий в фазу экстрагента. Затем проводят измерение светопоглощения экстракта при аналитической длине окрашенного продукта фотометрической реакции.
Встречаются и другие ситуации, в которых целесообразно применение экстракционно-фотометрического анализа.
При использовании экстракционно-фотометрического метода необходимо, чтобы степень извлечения определяемого вещества из исходного анализируемого раствора экстрагентом была бы количественной, т. е. чтобы в экстракт переходило не менее 99,9% определяемого вещества. Это достигается путем выбора подходящих органических экстрагентов, экстракционных реагентов, фотометрической реакции, создания оптимального значения pH в исходном анализируемом растворе, введения маскирующих реагентов и т. д.
Экстракционно-фотометрический метод позволяет определять многие вещества (особенно ‒ катионы металлов-комплексообразователей), включая фармацевтические препараты (например, преднизалон и преднизалона ацетат в мазях), обладает большой избирательностью (селективностью), высокой чувствительностью, относительной простотой и быстротой проведения анализа.
Фотометрические реакции в экстракционно-фотометрическом анализе. Большое значение в экстракционно-фотометрическом методе имеет выбор фотометрической реакции, в результате которой определяемое вещество переходит в продукт реакции, обладающий в спектре поглощения достаточно интенсивным максимумом при длине волны, которая может быть принята за аналитическую.
Наиболее часто используют следующие два типа фотометрических реакций.
1)_Фотометрические реакции образования окрашенных комплексных соединений металлов. В анализируемый раствор (обычно ‒ водный), содержащий определяемый катион металла, вводят реагент, образующий окрашенный комплекс с определяемым катионом металла. Этот комплекс извлекают подходящим органическим экстрагентом.
Так, катионы свинца(II) Рb2+ можно определять в присутствии в водном растворе ряда катионов, проводя реакцию с дитизоном в слабощелочной среде при pH = 8,5‒11. Катионы Pb2+ в дитизонатный комплекс свинца карминово-красного цвета по схеме:
Pb2+ + 2H2Dz = Pb(HDz)2 +2Н+
где H2Dz ‒ краткое обозначение молекулы органического реагента дитизона.
Образовавшийся окрашенный комплекс селективно экстрагируют хлороформом или тетрахлоридом углерода; дитизон при этом не экстрагируется.
В спектре поглощения раствора дитизонатного комплекса свинца (II) имеется максимум при длине волны 520 нм (ε = 7∙104 л∙моль-1∙см-1), при которой и проводят измерение светопоглощения экстракта. В присутствии маскирующего реагента ‒ цианид-ионов CN− ‒ определению катионов свинца (II) мешают только катионы таллия (I), олова (II) и висмута (III); большинство других катионов не мешает определению свинца (II). В качестве маскирующих реагентов применяют также цитрат и тартрат натрия.
Фотометрические реакции с образованием дитизонатных комплексов используют при экстракционно-фотометрическом определении целого ряда других катионов металлов.
При экстракционно-фотометрическом определении малых количеств (
40‒120 мкг в анализируемом растворе) катионов никеля (II) Ni2+ можно проводить фотометрическую реакцию образования окрашенного в красный цвет в водном растворе комплекса никеля (II) с органическим реагентом ‒ диметилглиоксимом (СН3—C=N—ОН)2 в слабо-щелочной среде по схеме
Ni2+ + 2HДМГ = Ni(ДМГ)2 + 2H+
где НДМГ ‒ сокращенное обозначение молекулы диметилглиоксима. Образовавшийся комплекс экстрагируют хлороформом, в котором диметилглиоксиматный комплекс никеля (II) окрашен в желтый цвет, и измеряют светопоглощение экстракта при аналитической длине волны 364 нм (ε = 3,5∙103 л∙моль-1∙ см-1).
Коэффициент распределения никеля (II) в данной системе между хлороформом и водной фазой равен
320, поэтому можно ограничиться однократной экстракцией.
Фотометрические реакции образования комплексных соединений используют при определении кобальта (II) в виде комплексов с нитрозонафтолами, алюминия ‒ с 8-оксихинолином, меди (II) ‒ с диэтилдитиокарбаминатом свинца (вариант обменной экстракции; в данном случае ‒ катионов свинца на катионы меди) и во многих других случаях.
2) Фотометрические реакции образования окрашенных ионных ассоциатов. Определяемое вещество переводят в окрашенный продукт, содержащий катионы или анионы относительно большого размера, проводя фотометрические реакции с кислотными или основными красителями.
Подобные реакции − высокочувствительны; образующиеся ионные ассоциаты обладают большой молярной массой и имеют в спектре поглощения интенсивные полосы с высоким значением молярного коэффициента погашения ε ≈ 104−105 л∙моль-1∙см-1.
Так, при экстракционно-фотометрическом определении сурьмы (V) ее вначале переводят в водном солянокислом растворе в бесцветные комплексные анионы [SbCl6]−, имеющие сравнительно большие размеры. При реакции с окрашенным органическом реагентом − кристаллическим фиолетовым, также достаточно крупного размера, эти комплексные анионы образуют интенсивно окрашенные ионные ассоциаты R+[SbCl6]− по схеме:
[SbCl6]− + R+ = R+[SbCl6]−
где R+ − сокращенное обозначение однозарядного катиона кристаллического фиолетового. Образовавшиеся ионные ассоциаты экстрагируют толуолом (свободный краситель кристаллический фиолетовый не экстрагируется) и получают экстракт, в спектре поглощения которого ионному ассоциату принадлежит интенсивный максимум при длине волны 660 нм (ε = 5∙104 л∙моль-1∙см-1), при которой и проводят измерение светопоглощения экстракта.
Железо (III) в присутствии соединений кобальта можно определить, экстрагируя вначале его из водного солянокислого раствора в форме HFeCl4 дибутиловым эфиром с последующей реэкстракцией раствором комплексона III в водную фазу, в которую прибавляют 1,10-фенантролин, гидрохлорид гидроксиламина и иодид калия. В реэкстракте − водной фазе − образуется ферроиниодид. Затем ферроиниодид экстрагируют хлороформом и к хлороформному экстракту прибавляют краситель − бромфеноловый синий, создавая ацетатным буфером щелочную среду (pH = 8,8). При этом в экстракте образуется ионный ассоциат ферроина с анионом бромфенолового синего. Экстракт затем фотометрируют при 610 нм − аналитической длине волны ионного ассоциата.
2.4. Понятие о фотометрическом титровании
Метод основан на определении конца титрования по резкому изменению светопоглощения титруемого раствора в точке эквивалентности или вблизи ее. Титрование проводят, последовательно измеряя светопоглощение титруемого раствора при прибавлении к нему титранта при аналитической длине волны, соответствующей максимуму в спектре поглощения либо титруемого вещества, либо титранта, либо продукта титриметрической реакции (безындикаторное титрование), либо прибавленного индикатора (индикаторное титрование).
По результатам измерения светопоглощения титруемого раствора строят кривую титрования в координатах оптическая плотность А ‒ объем прибавленного титранта V(Т). Резкий излом на кривой титрования, соответствующий концу титрования, наблюдается сравнительно редко. Чаще конец титрования находят экстраполяцией линейных участков кривой титрования. Точка пересечения экстраполяционных прямых отвечает концу титрования.
Иногда фотометрическим титрованием называют титрование с измерением светопоглощения на фотоколориметрах (фотоэлектроколори-метрах), а спектрофотометрическим − титрование с измерением светопоглощения на спектрофотометрах. Оба этих варианта можно назвать одним термином − фотометрическое титрование, независимого от того, на каких приборах проводится измерение оптической плотности.
Метод обладает селективностью, большей чувствительностью по сравнению с другими титриметрическими методами, более высокой точностью, чем непосредственная фотометрия растворов с постоянной концентрацией, позволяет использовать реакции с не очень высокими константами равновесия при температуре титрования и малостойкими продуктами реакции, проводить определение при длине волны, при которой поглощают и другие компоненты раствора (поскольку конец титрования фиксируется по изменению светопоглощения, а не по абсолютному значению оптической плотности раствора).
На практике фотометрическое титрование проводят как с использованием специальных фотометрических титраторов, так и без таковых.
Метод можно применить, например, при безындикаторном фотометрическом титровании перманганат-ионов MnO4− раствором, содержащим железо (II), в кислой среде. При титровании протекает окислительно-восстановительная реакция
MnO4− + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Измерение_оптической_плотности_раствора_проводят_при_аналитической длине волны 528 нм перманганат-иона (ε = 2400 л моль-1 см-1). По мере прибавления раствора, содержащего железо(II), к титруемому раствору перманганата калия оптическая плотность А титруемого раствора постепенно уменьшается (рис. 3.) до тех пор, пока прореагируют все перманганат-ионы. При дальнейшем прибавлении раствора титранта оптическая плотность титруемого раствора меняется уже несущественно (за счет разбавления раствора).
Рис. 3. Кривая фотометрического титрования раствора перманганата калия раствором, содержащим железо(II):
А − оптическая плотность раствора, V(Fe2+) − объем прибавленного титранта. Прямые 1 и 2 соответствуют изменению А до и после ТЭ. Крестиками обозначены экспериментальные точки
Объем раствора V(ТЭ) титранта, соответствующий точке эквивалентности, определяется точкой пересечения прямых 1 и 2 на рис. 3 можно, как обычно, описать уравнениями прямой линии:
где А1 и А2 − оптическая плотность; а1, а2, b1, b2 − коэффициенты; V − объем прибавленного титранта. В точке пересечения прямых A1 = A2 и V = V(ТЭ), поэтому
V(ТЭ) = 
Коэффициенты а1, а2, b1, b2 можно рассчитать, например, используя метод наименьших квадратов из полученных экспериментальных данных, по которым построены прямые линии.
Метод фотометрического титрования предложен для определения циркония (IV) − титрованием раствором органического реагента арсеназо III при 670 нм в растворе хлорной кислоты HClO4 или раствором паранитробензолазопирокатехина при 510 нм также в среде хлорной кислоты; для определения меди(II) − титрованием комплексона III при 745 нм в среде ацетатного буфера; для определения редкоземельных элементов − титрованием растворов их комплексов с органическим реагентом арсеназо I раствором комплексона III при 545 нм и во многих других случаях.
💥 Видео
Определение концентрации вещества в растворе методом титриметрииСкачать

4.Молярность и нормальность растворов. Подготовка к олипиадам по химии 8-9 класс.Скачать

Оптические методы анализа. Часть 2.Скачать

Полный гайд по титрованию с Игнатом Тарабриным | AllesСкачать

5.4. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразованияСкачать

Почему я не знал об этом раньше!!! Как разводить жидкое стекло с пескомСкачать

Плотность веществаСкачать

Плотность веществаСкачать

Химия 8 Способы выражения концентрации растворовСкачать

Химия. СпектрофотометрияСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

03 07 Динамический диапазон и оптическая плотностьСкачать

Анализ и контроль качества на фарм. про-ве. Растворы и способы их приготовленияСкачать