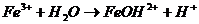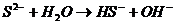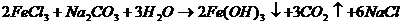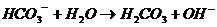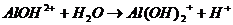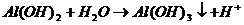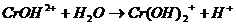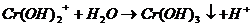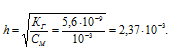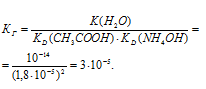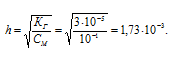1.4. Гидролиз солей
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции ( pH ) среды.
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого вещества. В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Рассмотрим различные случаи гидролиза солей.
а) Соль образована слабой кислотой и сильным основанием ( K 2 S ).
При растворении в воде K2S диссоциирует
K2S
При составлении уравнений гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды в малодиссоциирующие соединения, т.е. ионы, обусловливающие гидролиз.
В данном случае ионы S 2- связывают катион H + , образуя ион HS –
S 2– +H2O
Уравнение гидролиза в молекулярной форме
K2S + H2O
Практически гидролиз соли преимущественно ограничивается первой ступенью с образованием кислой соли (в данном случае KHS). Таким образом, гидролиз соли, образованной сильным основанием и слабой кислотой (такой, как K2S) протекает по аниону соли. Избыток ионов OH – в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
При растворении в воде CuCl2 диссоциирует
СuCl2
Ионы Cu 2+ соединяются с ионами OH – , образуя гидроксоионы CuOH + . Гидролиз соли ограничивается первой ступенью, и образование молекулы Cu(OH)2 не происходит. Ионно-молекулярное уравнение имеет вид
Cu 2+ + HOH
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом
CuCl2 + H2O
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой (в данном случае CuCl2) протекает по катиону соли. Избыток ионов H + в растворе обусловливает кислую реакцию среды в растворе (рН
При растворении в воде Al 2 ( SO 4 )3 диссоциирует
Al 2 ( SO 4 )3
В данном случае ионы Al 3+ соединяются с ионами ОН — , образуя гидроксоионы AlOH 2+ . Гидролиз соли ограничивается первой ступенью, и образование молекулы Al ( OH )3 не происходит. Ионно-молекулярное уравнение имеет вид
Al 3+ + Н2О 
Продуктами электролиза является основная соль и кислота.
Уравнение гидролиза в молекулярной форме записывается следующим образом
Al2(SO4)3+2 Н 2 О 
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4).
CH3COO – + NH4 + + H2O 
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания. Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса небходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
г) Соли, образованные сильной кислотой и сильным основанием ( NaCl , K 2 SO 4 , RbBr и др.) гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O (рН=7). Растворы этих солей имеют нейтральную среду. Например
NaCl + H 2 O 
Na + + Cl – + H2O 
H 2 O 
Реакции обратимого гидролиза полностью подчиняются принципу Ле–Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды;
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н + и ОН – , которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH 4 CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH 3 и воды:
NH4 + + CN – + H2O 
Гидролиз можно подавить , действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор ( для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислая, или подщелачивать, если щелочная.
Взаимное усиление гидролиза Допустим, что в разных сосудах установились равновесия
CO3 2– + H2O 
Al 3+ + H2O 
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H + и OH – . В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, гидролиз усиливается и протекает полностью
Это называется взаимным усилением гидролиза. Таким образом, если смешивать растворы солей, из которых одна гидролизуется по катиону, а другая – по аниону, гидролиз усиливается и протекает полностью.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Вывод: в результате реакции взаимного усиления гидролиза образуется слабое основание и слабая кислота.
Общие сведения.
Гидролизом называют процесс химического взаимодействия солей с водой. Продуктами гидролиза являются малодиссоциированные соединения в растворе, иногда – осадки или газы. Соответственно соли, образованные сильной кислотой и сильным основанием, не гидролизуются.
Различают три типа гидролизующих солей:
1. Соли, образованные сильной кислотой и слабым основанием,
гидролизуются по катиону.
2. Соли, образованные слабой кислотой и сильным основанием, гидролизуются по аниону с образованием слабой кислоты или иона кислой соли.
3. Соли, образованные слабой кислотой и слабым основанием, гидролизуются по обоим составляющим их ионам с образованием сразу двух слабых электролитов.
Степень гидролиза солей зависит от ряда факторов, определяемых принципом Ле-Шателье.
1.Чем слабее кислота или основание, образующиеся в результате гидролизе, тем выше глубина протекания процесса.
2.С увеличением количества воды, то есть с разбавлением раствора, степень гидролиза возрастает.
3.Поскольку гидролиз всегда протекает с поглощением тепла, является эндотермической реакцией, степень гидролиза повышается при нагревании раствора.
4.Гидролиз солей первой группы может быть подавлен добавлением кислоты, а во второй группе солей – добавлением щелочи.
5.При смешивании растворов солей первой и второй групп происходит взаимное усиление гидролиза.
Опыт 1.
Гидролиз солей.
В отдельные пробирки налить по 3-4 капли растворов хлорида железа (III), сульфата цинка, сульфата алюминия, карбоната натрия и сульфида натрия. Добавить
по 1-2 капли лакмуса и записать в таблицу окраску каждого из растворов этих солей. Вылить содержимое пробирок, промыть их дистиллированной водой и вновь налить указанные выше растворы. Добавить по 1-2 капли фенолфталеина и записать окраску растворов.
| Номер опыта | Формула соли | Окраска лакмуса | Окраска фенол- фталеина | Характер раствора |
| № 1 № 2 № 3 № 4 № 5 |   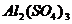   | красный фиолетовый фиолетовый синий синий | бесцветная бесцветная бесцветная малиновая малиновая |    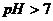 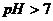 |
1. 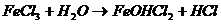

2. 

3. 

4. 
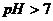
5. 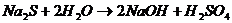
Опыт 4.
Взаимное усиление гидролиза при взаимодействии растворов двух солей.
В одну пробирку налить 3-5 капель раствора хлорида железа (Ш), во вторую – столько же раствора сульфата алюминия, в третью — столько же раствора сульфата хрома (Ш). В первые две пробирки добавить 3-5 капель раствора карбоната натрия, в третью – столько же раствора сульфида натрия.
1.
I.
II.
III.
Выпал осадок коричневого цвета и выделился газ.
2.
I.
II.
III.
Выпал осадок белого цвета и выделился газ.
3.
I.
II.
III.
Выпал осадок синего цвета и выделился газ.
Вывод: в результате реакции взаимного усиления гидролиза образуется слабое основание и слабая кислота.
Вывод: в ходе лабораторной работы я ознакомился с процессом гидролиза солей и его следствиями, научился составлять уравнения гидролиза. Также исследовал реакции взаимного усиления гидролиза, в результате которой образуется слабое основание и слабая кислота.
Видео:Гидролиз солей. 9 класс.Скачать

Смещение гидролиза соли в сторону усиления или уменьшения его
Задача 604.
Лакмус изменяет окраску в интервале рН от 5 до 8,3. Какова будет окраска содержащего лакмус 0,001 М раствора ацетата натрия CH3COONa (KГ = 5,6 . 10 -9 ): а) красная; б) фиолетовая; в) синяя?
Решение:
KГ(CH3COONa) = 5,6 . 10 -9 .
Далее определяем концентрацию ионов OH — :
[OH — ] = h . CM = (2,37 . 10 -3 ) . (10 -3 ) = 2,37 . 10 -6 моль/л.
Находим рН раствора:
pОH = -lgО[H — ] = -lg2,37 . 10 -6 = 6 — lg2,37 = 6 — 0,375 = 5,625;
рН = 14 — рОН = 14 — 5,625 = 8,3
Реакция среды будет щелочной (рН = 8,3), поэтому окраска лакмуса будет синей.
Ответ: в).
Задача 605.
Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале рН от 3,2 до 4,4. Какова будет окраска 0,1 М водного раствора ацетата аммония CH3COONH4, содержащего метиловый оранжевый: а) красная; б) оранжевая; в) желтая?
Решение:
CH3COONH4 — соль слабого основания и слабой кислоты, которая гидролизуется как по катиону, так и по аниону:
Так как константы диссоциации NH4OH и CH3COOH приблизительно равны 1,8 . 10 -5 , то соль будет в равной степени гидролизоваться и по катиону, и по аниону, образуя примерно равные количества ионов OH — и H + , реакция среды будет нейтральной, рН = 7.
Теперь рассчитаем степень гидролиза:
Находим концентрацию ионов H + и OH — :
[H + ] = [OH — ] = h . CM = (1,73 . 10 -3 ) . (0,1) = 1,73 . 10 -4 г/моль.
pH = lg [H + ] = -lg1,73 . 10 -4 = 4 — lg1,73 = 4 — 0,24 = 3,76 или 3,8.
Так как рН = 3,8, т. е. имеет промежуточное значение между 3,2 и 4,4, значит, окраска метилового оранжевого скорее будет оранжевой.
Ответ: б).
Задача 606.
Константы диссоциации азидоводорода HN3 и гидроксида аммония NH4OH примерно одинаковы. Каким будет соотношение значений рН в растворах NaN3 (pH1) и NH4NO3 (pH2 одинаковой молярной концентрации:
а) pH1 > pH2; б) pH1 = pH2; в) pH1
При гидролизе данной соли образуется избыток ионов OH — , поэтому реакция среды будет щелочной, рН > 7.
б) NH4NO3 — соль слабого основания и сильной кислоты, которая гидролизуется по катиону:
При гидролизе данной соли образуется избыток иона H+, поэтому реакция среды раствора будет кислая, рН
Отсюда вытекает, что pH1 > pH2, потому что у NaN3 гидролизуется катион, а у NH4NO3 — анион.
Ответ: а2.
Задача 607.
Добавление каких из перечисленных ниже реагентов к раствору FeCl3 усилит гидролиз соли:
а) HCl; б) NaOH; в) ZnCl2; г) Na2CO3; д) NH4Cl; е) Zn; ж) H2O?
Решение:
FeCl3 — соль слабого основания и сильной кислоты гидролизуется по катиону:
Fe 3+ + H2O ⇔ FeOH 2+ + H + .
Гидролиз соли в основном протекает по первой ступени и при этом образуется избыток ионов водорода.
а) Если в раствор FeCl3 ввести раствор HCl, в растворе будет введено дополнительное количество ионов водорода (за счёт диссоциации кислоты HCl ⇔ H + + Cl — ), то, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения ионов водорода, т.е. в сторону ослабления гидролиза.
б) Если в раствор FeCl3 ввести дополнительное количество раствора NaOH, то ионы OH — , образующиеся при диссоциации щёлочи (NaOH ⇔ Na + + OH — ), будут связывать ионы H + , образующиеся при гидролизе FeCl3 в воду (H + + OH — ⇔ H2O ). Поэтому, согласно принципу Ле Шателье, равновесие гидролиза FeCl3 сместится в сторону дополнительного образования ионов H + , т.е. гидролиз соли усилится.
в) Если в раствор FeCl3 ввести дополнительное количество раствора ZnCl 2 , гидролизующейся тоже по катиону, то в растворе будет образовываться дополнительное количество ионов H + . Согласно принципу Ле Шателье, равновесие в системе сместится в сторону уменьшения концентрации ионов H + , т.е. в сторону замедления гидролиза соли FeCl3.
г) Если в раствор FeCl3 ввести раствор Na2CO3, гидролиз которой проходит по аниону:
CO3 2- + H2O ⇔ HCO3 — + OH — , то в растворе будет образовываться дополнительное количество ионов OH-, которые будут связываться с ионами H+, образуемыми при гидролизе соли FeCl3, с образованием молекул H2O (H + + OH — ⇔ H2O ), что вызовет взаимное усиление гидролиза обеих солей и в результате – конечных продуктов гидролиза (образование нерастворимого Fe(OH)3 и выделение газообразного СО2):
д) Если в раствор FeCl3 добавить раствор NH4Cl, гидролизующейся по катиону:
NH4 + + H2O⇔ NH4OH + H + , то в растворе будет происходить увеличение концентрации ионов H + , что, согласно принципу Ле Шателье, сместит равновесие системы в сторону уменьшения гидролиза FeCl3.
е) При добавлении в раствор FeCl3 гранул цинка произойдёт связывание ионов водород. Объясняется это тем, что цинк как активный металл будет отдавать электроны ионам водорода, образующихся при гидролизе соли (Zn + 2H + ⇔ Zn 2+ + H2↑), что приводит к уменьшению концентрации ионов H + в растворе. Согласно принципу Ле Шателье, равновесие системы сместится в сторону увеличения концентрации ионов H + , т.е. в сторону усиления гидролиза FeCl3.
ж) При добавлении воды в раствор соли FeCl3 будет происходить разбавление раствора, что будет способствовать уменьшению концентрации всех веществ, участвующих в гидролизе, это приведёт к нарушению равновесия в растворе. Для того чтобы равновесие восстановилось некоторое количество соли должно дополнительно гидролизоваться, т. е .разбавление раствора соли способствует усилению гидролиза – процесса, связанного с поглощением воды.
📽️ Видео
Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Эта реакция точно будет на ЕГЭ по химии. Взаимное усиление гидролиза. #chemistry #егэхимия #егэСкачать

Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Совместный гидролиз | 9-11 классыСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

11 класс. Гидролиз солей.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Совместный гидролиз во второй части | Химия ЕГЭ | УмскулСкачать

Усиление гидролиза солей при нагреванииСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Гидролиз бинарных соединений. 11 класс.Скачать
Как выглядит совместный гидролиз солей на ЕГЭ - химические опыты | Химия 10 класс УмскулСкачать

Усиление гидролиза при нагреванииСкачать