| Название | Задача Двухатомные молекулы (20 баллов) Семь простых веществ в обычных условиях состоят из двухатомных молекул, x 2 |
| Дата | 03.04.2022 |
| Размер | 21.75 Kb. |
| Формат файла |  |
| Имя файла | 8 класс задачи + решение.docx |
| Тип | Задача #438689 |
 С этим файлом связано 10 файл(ов). Среди них: 11 класс решение.docx, 11 класс задачи.docx, 10 класс задачи.docx, 9 класс задачи + решение.doc, Викторина ко Дню ГО.docx, Практическая работа №1 по биологиии.docx, География.docx, Биология Практическая работа №2.docx, Анализ егЭ по химии 11а, 11б класс 2021г. Калинина О.И..doc, земледелие хоменко.docx. С этим файлом связано 10 файл(ов). Среди них: 11 класс решение.docx, 11 класс задачи.docx, 10 класс задачи.docx, 9 класс задачи + решение.doc, Викторина ко Дню ГО.docx, Практическая работа №1 по биологиии.docx, География.docx, Биология Практическая работа №2.docx, Анализ егЭ по химии 11а, 11б класс 2021г. Калинина О.И..doc, земледелие хоменко.docx.  Показать все связанные файлы Подборка по базе: ситуационная задача №9 ответ.docx, доу — задача32.doc, Строение вещества. Молекулы.docx, ВЭД Задача 3 Давыдов С.Я..docx, В6 Задача 4.6.pdf, ндфл задача.docx, проектная задача.docx, Ситуационная задача по географии..docx, КУРСОВА РАБОТА ПЪРВА ЗАДАЧА.docx, Юр психология. Задача 1.docx Показать все связанные файлы Подборка по базе: ситуационная задача №9 ответ.docx, доу — задача32.doc, Строение вещества. Молекулы.docx, ВЭД Задача 3 Давыдов С.Я..docx, В6 Задача 4.6.pdf, ндфл задача.docx, проектная задача.docx, Ситуационная задача по географии..docx, КУРСОВА РАБОТА ПЪРВА ЗАДАЧА.docx, Юр психология. Задача 1.docxШкольный этап, 2021-2022 гг. Задача 1. Двухатомные молекулы (20 баллов) Семь простых веществ в обычных условиях состоят из двухатомных молекул, X2. Масса самой тяжёлой из таких молекул в 127 раз больше массы самой лёгкой. Установите формулы этих двух молекул. Напишите уравнение реакции между ними, если известно, что продукт реакции также состоит из двухатомных молекул. Напишите формулы трёх других простых веществ, молекулы которых состоят из двух атомов. Задача 2. Вещества А и Б (20 баллов) В неизвестном веществеА, состоящем из атомов двух элементов, массовые доли элементов равны между собой. Определите веществоА, зная, что оно образуется при сжигании на воздухе жёлтого порошка вещества Б. Запишите уравнение реакции. Как используют веществоА? Где вещество Б встречается в природе? В две фарфоровые чашки поместили образцы меди и ртути одинаковой массы. Вещества подвергли длительному прокаливанию на воздухе. После охлаждения чашек их взвесили. Масса чашки, в которой находилась медь, увеличилась, а масса чашки со ртутью уменьшилась. Как это можно объяснить? Что произошло при прокаливании металлов на воздухе? Какое новое вещество образовалось? Напишите уравнение реакции. Какой цвет имеет продукт реакции? Задача 4. Уравнения реакций (20 баллов) Завершите приведённые ниже уравнения реакций, поставив вместо троеточий коэффициенты или химические формулы. Отнесите каждую реакцию к одному из четырёх типов – соединения, разложения, замещения или обмена. Задача 5. Разделение смеси (20 баллов) (1) нагреть смесь до плавления парафина (2) снять с поверхности воды плавающие кусочки вещества А и высушить их между листами фильтровальной бумаги (3) поместить смесь в воду, перемешать палочкой или взболтать (4) отделить находящийся на дне осадокБфильтрованием (5) размешать взвесь стеклянной палочкой и вылить на воронку с фильтром (6) отделить воду перегонкой (7) перенести фильтрат в фарфоровую чашку и выпарить досуха (9) перетереть смесь и выделить из неё одно из веществ магнитом (10) дождаться, когда одно из веществ всплывёт Всероссийская олимпиада школьников по химии Школьный этап, 2021-2022 гг. 8 класс Задача 1. Двухатомные молекулы Самая тяжёлая – I2 (Mr = 127 2 = 254) 4 балла Уравнение реакции: H2 +I2= 2HI 6 баллов Другие простые вещества – любые три из списка: по 2 балла за вещество 6 баллов Итого 20 баллов Задача 2. Вещества А и Б А – оксид серы(IV), или сернистый газ, SO2 Сернистый газ используют для защиты растений от вредителей, в качестве консерванта, при производстве серной кислоты. Сера встречается в природе в районах с активной вулканической деятельностью. ВеществаАи Б – по 6 баллов, всего 12 баллов Уравнение реакции 4 балла Применение сернистого газа 2 балл Нахождение серы в природе 2 балл Итого 20 баллов Задача 3. Прокаливание металлов При прокаливании медь соединяется с кислородом воздуха и образует новое вещество – оксид меди(II), CuO2 балла 2Cu + O2 = CuO4 балла Масса чашки увеличивается за счёт присоединённого кислорода. (4 балла). CuO имеет чёрный цвет (4 балла). Ртуть при прокаливании на воздухе испаряется, поэтому масса чашки уменьшается (6 баллов) . Итого 20 баллов Задача 4. Уравнения реакций 1) 2BaO + O2 = 2BaO2 соединение 2) Al2S3 + 6HCl = 2AlCl3 + 3H2S обмен 3) Fe2O3 + 3C = 2Fe + 3CO замещение 4) 2N2O5 = 4NO2 + O2 разложение Каждое уравнение – по 4 балла, каждый тип реакции – по 1 баллу. В первой реакции за уравнение Ba + O2 = BaO2 — два бала из четырех Итого 20 баллов Задача 5. Разделение смеси Правильная последовательность: (3) – (10) – (2) – (5) – (4) – (7) – (8) А – парафин, Б – мел, В – поваренная соль За каждую указанную необходимую операцию (неважно, в каком порядке) – 1 балл, за каждую неправильную – минус 1 балл 7 баллов Правильная последовательность 7 баллов Содержание
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать  Муниципальный тур олимпиады по химииОбращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Рабочие листы и материалы для учителей и воспитателей Более 2 500 дидактических материалов для школьного и домашнего обучения ВСЕРОССИЙСКАЯ ОЛИМПИАДА ШКОЛЬНИКОВ МУНИЦИПАЛЬНЫЙ ЭТАП. 8 КЛАСС Задание 1. Разделение смеси Смесь поваренной соли, мела и парафина необходимо разделить на индивидуальные вещества. Ниже представлен перечень отдельных операций. Выберите из него необходимые операции и расположите их в правильном порядке. Какие вещества обозначены буквами А, Б, В? (5+ 3 = 8 баллов) (1) нагреть смесь до плавления парафина (2) снять с поверхности воды плавающие кусочки вещества А и высушить их между листами фильтровальной бумаги (3) поместить смесь в воду, перемешать палочкой или взболтать (4) отделить находящийся на дне осадок Б фильтрованием (6) отделить воду перегонкой (7) перенести фильтрат в фарфоровую чашку и выпарить досуха (8) собрать стеклянной палочкой с фарфоровой чашки вещество В (9) перетереть смесь и выделить из неё одно из веществ магнитом (10) дождаться, когда одно из веществ всплывёт А – парафин, Б- мел, В- поваренная соль Определите степени окисления элементов переходных металлов в следующих соединениях: Переходный металл – хром. Задание 3. Уравнения реакций Завершите приведённые ниже уравнения реакций, поставив вместо троеточий коэффициенты или химические формулы. Отнесите каждую реакцию к одному из четырёх типов – соединения, разложения, замещения или обмена. (4+ 4=8 баллов) Fe 2 O 3 + 3C = 2 Fe + 3CO Напишите уравнение реакции с участием кислорода, в результате которой образуются два газообразных при обычных условиях вещества. (4 балла) Решение. Газообразные при обычных условиях продукты горения – CO 2 и SO 2. Исходное вещество – сероуглерод: В 100 г воды растворили 12.2 г белого порошка и получили 9.27%-ный раствор хлорида бария. Установите формулу порошка. Ответ подтвердите расчётом. ( 6 баллов) Решение . Рассчитаем массу раствора и массу хлорида бария в нем: m (р-ра) = 100 + 12.2 = 112.2 г, т (BaCl 2 ) = 112.2 ∙ 0.0927 = 10.4 г. n (BaCl 2 ) = 10.4 / 208 = 0.05 моль, M (порошка) = 12.2 / 0.05 = 244 г/моль, 244 – 208 = 36 = 18 ∙ 2. Формула порошка – BaCl 2 ∙ 2H 2 O В неизвестном веществе А, состоящем из атомов двух элементов, массовые доли элементов равны между собой. Определите вещество А, зная, что оно образуется при сжигании на воздухе жёлтого порошка вещества Б. Запишите уравнение реакции. Как используют вещество А? Где вещество Б встречается в природе? ( 6 баллов) А) Вещество А – диоксид серы SO 2 Б) Вещество Б – сера S В) Уравнение реакции S + O 2 = SO 2 Вещество А – диоксид серы. Диоксид серы используется во многих областях пищевой промышленности из-за её антимикробного эффекта. В профилактических целях обрабатывают помещения, в которых хранятся фрукты и овощи, очищают емкости для хранения вин и других напитков. Текстильные комбинаты применяют рассматриваемое вещество с целью отбеливания тканей, созданных из шерсти и шелка. Этот метод является одним из актуальных видов отбеливания без применения хлорки. Преимущество процедуры состоит в том, что волокна не будут разрушены. Вещество Б – сера в природе может встречаться в самородном виде и в виде соединений. Важнейшие природные минералы серы: FeS 2 — железный колчедан, или пирит, ZnS — цинковая обманка, PbS — свинцовый блеск, или галенит, HgS — киноварь. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химия 9 класс, муниципальный (второй) этап, г. Москва, 2016 годВидео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Задание 1. (10 баллов) «Ионные реакции»Завершите приведённые ниже сокращённые ионные уравнения реакций с коэффициентами. Все неизвестные частицы обозначены многоточиями. Для каждого сокращённого ионного уравнения приведите по одному уравнению в молекулярной форме. Решение
Критерий оцениванияКаждое уравнение (сокращённое ионное или молекулярное) – по 1 баллу. Всего за задачу – 10 баллов. Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать  Задание 2. (10 баллов) «Взаимодействие растворов»При смешении равных масс растворов хлорида бария и карбоната натрия образовалось 13,79 г осадка Х и раствор вещества Y. Определите неизвестные вещества и запишите уравнение реакции. Найдите массу вещества Y и его массовую долю в конечном растворе, если известно, что при добавлении к нему серной кислоты никаких изменений не наблюдается, а массовая доля карбоната натрия в исходном растворе в 1,7 раза больше массовой доли вещества Y в конечном растворе. РешениеПри взаимодействии растворов хлорида бария и карбоната натрия протекает реакция: X – BaCO3, Y – NaCl. Так как фильтрат не реагирует с серной кислотой, он не содержит ни избытка карбонат-ионов, ни избытка ионов бария. Это означает, что оба вещества прореагировали полностью. Проведём расчёт по уравнению реакции: n(BaCO3) = 13,79 / 197 = 0,07 моль, n(Na2CO3) = 0,07 моль, m(Na2CO3) = 0,07∙106 = 7,42 г, n(NaCl) = 0,14 моль, m(NaCl) = 0,14∙58,5 = 8,19 г. Пусть масса каждого из двух смешанных растворов равна x г, тогда масса конечного раствора равна (2x – 13,79) г (осадок BaCO3 не входит в состав раствора). Массовая доля карбоната натрия в исходном растворе: а массовая доля хлорида натрия (вещества Y) в конечном растворе: По условию задачи, ω1 = 1,7ω2, 7,42 / x = 1,7∙8,19 / (2x – 13,79), ω2 = 8,19 / (2∙111,6 – 13,79) = 0,039, или 3,9 %. Ответ : m(NaCl) = 8,19 г, ω(NaCl) = 3,9 %. Критерии оценивания
Видео:ЛОДУ 2 порядка c постоянными коэффициентамиСкачать  Задание 3. (10 баллов) «Электроны химических связей»Приведите по одному примеру молекул, у которых в образовании ковалентных химических связей участвуют:
Ответы обоснуйте. Для каждой молекулы опишите электронную конфигурацию атома с наибольшим порядковым номером. Решениеа) Только в одном элементе, способном к образованию химических связей, нет внутренних электронов – это водород H. В молекуле H2 оба электрона (т. е., все электроны молекулы) участвуют в образовании связи H–H. Других таких молекул нет . Электронная конфигурация атома водорода: 1s 1 б) Чем больше в молекуле атомов водорода, тем большая доля электронов от их общего числа в молекуле участвует в ковалентных связях. Кроме водорода имеет смысл рассматривать только элементы 2-го периода, так как у них относительно немного внутренних электронов. Перечислим летучие водородные соединения неметаллов 2-го периода (за исключением бора) с указанием числа электронов: CH4 – всего 10 электронов, 4 химические связи, образованные 8 электронами. 8/10 > 1/2, подходит. NH3 – всего 10 электронов, 3 химические связи, образованные 6 электронами. 6/10 > 1/2, подходит. H2O – всего 10 электронов, 2 химические связи, образованные 4 электронами. 4/10 2 2s 2 2p 2 , N – 1s 2 2s 2 2p 3 (принимается также распределение по энергетическим уровням: 2 – 4 для углерода и 2 – 5 для азота). в) Число электронов, участвующих в образовании ковалентных связей, чётное. Тогда общее число электронов в молекуле должно быть кратным 6: 6, 12, 18 и т. д. Молекул с 6 электронами нет (BeH2 имеет немолекулярное строение). 12 электронов имеет неустойчивая молекула C2, связь в которой – двойная. Формально, C2 – правильный ответ. 18 электронов и 3 ковалентные связи – в молекуле PH3, которая и является основным правильным ответом. Электронная конфигурация атома P: 1s 2 2s 2 2p 6 3s 2 3p 3 (или 2 8 5). Ответ:
Критерии оценивания:
Видео:Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать  Задание 4. (10 баллов) «Цветные реакции»Бирюзовый осадок X массой 7,74 г, выделившийся при добавлении небольшого количества раствора гидроксида натрия к водному раствору сульфата меди(II), при прокаливании образует 4,80 г чёрного порошка Y, который при нагревании в токе водорода изменяет окраску, превращаясь в розово-красный порошок Z массой 3,84 г.
Решение
n(Cu) = 3,84/64 = 0,06 моль. Вещество Y представляет собой оксид меди. Если предположить, что в формульной единице оксида содержится один атом меди, то n(Y) = n(Cu) = 0,06 моль, тогда M(Y) = 4,8/0,06 = 80 г/моль, что соответствует оксиду меди CuO. Используя такое же предположение, рассчитаем молярную массу X. Она равна 7,74/0,06 = 129 г/моль, что не соответствует молярной массе гидроксида меди. Тогда разумно предположить, что X представляет собой основную соль. Если в формульной единице X содержится два атома меди, то М(X) = 7,74/0,03 = 258 г/моль,что соответствует формуле Cu2(OH)2SO4. Итак, X – Cu2(OH)2SO4, сульфат дигидроксидимеди(II), или основный сульфат меди(II), или сульфат гидроксомеди. Принимается любое из этиx названий. Y – CuO, оксид меди(II). Z – Cu, медь. Критерии оценивания
Всего – 5 баллов.
Всего за задачу – 10 баллов. Видео:Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать  Задание 5 (10 баллов) «Анализ жидкости»В две колбы с тёплой водой поместили по 13,5 г бесцветной кислородсодержащей жидкости, состоящей из трёх элементов. Через некоторое время, когда реакция закончилась, растворы подвергли анализу. Полученные растворы имели кислую реакцию. В первую колбу прилили избыток раствора хлорида бария, при этом выделилось 23,3 г белого кристаллического осадка. Во вторую колбу добавили избыток раствора нитрата серебра. Масса выпавшего творожистого осадка составила 28,7 г. Определите формулу неизвестной жидкости. Запишите уравнения протекающих химических реакций. Решение и критерии оцениванияИз условия задачи можно предположить, что в результате взаимодействия неизвестной жидкости с водой образовались серная и соляная кислоты. Белый кристаллический осадок – сульфат бария. Белый творожистый осадок – хлорид серебра. Поэтому исходное вещество состояло из трёх элементов – серы, хлора и кислорода. (2 балла) Количество вещества серы в составе сульфата бария: n(S) = n(BaSO4) = 23,3 г / 233 г/моль = 0,1 моль (1 балл) Количество вещества хлора в составе хлорида серебра: n(Cl) = n(AgCl) = 28,7 г /143,5 г/моль = 0,2 моль (1 балл) Количество вещества кислорода в составе неизвестной жидкости: m(O) = 13,5 – (m(S) + m(Cl)) = 13,5 – (0,1∙32 + 0,2∙35,5) = 3,2 г n(O) = 3,2/16 =0,2 моль (2 балла) Отношение чисел атомов в соединении: n(S) : n(Cl) : n(O) = 0,1 : 0,2 : 0,2 = 1 : 2 : 2 (1 балл) Уравнение реакции взаимодействия вещества с водой: (3 балла) Всего за задачу – 10 баллов. Видео:Линейное неоднородное дифференциальное уравнение второго порядка с постоянными коэффициентамиСкачать  Задание 6. (10 баллов) «Школьный эксперимент»В школьной лаборатории собрали прибор, как это показано на рисунке 6.1. В колбу 1 поместили небольшие кусочки сульфида железа(II) и прилили соляную кислоту. Выделяющийся газ пропустили через склянку 2, заполненную безводным хлоридом кальция. В колбе 6 к порошку сульфита натрия прилили концентрированную серную кислоту. Выделяющийся газ пропускали через склянку 7 с концентрированной серной кислотой. Оба газа поступали в колбу-реактор 3, направление движения газов показано на рисунке стрелками. Избыток газов поступал по газоотводной трубке 8 в поглотительную склянку 9. Когда колба-реактор 3 была заполнена смесью газов, никаких изменений не наблюдалось. Однако после того, как открыли зажим 5 и прилили небольшое количество воды из воронки 4, в колбе 3 началась реакция. Пространство в этой колбе заполнилось дымом, а через некоторое время на её стенках образовался плотный налёт жёлтого цвета.
Решение и критерии оценивания
2 балла В колбе 6 получали сернистый газ: 2 балла
1 балл Склянку 2 нельзя заполнять концентрированной серной кислотой, т. к. Выделяющийся сероводород будет окисляться. 1 балл
На стенках колбы образуется налёт элементарной серы. 2 балла
По 1 баллу за каждый правильный вариант. Всего за задачу – 10 баллов. Максимальное количество баллов за работу – 50. Общие указания: если в задаче требуются расчёты, они обязательно должны быть приведены в решении. Ответ, приведённый без расчётов или иного обоснования, не засчитывается. В итоговую оценку из 6 задач засчитываются 5 решений, за которые участник набрал наибольшие баллы, то есть одна из задач с наименьшим баллом не учитывается. 📹 ВидеоРеакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать  Реакции ионного обмена (РИО) | Химия ЕГЭ, ЦТСкачать  Линейное неоднородное дифференциальное уравнение с постоянными коэффициентами 4y''-y=x^3-24x #1Скачать  Химический эквивалент и фактор эквивалентности в реакциях ионного обменаСкачать  Задача Коши ➜ Частное решение линейного однородного дифференциального уравненияСкачать 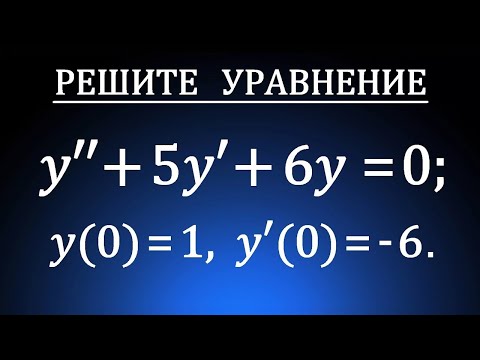 Коэффициент поверхностного натяженияСкачать  Константа нестойкости и диссоциация комплексных соединенийСкачать  Линейное однородное дифференциальное уравнение 2-го порядка с постоянными коэффициентами.Скачать  Математика без Ху!ни. Линейные неоднородные дифференциальные уравнения 2 порядка.Скачать  Задача №34 с двумя колбами на растворимость | ЕГЭ по химии 2024Скачать  Три способа отбора корней в задании 13 ЕГЭ профильСкачать  Отбор корней с аркфункциями в №12 | Это будет на ЕГЭ 2023 по математикеСкачать  |
