А) понижения давления;
Б) повышения температуры;
В) понижения температуры;
Г) использования катализатора.
А) понижения давления;
Б) повышения температуры.
- Химическое равновесие в системе С4Н10(г) С4Н8(г) + Н2(г) – Q можно сместить в сторону продуктов реакции
- Ваш ответ
- решение вопроса
- Похожие вопросы
- В каком направлении сместится химическое равновесие в следующей системе : C4H10 < ; — — > ; C4H8 + H2 — Q а) при понижение температуры?
- Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :1 Понижение температуры и понижении давления?
- В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры?
- Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А?
- Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления?
- В какой системе при повышении давления химическое равновесие сместится вправо?
- Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления?
- Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А?
- В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж?
- В какую сторону сместится равновесие системы : N2O4< ; — > ; 2NO2 ; dH< ; 0 а) при понижении температуры?
- Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
- Бутан: способы получения и химические свойства
- Гомологический ряд бутана
- Строение бутана
- Изомерия бутана
- Структурная изомерия
- Химические свойства бутана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование бутана
- 2. Дегидрирование бутана
- 3. Окисление бутана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- 4. Изомеризация бутана
- Получение бутана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 3. Гидрирование алкенов и алкинов
- 4. Синтез Фишера-Тропша
- 5. Получение бутана в промышленности
Видео:25. Схема реакции и химическое уравнениеСкачать

Химическое равновесие в системе С4Н10(г) С4Н8(г) + Н2(г) – Q можно сместить в сторону продуктов реакции
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Ваш ответ
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

решение вопроса
Видео:Определение порядка реакции методом подбора кинетического уравненияСкачать

Похожие вопросы
- Все категории
- экономические 43,427
- гуманитарные 33,634
- юридические 17,906
- школьный раздел 608,208
- разное 16,858
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

В каком направлении сместится химическое равновесие в следующей системе : C4H10 < ; — — > ; C4H8 + H2 — Q а) при понижение температуры?
Химия | 10 — 11 классы
В каком направлении сместится химическое равновесие в следующей системе : C4H10 < ; — — > ; C4H8 + H2 — Q а) при понижение температуры.
Б) при повышение давления.
При понижении температуры — влево
при повышении давления — влево.
Видео:Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :1 Понижение температуры и понижении давления?
Химическое равновесие в системе 2SO2(г) + О2(г) — — — 2SO3 (г) + Q сместится в сторону продукта реакции при :
1 Понижение температуры и понижении давления.
2 Повышение давления и температуры .
3 повышении давления и понижении температуры.
4 увеличении концентрации SO3 и понижении температуры.
Видео:HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать

В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры?
В какую сторону сместится равновесие реакциипри : повышение давления, понижения температуры.
Дайте обоснованый ответ,.
Видео:07 Кинетика 5 эксп опред параметров реакцииСкачать

Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А?
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции : А.
Повышения температуры и давления.
Б. Понижение температуры и давления.
В. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
Видео:Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления?
Химическое равновесие в система : C6H11 — CH3 — — — — — — — C6H5 — CH3 + 3H2 — Q сместится в сторону исходного вещества при : а)повышении температуры 2)понижении давления 3)повышении давления.
Видео:Обратимая реакция второго порядка || Вывод уравнения || Разбор задачи || КинетикаСкачать

В какой системе при повышении давления химическое равновесие сместится вправо?
В какой системе при повышении давления химическое равновесие сместится вправо?
Видео:c04 3, Динамические звенья 2: типовые звенья и их АФЧХСкачать

Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления?
Химическое равновесие в системе H2O + SO2 = H2SO4(р — р) + Q сместится в сторону продуктов реакции при а) понижении температуры б)повышении температуры в)понижения давления.
Видео:Определение формулы органических соединений. 1 часть. Практическая часть - решение задачи. 9 класс.Скачать

Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А?
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции : А.
Повышения температуры и давления.
Б. Понижение температуры и давления.
В. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
Видео:Реакции равновесияСкачать
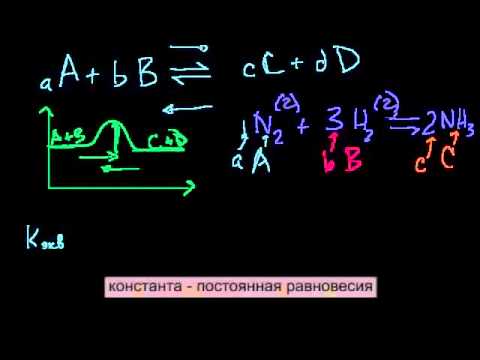
В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж?
В сторону какой реакции сместится химическое равновесие 2SO2 + O2 = 2SO3, ΔH° = 192 кДж.
При : а)понижении температуры, б) повышения давления.
Видео:Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

В какую сторону сместится равновесие системы : N2O4< ; — > ; 2NO2 ; dH< ; 0 а) при понижении температуры?
В какую сторону сместится равновесие системы : N2O4< ; — > ; 2NO2 ; dH< ; 0 а) при понижении температуры?
Б) при повышении давления?
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
Как сместиться равновесие реакций азота с кислородом и азота с водородом при повышении и понижении давления, при повышении и понижении температуры?
На этой странице сайта, в категории Химия размещен ответ на вопрос В каком направлении сместится химическое равновесие в следующей системе : C4H10 < ; — — > ; C4H8 + H2 — Q а) при понижение температуры?. По уровню сложности вопрос рассчитан на учащихся 10 — 11 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Видео:Конформные отображенияСкачать

Бутан: способы получения и химические свойства
Бутан C4H10 – это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Видео:ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать

Гомологический ряд бутана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:Равноускоренное движение. Вывод формулСкачать

Строение бутана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле бутана C4H10 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия бутана
Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
| Бутан | Изобутан |
 |  |
Для бутана не характерна пространственная изомерия.
Химические свойства бутана
Бутан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
| Например, при хлорировании бутана образуются 1-хлорбутан и 2-хлорбутан: Бромирование протекает более медленно и избирательно.
|

















