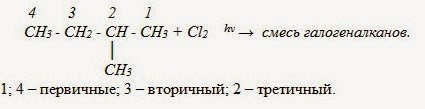Химия | 5 — 9 классы
Заполните таблицу химические свойства и применение алканов.
Все ответы в прикреплённых изображениях.

- Помогите пожалуйста?
- Заполните таблицу в которой отражены химические свойства углерода допишите уравнения реакции?
- Химические свойства Алканов Алкенов и т?
- Химические свойства алканов?
- Химические свойства алканов?
- Химические свойства : алканов, алкенов, алкинов, алкодиенов, аренов ввиде формул?
- Перечислите химические свойства воды?
- Химические свойства алканов?
- Перечислите области применения кислорода ?
- Как строение алканов повлияло на их химические свойства?
- Методическая разработка урока «Химические свойства и применений алканов» план-конспект урока по химии (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- Заполните таблицу химические свойства и применение алканов уравнение реакции
- Химические свойства алканов
- Строение алканов
- Химические свойства
- Применение
- Что мы узнали?
- 💡 Видео
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Помогите пожалуйста?
Заполните таблицу «Химические свойства металлов», записав уравнения возможных реакций.
Видео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать

Заполните таблицу в которой отражены химические свойства углерода допишите уравнения реакции?
Заполните таблицу в которой отражены химические свойства углерода допишите уравнения реакции.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Химические свойства Алканов Алкенов и т?
Химические свойства Алканов Алкенов и т.
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Химические свойства алканов?
Химические свойства алканов.
Видео:Методы получения и применения алканов | Химия 10 класс #7 | ИнфоурокСкачать

Химические свойства алканов?
Химические свойства алканов.
Видео:Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать

Химические свойства : алканов, алкенов, алкинов, алкодиенов, аренов ввиде формул?
Химические свойства : алканов, алкенов, алкинов, алкодиенов, аренов ввиде формул.
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Перечислите химические свойства воды?
Перечислите химические свойства воды.
Какие из этих свойств находят практическое применение.
Видео:1.3. Алканы: Химические свойства. Подготовка к ЕГЭ по химииСкачать

Химические свойства алканов?
Химические свойства алканов.
Видео:Химические свойства алканов. 2 часть. 10 класс.Скачать

Перечислите области применения кислорода ?
Перечислите области применения кислорода .
На каких химический или физический свойствах основано это применение.
Видео:Алканы. Химические свойства. 9 класс.Скачать

Как строение алканов повлияло на их химические свойства?
Как строение алканов повлияло на их химические свойства?
Вы находитесь на странице вопроса Заполните таблицу химические свойства и применение алканов? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
D = 8, 83 M = 28, 98 г / моль молярная масса воздуха M(S) = 32 г / моль M(Sₓ) = xM(S) M(Sₓ) = DM xM(S) = DM 32x = 8, 83 * 28, 98 x = 8 S₈ молекула состоит из восьми атомов.
Так як шукаючи масу кальцію треба множити його молярну масу на кількість речовини, можна зробити висновок, що збільшення маси кальцію у сполуках буде дорівнювати збільшенню його кількості речовини Тому послідовність буде така В) n(Ca) = n(CaSO4) = 0.
Ответ а Алкан : а, д Циклоалкан : бжз Алкен : бв Алкин : г.
Ответ на фотографии.
2K + H2 = 2КН S + O2 = SO2 4Al + 3O2 = 2Al2O3 2Ca + O2 = 2CaO.
А)2Н2 + О2 = 2Н2О г)2Р + 3О2 = Р2О5.
Молекулы которые имеют большую разность.
Однородные : — воздух — морская вода — молоко — раствор сахара в воде — туман — дым — смесь уксуса и воды Неоднородные : — свежевыжатый апельсиновый сок — ил в реке.
Белый пудель. Он же белый. Соответствует названию. Наверное.
Видео:Углеводороды: алканы. Химические свойства и получение | Химия ЕГЭ, ЦТСкачать

Методическая разработка урока «Химические свойства и применений алканов»
план-конспект урока по химии (10 класс) на тему
Методическая разработка урока «Химические свойства алканов и их применение»
Видео:Углеводороды. Тема 7. Химические свойства, получение и применение алкановСкачать

Скачать:
| Вложение | Размер |
|---|---|
| khimicheskie_svoystva_alkanov.docx | 116.56 КБ |
Видео:10 класс § 26 "Получение и применение алканов"Скачать

Предварительный просмотр:
Методическая разработка урока:
«Химические свойства и применение алканов»
Цель урока: изучение важнейших химических свойств и применения алканов.
Образовательные задачи урока:
- рассмотреть основные химические свойства – реакции замещения, горения, разложения, дегидрирования и их практическое применение в жизни человека
- выявить взаимосвязь между строением алканов, их химическими свойствами и важнейшими областями применения
Развивающие задачи урока:
- развивать умения обучающихся составлять уравнения химических реакций, находить зависимость в ряду: строение – свойства – применение;
- развивать умение анализировать, сравнивать, обобщать, классифицировать, строить умозаключения, делать выводы;
- развивать навыки самостоятельной работы;
- привить любовь к предмету, желание познать новое.
Воспитательные задачи урока:
- воспитывать культуру умственного труда;
- воспитывать информационную культуру;
- воспитывать потребность добиваться успехов в приобретении знаний;
Индивидуальная, фронтальная работа
Комбинированный урок с применением ИКТ
Компьютер, проектор, презентация «Химические свойства алканов и важнейшие области их применения», таблицы: «Генетический ряд алканов», видеоопыты: « «Горение метана», «Горение жидких углеводородов», карточки для самостоятельной работы у доски и на местах, проверочные тесты, мел, доска
Используемые учебники и учебные пособия :
- О.С. Габриелян. Химия. 10 класс. Базовый уровень. Дрофа. Москва. 2013.
- О.С. Габриелян. Химия. Методическое пособие. 10 класс. Базовый уровень. Дрофа. Москва. 2008
Используемая методическая литература:
- О.С. Габриелян, А.В. Яшукова. Химия. Методическое пособие 10 класс. Базовый уровень
- О.С. Габриелян, И.Г. Остоумов. Настольная книга учителя химии. 10 класс
«Горение жидких углеводородов»
I этап. Организационный момент.
II этап. Актуализация знаний обучающихся
III этап. Изучение нового материала.
IV этап. Физкультминутка
V этап. Закрепление полученных знаний и способов деятельности
VI этап. Подведение итогов урока.
VII этап. Домашнее задание.
VIII этап. Рефлексия.
I. Организационный момент
Учитель приветствует обучающихся, проверяет готовность класса к уроку, определяет отсутствующих учеников.
Приветствуют учителя, дежурный сообщает о готовности класса к уроку и называет отсутствующих
II.Актуализация знаний обучающихся
Учитель приглашает трех учеников к доске для самостоятельного выполнения индивидуальных заданий по карточкам:
1 ученик – работа по карточке: Назовите предложенные вещества.
2 ученик – работа по карточке: Составьте структурные формулы: а) 2,2-диметилбутана,
3 ученик – решает задачу: Установите формулу алкана, если его молекулярная масса равна 58. Составьте структурные формулы одного изомера и одного гомолога для данного вещества, назовите их.
В это время учитель проводит фронтальную беседу с остальными обучающимися в классе:
- Какие вещества называются алканами?
- Почему их называют “предельными” или “насыщенными” углеводородами?
- Назовите общую формулу для класса алканов?
- Какой тип химической связи присутствует в молекулах алканов?
- Расскажите об основных способах получения алканов?
Учитель вместе с обучающимися класса проверяет задания, выполненные самостоятельно у доски тремя учениками.
Трое учеников самостоятельно решают полученные задания у доски.
В ходе беседы обучающиеся класса отвечают на поставленные вопросы учителя.
Ученики вместе с учителем проверяю правильность выполненных заданий
III. Изучение нового материала
Учитель рассказывает: Как мы с вами знаем, алканы при комнатной температуре химически малоактивны и даже с сильными окислителями тяжело реагируют. Поэтому их еще называют парафинами – от греческого «парум афинис» – что означает не терпящие сродства. Однако при специальных условиях алканы могут вступать в различные реакции. Сегодня мы приступаем к изучению химических свойств алканов и важнейших областей их применения человеком. Запишите тему урока.
Учитель записывает на доске тему урока «Химические свойства и применение алканов»
Демонстрация слайда № 1 (Эпиграф к теме урока «Границ научному познанию и предсказанию предвидеть невозможно» Д.И. Менделеев)
Определяет цель и задачи урока
Демонстрация слайда № 2-3(Цель и задачи урока)
В течение урока в ходе объяснения учителя ученики заполняют таблицу «Химические свойства алканов и важнейшие области их применения», которую учитель чертит на доске:
Учитель объясняет: Наиболее характерными для алканов являются реакции замещения, в ходе которых атом водорода замещается на атом галогена или какую-либо другую группу. Эти реакции протекают только при ярком освещении, сильном нагревании. Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
Демонстрация слайда № 4 (слайд о Н.Н. Семенове)
Учитель записывает на доске уравнения реакций замещения:
СН 4 + Cl 2 CH 3 Cl + HCl
Демонстрация слайда № 5:
СН 3 Cl (хлорметан или хлористый метил )– газ, легко сжижается и при последующем испарении поглощает большое количество теплоты. Применяется в холодильных установках.
СН 3 Cl + Cl 2 CH 2 Cl 2 + HCl
Демонстрация слайда № 6:
СН 2 Cl 2 (хлористый метилен) – применяется как растворитель, для склеивания пластиков
СН 2 Cl 2 + Cl 2 CHCl 3 + HCl
Демонстрация слайда № 7:
СН Cl 3 – хлороформ , бесцветная летучая жидкость с эфирным запахом и сладким вкусом используется:
при производстве фреонового хладагента; в качестве растворителя в фармакологической промышленности; для производства красителей и пестицидов
СНCl 3 + Cl 2 CCl 4 + HCl
Демонстрация слайда № 8:
СCl 4 (четрыххлористый углерод) — применяется как растворитель (жиров, смол, каучука);для получения фреонов, в медицине. Являлся стандартным наполнителем переносных огнетушителей для советской бронетехники
Учитель записывает уравнения реакции на доске:
СН 4 + HO-NO 2 = CH 3 -NO 2 + H 2 O
Учитель объясняет: Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М.И.Коновалова).
Демонстрация слайда №9 : Эта реакция была проведена в 19 веке и про учёного говорили, что он сумел оживить « химических мертвецов. Эта реакция применяется для получения нитро соединений, растворителей, используемыми человеком в промышленности.
Учитель объясняет второе важнейшее химическое свойство алканов:
Горение — при поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
Учитель показывает видеоопыт : «Горение метана»
Учитель записывает уравнение реакции на доске:
CH 4 + 2O 2 –– пламя > CO 2 + 2H 2 O
Учитель показывает видеоопыт: «Горение жидких углеводородов»
Учитель записывает уравнение химической реакции на доске:
2C 6 H 14 + 19O 2 –– пламя > 12CO 2 + 14H 2 O
Учитель демонстрирует горение пропанобутановой смеси на примере газовой зажигалки и дает задание учащимся записать уравнения горения: 1 вариант — горение пропана; 2 вариант – горение бутана.
Учитель проверяет правильность составленных уравнений реакций, вызывая к доске 2-х человек.
Демонстрация слайда № 9: ( Горение алканов – это экзотерическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива)
Учитель объясняет, показывая практическое значение реакции горения алканов – это экзотермическая реакция, имеющая большое значение при использовании алканов в качестве топлива.
Ученики слушают учителя.
Обучающиеся записывают тему урока и эпиграф к уроку в тетрадь.
Ученики чертят таблицу в тетрадь, заполняют шапку таблицы.
Ученики начинают заполнять таблицу в ходе объяснения учителя, записывая первое химическое свойство алканов реакции замещения
Ученики записывают в таблицу уравнения реакции галогенирования, смотрят слайды и отмечают области применения хлорметана, дихлорметана,
Видео:Получение и применение алканов | ХимияСкачать

Заполните таблицу химические свойства и применение алканов уравнение реакции
II. Химические свойства алканов
1. Реакции замещения
а) Галогенирование
При действии света — hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или С n H 2n+1 Г
(Г — это галогены F, Cl, Br, I)
CH 4 + Cl 2 hν → CH 3 Cl + HCl (1 стадия)
CH 3 Cl + Cl 2 hν → CH 2 Cl 2 + HCl (2 стадия)
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( — СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
б) Нитрование (реакция М.И. Коновалова , он провёл её впервые в 1888 г)
2. Реакции отщепления (дегидрирование)
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
3. Реакции перегруппировки (изомеризация)
4. Реакции горения (горят светлым не коптящим пламенем)
Помните! Смесь метана с воздухом и кислородом взрывоопасна
5. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С и Н2:
в) Конверсия метана с образованием синтез – газа (СО + Н2)
III. Получение алканов
1. Получение в лаборатории
1. Гидролиз карбида алюминия (получение метана):
2. Реакция Вюрца (взаимодействие натрия с галогенпроизводными алканов):
(R- это радикал; Г- это галоген)
3. Термическое декарбоксилирование солей карбоновых кислот в присутствии щелочей:
(ацетат натрия+ едкий натр=(метан+карбонат натрия)
этилат натрия этан
4. Каталитическое гидрирование алкенов и алкинов:
5. Электролиз растворов солей карбоновых кислот — реакция КОЛЬБЕ
Пример. Электролиз водного раствора ацетата натрия
Катод (-): H2O , Na + — Процесс восстановления: 2H 2 O + 2ē → H 2 ↑ + 2OH —
Анод (+): H 2 O, CH3COO — (анионы органических кислот активнее воды) – Процесс окисления:
2H2O + 2CH3COONa эл . ток = H2 + 2NaHCO3 + C2H6
2. Получение в промышленности
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье — нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов.
Метан называют ещё и болотным; рудничным газом.
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
бензины — т. кип. от 40 до 180 С, (содержит углеводороды С5-С10), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
легкий газойль (дизельное топливо) 230-305 С (С13-С17);
тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С18-С25);
смазочные масла 405-515 С (С26-С38).
Остаток после перегонки нефти называется асфальтом или битумом.
2. Синтезом из водяного газа:
3. Синтезом из простых веществ:
IV. Применение
1. Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
2. Использование в качестве топлива – в котельных установках, бензин, дизельное топливо, авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит.
3. Вазелин используется в медицине, парфюмерии, косметике, высшие алканы входят в состав смазочных масел, соединения алканов применяются в качестве хладагентов в домашних холодильниках.
4. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров.
5. Метан используется для производства шин и краски.
6. Значение алканов в современном мире огромно. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ. Велико значение в медицине, парфюмерии и косметике.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические свойства алканов

Средняя оценка: 4.1
Всего получено оценок: 750.
Средняя оценка: 4.1
Всего получено оценок: 750.
Алканы – соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH2-) и метильные (-CH3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.

Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Видео:Получение алканов. 10 класс.Скачать

Химические свойства
Общие свойства алканов приведены в таблице.
Типы химических реакций
Описание
Уравнение
Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы
Нитрование (реакция Коновалова)
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы
Сопровождается окислением с образованием алкансульфонилхлоридов
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены
Реакция дегидрирования с образованием циклоалканов
Образование изомеров под действием температуры и катализаторов
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
Видео:Вся теория по алканам | Химия ЕГЭ для 10 класса | УмскулСкачать

Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.

Видео:Органическая Химия — Алканы и Цепь из АтомовСкачать

Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы – предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
💡 Видео
Химические и физические свойства алканов | Химия 10 класс #6 | ИнфоурокСкачать