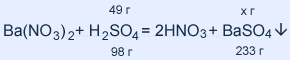8.2Al+3S=Al2S3
Alº-3*2e=Al(3+)2 востановитель
Sº+2*3e=S(2-)3 окислитель
Номер 2
4Al+3O2=2Al2O3
Al2O3+6HCl=2AlCl3+3H2O
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O
2Al(OH)3 + 6H(+) + 3SO4(2-) = 2Al(3+) + 3SO4(2-) + 6Н2O — полный ионный вид (в скобках указаны заряды ионов, которые записывают справа вверху
2Al(OH)3 + 6H(+) = 2Al(3+) + 6Н2O — сокращённый ионный вид.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Запишите уравнения тех реакций которые идут в действительности fe cucl2 ag cucl2
Вопрос по химии:
Помогите пожалуйста, тема химические свойства металлов
1. Запишите уравнения тех реакций,
которые идут в действительности.
Fe + CuCl2 →
K + O2 →
Ag + CuCl2 →
Mg + HCl →
Na + H2O →
Ag + HCl →
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
1) Fe + CuCl2 -> FeCl2 + Cu
2) 4K + O2 -> 2K2O
3) Mg + 2HCl -> MgCl2 + H2
4) 2Na + 2H2O -> 2NaOH + H2
5) Ca + Cl2 -> CaCl2
6) 2Al + 3S -> Al2S3
Прошу вас.
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Запишите уравнения тех реакций которые идут в действительности fe cucl2 ag cucl2

Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.

Ca(NO3)2 = Ca 2+ + 2NO3 − нитрат кльция
Na3PO4 = 3Na + + PO4 3− фосфат натрия
Кислые соли
Ca(HSO4)2 = Ca 2+ + 2HSO4 − гидросульфат кальция
NaH2PO4 = Na + + H2PO4 − дигидрофосфат натрия
Основные соли
(CaOH)2SO4 = 2CaOH + + SO4 2− гидроксосульфат кальция
MgOHNO3 = MgOH + + NO3 − гидроксонитрат магния

а) HCl + Na2SO4 →
б) H3PO4 + CaCl2 →
в) FeCl3 + AgNO3 →
г) KNO3 + NaCl →
д) NaOH+ FeS →
е) KOH + Al2(SO4)3 →
ж) Ca + CuCl2 →
з) Cu + AgNO3 →
и) Mg + ZnS →
к) Cu + Fe(NO3)2 →
Если реакция не может быть осуществлена, объясните почему.

а) 2HCl + Na2SO4 = H2SO4 + 2NaCL 2H + +2Cl − + 2Na + + SO4 2− = 2H + + SO4 2− + 2Na + + 2Cl −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
г) KNO3 + NaCl = KCl + NaNO3 K + + 2NO 3 − + Na + + Cl − = K + + Cl − + Na + + NO 3 −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
ж) Cu + CuCl2 = CaCl2 + Cu
Ca 0 + Cu 2+ + 2Cl − = Ca 2+ + 2Cl − + Cu 0
Ca 0 + Cu 2+ = Ca 2+ + Cu 0
з) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu 0 + 2Ag + + 2NO 3 − = Cu 2+ + 2 NO 3 − + 2Ag 0
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
и) Mg + ZnS ≠ MgS + Zn Реакция не идет т.к. ZnS и MgS нерастворимые соли
к) Cu + Fe(NO3)2 ≠ Реакция не идет т.к. в электрохимическом ряду напряжений Cu расположена правее Fe и не может вытеснять железо из его солей

| Дано: H2SO4, Ba(NO3)2 mр-ра= 980 г ω( H2SO4) = 0,05 mосад. =? | Решение: m(H2SO4) = mр-ра • ω( H2SO4) = = 980 • 0,05 = 49 г M(H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 г / моль M(BaSO4) = 137 + 32 + 16 • 4 = 233г / моль 49 : 98 = х : 233; х = 116,5 г BaSO4 |


1. Fe + H2SO4 = FeSO4 + H2↑
2. FeO + H2SO4 = FeSO4 + H2O
3. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4. CuSO4 + Fe = FeSO4 + Cu
5. FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O

📹 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

8 класс. Составление уравнений химических реакций.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Решение цепочек превращений по химииСкачать

Составление уравнений реакций. 1 часть. 9 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать