
Средняя оценка: 4
Всего получено оценок: 197.
Средняя оценка: 4
Всего получено оценок: 197.
Азотную кислоту впервые стали получать ещё в XVII веке. Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используется метод окисления аммиака.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Общее описание
Формула азотной кислоты HNO3. Это сильная бесцветная кислота с резким запахом. Она неограниченно растворима в воде. Имеет небольшие температуры плавления (-41°C) и кипения (82,6°С). Плотность кислоты – 1,52 г/см 3 .

Концентрированная азотная кислота выделяет ядовитые газы – оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань, вызывает ожоги на коже.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Получение
Азотную кислоту впервые получили алхимики из селитры и железного купороса при термической реакции:
В современной химии существуют лабораторные и промышленные способы получения азотной кислоты. В лабораториях кислоту получают путём нагревания смеси из нитратов и концентрированной серной кислоты:
В промышленности азотную кислоту получают окислением аммиака. Метод осуществляется в три этапа.
Сначала аммиак окисляют на платиновых катализаторах до оксида азота (II):
Это реакция необратима.
Оксид азота (II) или монооксид окисляют до диоксида или оксида азота (IV):
Конечным этапом является поглощение диоксида азота водой в избытке кислорода:
Все реакции протекают с выделением тепла, т.е. являются экзотермическими. Две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока (45-58 %).
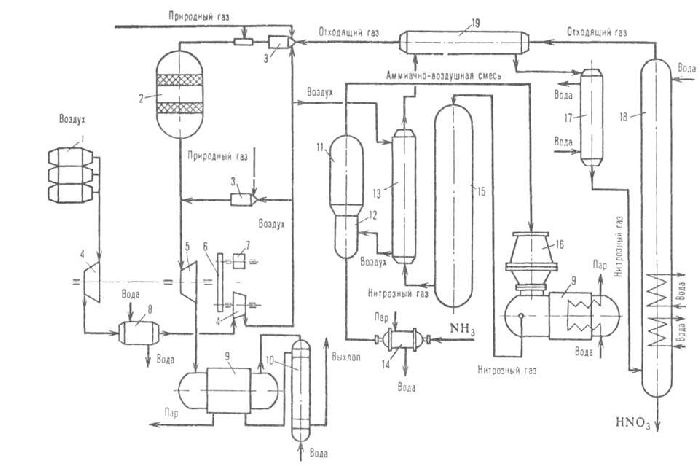
Для повышения концентрации в реакции оксида азота (IV) с водой смещают равновесие, увеличивая давление. Также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. Азотная кислота испаряется и конденсируется.
Лабораторный метод получения азотной кислоты обнаружил немецкий алхимик Иоганн Рудольф Глаубер в XVII веке.
Видео:Получение концентрированной азотной кислотыСкачать

Применение
Азотная кислота используется:
- при производстве удобрений;
- в изготовлении взрывчатых веществ;
- в качестве окислителя ракетного топлива;
- для травления печатных форм в типографии;
- при изготовлении красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Азотная кислота ядовита. При попадании на кожу разрушает белок, оставляя долго заживающие язвы.
Видео:Все темы из задания №25 | Химия ЕГЭ 2023 | УмскулСкачать

Что мы узнали?
Азотную кислоту получают промышленным и лабораторным путём. В промышленности используется метод окисление аммиака, который включает три реакции. Сначала окисляется аммиак, затем оксид азота (II). Конечной реакцией является поглощение диоксида азота водой. Для повышения концентрации в обратимых реакциях повышают давление. В лабораториях кислоту получают действием серной кислоты на нитраты. Азотная кислота используется в промышленности для производства удобрений, взрывчатки, лекарств, красок.
Видео:Видео 360 | Производство азотной кислоты. Неорганическая химия. Азот.Скачать

Основные способов получения азотной кислоты
Задача 904.
Указать химические реакции, в результате которых из природных веществ получают в настоящее время азотную кислоту.
Решение:
а) Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. Аммиак получают фиксацией атмосферного азота водородом. Реакция между азотом и водородом протекает при высокой температуре, давлении и в присутствии катализатора:
Затем аммиак окисляют кислородом воздуха при нагревании и в присутствии катализатора:
Образовавшийся NO легко переходит в NO2:
Оксид NO2 с водой даёт азотную кислоту:
б) Существует способ получения азотной кислоты из селитры:
в) Существуют заводы, которые используют для получения азотной кислоты аммиак, как побочный продукт коксования каменного угля (газовая вода) и при карбидном получении аммиака:
Задача 905.
Почему при получении азотной кислоты из селитры необходимо брать концентрированную серную кислоту, а селитру — в виде твердого вещества? Почему реакционную смесь нельзя сильно нагревать?
Решение:
При получении азотной кислоты из селитры протекает реакция:
Из уравнения реакции следует, что образуется азотная кислота и сульфат натрия, которые в водном растворе будут полностью диссоциированы на ионы:
В водном растворе связывание ионов Н + и NO3 – , Na + и SO2 — не происходит, т. е. реакция обмена в водном растворе практически не происходит. Поэтому для получения азотной кислоты из селитры необходимо процесс проводить в неводном растворе или проводить процесс с твёрдой селитрой и безводной (концентрированной) серной кислотой.
Реакционную смесь нельзя сильно нагревать, потому что при нагревании селитра разлагается с образованием нитрита натрия и кислорода:
2NaNO3 
Образуемый при этом нитрит натриz разлагается на Na2O, NO и NO2:
2NaNO2 
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Нитраты. Нитриты
Задача 906.
Какова термическая устойчивость нитратов и нитритов? Что происходит при нагревании следующих солей: NaNO2, Рb(NO2)2, NH4NO2, NaNO3, Рb(NO3)2, АgNO3, NH4NO3? Написать уравнения протекающих реакций.
Решение:
Соли азотистой кислоты – нитриты и соли азотной кислоты – нитраты термически неустойчивые соединения. Поэтому при нагревании они разлагаются:
а) При нагревании нитрита натрия происходит его расплавление:
NaNO2(тв) 
б) При нагревании нитрита свинца образуются оксид свинца, оксид азота (I) и кислород:
2Pb(NO2)2 
в) При нагревании нитрита аммония образуется молекулярный азот и пары воды:
NH4NO2 
г) При нагревании нитрата натрия образуются нитрит натрия и кислород:
2NaNO3 
д) При нагревании нитрата свинца (II) образуются оксид свинца (II), кислород и диоксид азота:
2Pb(NO3)2 
е) При нагревании нитрата серебра образуются серебро, кислород и диоксид азота:
2AgNO3 
ж) При нагревании нитрата аммония образуются оксид азота (I), и вода:
NH4NO3 
2NH4NO3 
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Please wait.
Видео:Три способа получения азотной кислоты [NurdRage]Скачать
![Три способа получения азотной кислоты [NurdRage]](https://i.ytimg.com/vi/T0IGRlvcU4I/0.jpg)
We are checking your browser. gomolog.ru
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Азотная кислота. 11 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702d4d1199e01f74 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
🎬 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение АЗОТНОЙ кислотыСкачать

Получение азотной кислотыСкачать

распознавание растворов соляной, азотной и серной кислотСкачать

азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Лабораторная работа №13. Свойства азотной кислоты. 9 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

как получают азотную кислотуСкачать

Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Получение азотной кислотыСкачать

