ГДЗ (готовое домашние задание из решебника) на § 13 №7, Номера по учебнику Химия. 8 класс. Учебник для общеобразовательных организаций / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков. Просвещение, 2019-2021г.
Условие
7. Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути(2). Запишите уравнение этой реакции. К какому типу реакций по тепловому эффекту она относится?
2HgO= 2Hg+O2^
Как и большинство реакций разложения, эта реакция является эндотермической.
Решение 1
Подробное решение
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Популярные решебники
Издатель: О. С. Габриелян, Дрофа, 2013-2019г
Издатель: Габриелян Остроумов, Сладков. Просвещение, 2019-2021г
Издатель: Г.Е. Рудзитис, Ф.Г. Фельдман. Просвещение, 2016-2021г.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Запишите уравнение реакции ртути с одним из компонентов воздуха
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Назовите аллотропные модификации кислорода и сравните их свойства.
Для кислорода характерны две аллотропные модификации: кислород O2 и озон O3. Эти простые вещества различаются числом атомов в молекуле.
Сравнение физических свойств.
Кислород ― бесцветный газ, без вкуса и запаха, малорастворим в воде, плотность при н.у. 1,43 г/л.
Озон ― голубой газ с характерным запахом свежести, ядовит, намного лучше растворяется в воде, чем кислород, плотность в 1,5 раза больше, чем у кислорода, то есть 2,1 г/л.
Сравнение химических свойств.
Кислород взаимодействует со многими веществами при нагревании с выделением тепла и света.
Озон значительно более химически активен, чем кислород. Это связано с тем, что молекула озона распадается на атом и молекулу кислорода (O3=O2+O), а атомарный кислород намного активнее молекулярного. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются, каучук становится хрупким, а красители обесцвечиваются.
Задание 2
Какое значение в природе имеет озон и где он применяется? В верхних слоях атмосферы под влиянием ультрафиолетового излучения Солнца кислород превращается в озон: 3О2 = 2О3. Аллотропное видоизменение кислорода ― озон ― обеспечивает жизнь на Земле. Больше всего его на высоте 15-25 км, где он образует озоновый слой, который поглощает опасные для живых организмов излучения Солнца и защищает Землю от резкого переохлаждения. Без озонового слоя средняя температура на Земле была бы на 30°С ниже.
Озон применяется при обеззараживании (гибнут болезнетворные микроорганизмы) питьевой воды, воды в бассейнах, сточных вод, для отбеливания тканей, удаления запаха (дезодорирования) продуктов питания, дезинфекции воздуха в помещениях.
Задание 3
Запишите уравнения реакций получения кислорода в лаборатории.
Кислород в лаборатории получают из перманганата калия, пероксида водорода, бертоллетовой соли:
1) KMnO4 = K2MnO4 + MnO2 + O2↑ при нагревании
2) 2H2O2 MnO₂ = 2H2O + O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
3) 2KClO3 = 2KCl + 3O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO 2
Каким образом можно:
а) собрать кислород в сосуд;
Кислород можно собрать методом вытеснения воздуха, держа пробирку вниз дном (кислород тяжелее воздуха), или методом вытеснения воды (кислород плохо растворяется в воде) .
б) доказать наличие кислорода в сосуде?
Можно с помощью тлеющей лучины, которая ярко вспыхнет в сосуде, где находится кислород.
Задание 4
Как кислород получают в промышленности?
Двумя способами:
1-й способ. Кислород добывают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами. 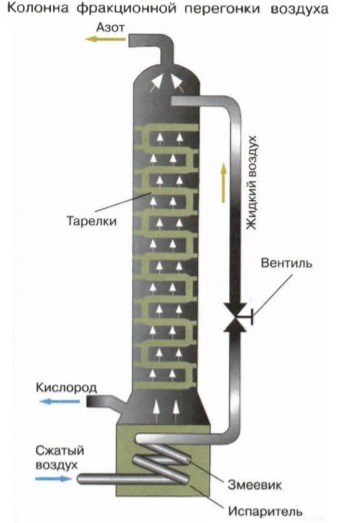
С помощью специальных компрессоров воздух сжимают и охлаждают, при этом все его компоненты переходят в жидкое агрегатное состояние. Жидкий воздух подают в верхнюю часть ректификационной колонны, представляющую собой высокий цилиндр, разделённый множеством поперечных перегородок — тарелок. Стекая по тарелкам, жидкость постепенно нагревается, при этом из неё начинает испаряться самый легкокипящий компонент — азот (tкип.-196°С), который поднимается в верхнюю часть колонны, а стекающая в нижний резервуар жидкость представляет собой жидкий кислород (tкип.-183°С ).
2-й способ. Часто в промышленности кислород добывают реакцией разложения воды — электролизом (под действием электрического тока вода разлагается на два простые вещества — кислород и водород) :
2H2O = 2H2↑ + O2↑ (электрический ток)
Задание 5
Назовите области применения кислорода. В металлургии и химической промышленности, для газовой сварки и резки металлов, в качестве окислителя ракетного топлива космических кораблей, для жизнеобеспечения на подводных лодках, орбитальных станциях и в авиационной технике. В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Задание 6
Запишите уравнения реакций
А) 2SO2 + O2 = 2SO3
Б) 2Li2S + 3O2 = 2SO2 + 2Li2O
В) 2NaNO3 = 2NaNO2 + O2 ↑
Г) 2C2H2 + 5O2 = 4CO2 + 2H2O
Задание 7
Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути (II). Запишите уравнение этой реакции.
Нагревая с помощью линзы красный порошок оксида ртути, Джозеф Присли получил кислород.
2HgO = 2Hg + O2↑
К какому типу реакций по тепловому эффекту она относится? Эндотермическая реакция.
Задание 8
Подготовьте сообщение по одной из тем:
а) «Происхождение и изменение состава земной атмосферы»;
Ранняя вулканическая атмосфера Земли состояла из метана и кислорода, при этом состав постоянно менялся, поскольку метан окислялся кислородом до углекислого газа, аммиака и воды. Со временем большая часть метана израсходовалась на окисление, сильно сократив концентрацию кислорода, температура атмосферы стала снижаться, вследствие чего пары воды стали конденсироваться, образуя океаны и водоемы, а углекислый газ, растворяясь в водоемах, откладывался в виде карбонатов в горных породах и минералах. Аммиак под действием кислорода и бактерий денитрифицировался с высвобождением азота. Современная атмосфера состоит в основном из азота (78%), кислорода (21%) и смеси газов (1%).
б) «Из истории открытия кислорода»;
в) «Значение кислорода в жизни».
Задание 9
Присутствие кислорода в атмосфере Земли делает её пригодной для жизни. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Процессы гниения и разложения (порча) продуктов питания. Метод борьбы: охлаждение или заморозка, использование вакуумной упаковки.
При вдыхании воздуха, содержащего более 60% кислорода, у человека может возникнуть «кислородное отравление» ― гипероксия, от которой чаще всего страдают водолазы или пациенты, использующие кислородные аппараты. Метод борьбы: тщательный контроль технической исправности таких аппаратов, а также строгое соблюдение техники безопасности и инструкции по их применению.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
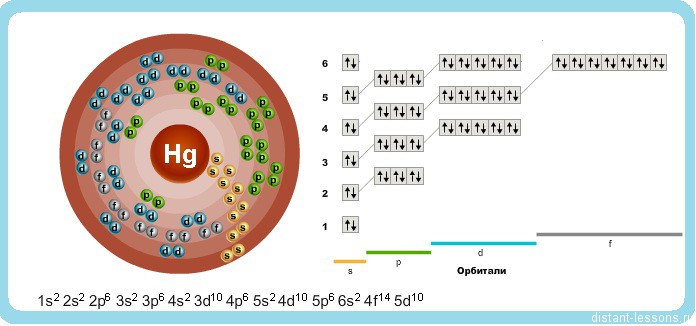
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
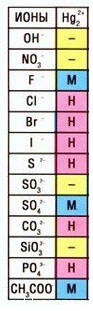
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
📸 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Кислород. Способы собирания газов. Урок 16. Химия 7 класс.Скачать

Воздух. Состав воздуха. 7 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

РТУТЬ, ОСТОРОЖНО!Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Разложение роданида ртути (decomposition of mercury(II) thiocyanate)Скачать

Йодид Ртути(1) - Hg2I2. Реакция Ртути И спиртового раствора Йода. Реакция Hg и I2.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Занятие 11 | Воздух. Кислород и озон. Методы собирания газов | Курс химии | 7 классСкачать

РТУТЬ. Анализ на содержание. Химия – ПростоСкачать

Получение ЙОДИДА РТУТИ HgI2. Реакция РТУТИ и ЙОДА. Опыты по химии.Chemical experiment.Mercury iodideСкачать

Кислород. Физические свойства. Получение. Урок 17. Химия 7 класс.Скачать

Состав воздухаСкачать

Разложение ЙОДИДА РТУТИ HgI2. Получение РТУТИ. Опыты по химии дома. Decomposition of MERCURY IODIDE.Скачать