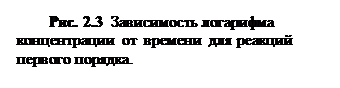Зависимости концентраций участников реакции от времени для элементарных гомогенных, односторонних реакций нулевого, первого, второго и третьего порядка при постоянном объеме
ю и температуре несложно получить из основного постулата химической кинетики.
Реакции нулевого порядка п = 0.
Для элементарной реакции нулевого порядка
основной постулат химической кинетики, с учетом выражения для скорости реакции, имеет вид:
Согласно (1.8), скорость реакции не зависит от концентрации и при заданной температуре реакция протекает с постоянной скоростью. Это имеет место в случаях, когда убыль вещества в результате протекания реакции восполняется поставкой его из другой фазы. Примером может служить омыление водой малорастворимых в воде сложных эфиров в присутствии эфирного слоя.
Нулевой порядок наблюдается также, если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул. Например, при фотохимических реакциях определяющим фактором может служить количество поглощенного света, а не концентрация веществ.
Часто в каталитических реакциях скорость определяется концентрацией катализатора и не зависит от концентрации реагирующих веществ.
Проинтегрируем выражение (1.8), разделив переменные:
где с0 — начальная концентрация исходного вещества А, отвечающая моменту времени, равному нулю; с — концентрация этого же вещества к моменту времени т. Согласно (1.10), концентрация реагирующего вещества линейно убывает со временем (рис. 1.1). Размерность константы скорости совпадает с размерностью скорости.
Рис. 1.1. Зависимость концентрации исходного вещества А от времени для реакции нулевого порядка
Размерность константы скорости для реакции нулевого порядка [А] = моль/л • с.
В кинетике часто используется понятие времени (периода) полупревращения, т. е. времени, за которое прореагирует половина исходного вещества, ту. Подставляя в уравнение (1.10)
с-—, найдем время полупревращения:
Реакции первого порядка п = 1.
Для элементарной реакции (или стадии) первого порядка
или для частного случая формально простой реакции первого порядка по веществу А , например
(по веществу Аг порядок реакции равен нулю, например, при избытке АЛ выражение основного постулата химической кинетики запишется следующим образом:
Уравнением первого порядка могут описываться скорости мономолекулярных реакций (изомеризация, термическое разложение), а также ряд реакций с более сложным механизмом, например гидролиза сахарозы с образованием глюкозы и фруктозы. Эта реакция бимолекулярная, однако из-за избытка воды скорость зависит только от концентрации сахарозы.
Разделив переменные в уравнении (1.12), получим:
Интегрирование выражения (1.13) дает:
Тогда для константы скорости и концентрации реагирующего вещества в любой момент времени получим:
Из (1.15) видно, что константа скорости реакции первого порядка имеет размерность, обратную времени (время)» 1 , например с ‘, мин» 1 , ч ‘, и не зависит от единиц измерения концентрации. Согласно (1.15), концентрация реагирующего вещества убывает со временем, как показано на рис. 1.2.
Рис. 1.2. Зависимость концентрации исходного вещества А от времени для реакции первого порядка
При подстановке в уравнение (1.15) с =-^- получаем выражение для времени полупревращения х к реакции первого порядка,
которое для мономолекулярных реакций еще называют периодом полураспада:
Как видно, время полупревращения не зависит от исходной концентрации реагирующего вещества (рис. 1.2) и обратно пропорционально константе скорости реакции.
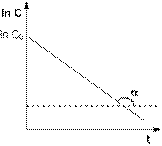
Простое преобразование уравнения (1.15) к виду In с = In с0 — кх показывает, что зависимость концентрации исходного вещества от времени может быть линеаризована при использовании полулогарифмических координат 1пе=/'(т) (рис. 1.3), и ее также можно применять для определения константы скорости из экспериментальных данных.
Рис. 1.3. Зависимость Inc =/(т) для реакции первого порядка
При кинетическом изучении реакции первого порядка вместо концентраций можно использовать любые другие величины, которые меняются пропорционально концентрации, так как в уравнение (1.15) входит отношение концентраций. Например, концентрации можно заменить через количество исходного вещества в системе:
где a = c0-V — начальное количество вещества; a-x = c-V — количество вещества, которое осталось во всем объеме V системы к моменту времени т; х — количество прореагировавшего вещества.
Преобразуя уравнение (1.17), можно получить зависимость количества прореагировавшего вещества к моменту времени т:
Реакции второго порядка п = 2.
Для элементарной реакции (или стадии) второго порядка, когда в элементарном акте реагируют две одинаковые частицы
основной постулат химической кинетики имеет вид 
Примерами реакций, скорость которых описывается уравнением второго порядка, являются: взаимодействие йода с водородом с образованием йодистого водорода, разложение йодистого водорода, омыление ацетоуксусного эфира щелочью, а также разложение диоксида азота
Разделив переменные в уравнении (1.21), получим:
Интегрирование выражения (1.23) дает:
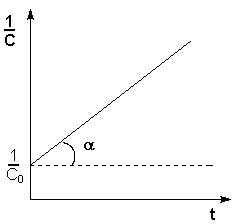
В этом случае от времени линейно зависит — (рис. 1.4).
Размерность константы скорости реакции второго порядка (время 1 • конц ‘) зависит от размерности, в которой выражено не только время, но и концентрация. Если время выражено в секундах, а концентрация в (моль/л), то размерность константы л/моль • с.
Рис. 1.4. Зависимость обратной концентрации исходного вещества от времени для реакции второго порядка
Подставляя в (1.25) с = найдем время полупревращения:
В реакциях второго порядка время полупревращения ту обратно пропорционально концентрации исходного вещества.
Уравнения (1.25) и (1.26) получаются и в том случае, если реагируют разные частицы согласно реакции (1.20), при равенстве концентраций исходных веществ (сл = св).
Если в элементарной реакции реагируют две разные частицы с разными концентрациями, то выражение для скорости можно представить в виде:
Обозначим начальные концентрации веществ А и В как а и b соответственно, а количество А и В, вступивших во взаимодействие ко времени т, как х. Тогда текущие концентрации веществ А и В соответственно равны сл = а — х и св = b — х, уравнение (1.27) примет вид:
Разделив переменные в уравнении (1.28), получим:
Интегрирование рациональных дробей проводят методом неопределенных коэффициентов. Для этого разложим подынтегральное выражение на простейшие дроби:
Приводя к общему знаменателю правую часть равенства (1.30), получаем
Поскольку знаменатели одинаковы, то можно приравнять числители дробей:
Так как в любой момент времени, отличный от нуля, х ^ 0, то это означает, что для выполнения равенства сумма неопределенных коэффициентов должна быть равна нулю:
Тогда из уравнения (1.31) получаем, что:
Так как из уравнения (1.32) следует, что ср, =- 1 • конц 2 ), например л 2 /моль 2 • с.
Уравнения (1.45) и (1.46) получаются и в том случае, если реагируют разные частицы, согласно вышеприведенным реакциям, с одинаковыми концентрациями (сл = св = с( ).
Аналогичным способом, как это было сделано для реакции второго порядка, можно получить выражение для концентраций реагирующих веществ от времени при их неравных друг другу исходных концентрациях:
Аналитические интегральные уравнения, описывающие изменение концентраций исходных веществ от времени, размерности констант скоростей и выражения для времени полупревращения, полученные в данном разделе, сведены в табл. 1.1.
Кинетические уравнения односторонних реакций различных порядков
- Для заданной химической реакции запишите кинетическое уравнение, определите порядок элементарной односторонней реакции и размерность константы ее скорости Готовое решение: Заказ №6836
- Описание и исходные данные задания, 50% решения + фотография:
- Кинетика односторонних реакций2-гопорядка
- Кинетика односторонних реакций n-ого порядка
- Кинетическое уравнение химической реакции. Порядок реакции.
- 💡 Видео
Видео:Порядок реакцииСкачать

Для заданной химической реакции запишите кинетическое уравнение, определите порядок элементарной односторонней реакции и размерность константы ее скорости Готовое решение: Заказ №6836






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Задание 2.
2.1. Химическая кинетика (таблица 3)
- Для заданной химической реакции запишите кинетическое уравнение, определите порядок элементарной односторонней реакции и размерность константы ее скорости.
- Используя значения υ0(начальная скорость реакции) и с0А(начальная концентрация вещества А), определите константу скорости и период полупревращения.
- Определите промежуток времени τ, в течение которого концентрация продукта реакции В достигнет значения сτВ. Рассчитайте скорость реакции в момент времени τ и сравните ее с начальной скоростью. Сделайте вывод о влиянии концентрации реагента на величину скорости реакции.
Решение:
1. скорость реакции описывается кинетическим уравнением:
Реакция третьего порядка, кинетическое уравнение:
Размерность константы: л 2 /моль 2 *с
2. константа скорости реакции:
k= V/[A] 3 =1,15*10 -2 /1,6 3 = 2,81*10 -3 л 2 /моль 2 *с
тогда период полупревращения:
3. по уравнению реакции на образование 0,15 моль В требуется 0,15*3=0,45 моль А, тогда концентрация А станет равной: 1.6-0.45=1.15 моль/л рассчитаем время реакции по кинетическому уравнению:
Я и моя команда оказывает помощь в учёбе по любым предметам и заданиям любой сложности.
Решение задач является неотъемлемой частью обучения в любом учебном заведении, и я смогу помочь в решение задач по любым предметам.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Кинетика односторонних реакций2-гопорядка
Пусть известно, что реакция: н 1A1+ н 2А2> Продукты
протекает как реакция 2-го порядка с константой скорости k. Необходимо:
- 1) получить уравнение, описывающее зависимость концентрации исходных веществ от времени;
- 2) определить период полупревращения исходного вещества А1.
Примем, что начальные количества исходных веществ А1 и А2были равны и составляли a молей и н1= н2(это допущение избавляет нас от громоздких математических преобразований, которые придется проводить, если количества А1 и А2в начальный момент неодинаковы).
Для решения задачи введем некоторые обозначения:
Пусть V,дм 3 — объем реакционной смеси,
C0= , моль/дм 3 — начальная концентрация исходных веществ А1и А2, т.е.концентрация А1 и А2при t=0,
(a-x), моль- количество веществ А1 и А2, присутствующих в смеси в момент времени t,
c=(a-x)/V, моль/дм 3 — концентрация исходных веществ А1 и А2, в момент времени t.
Так как по условию данная реакция протекает как реакция 2-ого порядка, имеем:
или — = k• c 2 (1.20)
Интегрируя уравнение (1.20), получаем:
- 2) — = k• dt разделили переменные
- 3) — =
4) = kt+ const решили простейшее дифференциальное уравнение
Нашли константу интегрирования, учитывая, что при t=0, c=c0имеем:
= k•0+ const, т.е. const =.
Тогда интегральное кинетическое уравнение 2-ого порядка примет вид:
Выражение (1.21) можно представить графически в виде прямой линии, если по оси ординат откладывать 1/с, а по оси абсцисс время t. Тангенс угла наклона прямой к оси абсцисс равен k (рис.1.6)
Интегральное кинетическое уравнение (1.21) позволяет определить концентрацию исходных веществ А1 и А2 в любой момент времени t1и время, в течение которого концентрация исходных веществ примет любое заданное значение.
Например, нас интересует время (ф), в течение которого концентрация исходных веществ уменьшится в двое, т.е. период полупревращения веществ А1 и А2. Тогда при t= ф, c=c0/2подставляя эти величины в (1.21) имеем:
или , откуда (1.22)
В результате оказалось, что период полураспада вещества для реакции 2-ого порядка зависит от начальной концентрации веществ.
Видео:Скорость химических реакций. 9 класс.Скачать

Кинетика односторонних реакций n-ого порядка
протекает как реакция n-ого порядка (n может быть целым или дробным числом) с константой скорости k. Пусть (для простоты) исходные количества вещества А1,А2, А3 были одинаковыми и равными c0. Тогда
где c- концентрация веществ А1,А2, А3 в реакционной смеси.
Решая уравнение (1.23) с учетом начальных условий ( при t=0, c=0), получим:
Для времени полупревращения(ф)из (1.24) имеем:
Уравнение (1.25), выраженное в форме
можно представить графически в виде прямой линии (см. рис. 1.7), угол наклона прямой зависит от порядка реакции.
Уравнение (1.26) можно применить для определения порядка реакции.
Для этого следует:
1. Провести несколько опытов с различными начальными концентрациями исходных веществ и определить во всех случаях период полупревращенияф.
2. Построить график зависимости от lgc0 и определить порядок реакции из соотношения (1.27).
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

Кинетическое уравнение химической реакции. Порядок реакции.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + . ––> еЕ + .
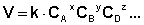
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
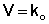
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
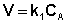
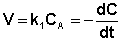
После интегрирования выражения (II.7) получаем:
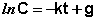
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
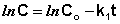
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
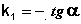
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
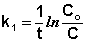
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
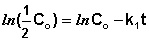
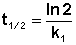
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
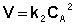
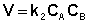
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
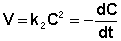
После разделения переменных и интегрирования получаем:
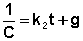
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
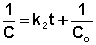
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
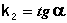
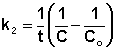
Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка.
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
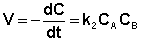
В этом случае для константы скорости получаем выражение
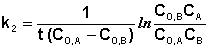
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции. Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика которой изучается в лабораторном практикуме по физической химии:
Если проводить эту реакцию при близких концентрациях этилацетата и воды, то общий порядок реакции равен двум и кинетическое уравнение имеет следующий вид:
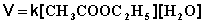
При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация вещества, находящегося в избытке, практически не изменяется и может быть включена в константу скорости; кинетическое уравнение для двух возможных случаев принимает следующий вид:
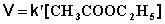
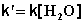
2) Избыток этилацетата:
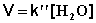
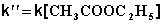
В этих случаях мы имеем дело с т.н. реакцией псевдопервого порядка. Проведение реакции при большом избытке одного из исходных веществ используется для определения частных порядков реакции.
💡 Видео
Составляем кинетические уравненияСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

задачи на порядок хим реакцииСкачать

ЛЕКЦИЯ №4 || Химическая кинетика || Методы определения порядка реакцииСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

5 3 Порядок реакцииСкачать

46. Вычисление пределов с помощью эквивалентных бесконечно малых функцийСкачать

Основы химической кинетикиСкачать

ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Скорость химической реакцииСкачать

Метод контурных токов - определение токов. ЭлектротехникаСкачать

Скорость реакции. Химия – ПростоСкачать

Порядок реакции и энергия активацииСкачать