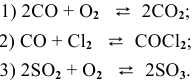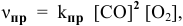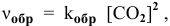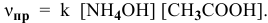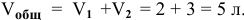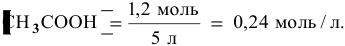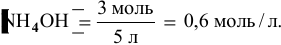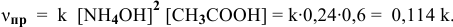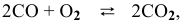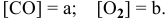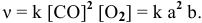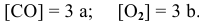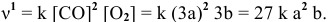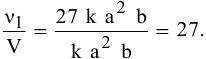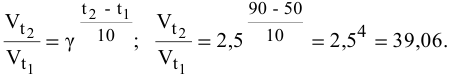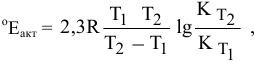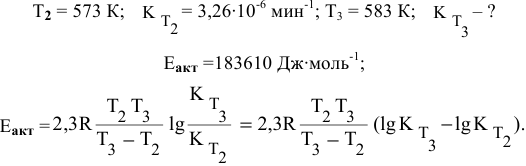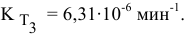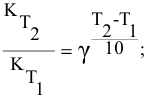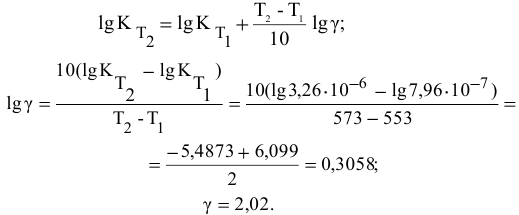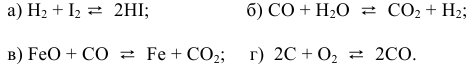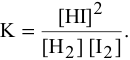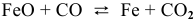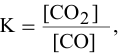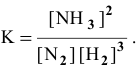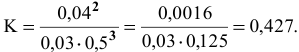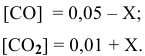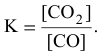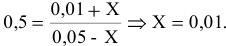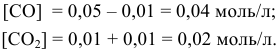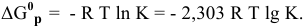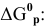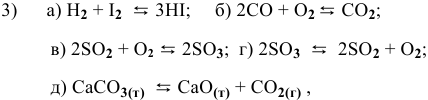- Скорости прямой и обратной реакци разложения СО
- Зависимость скорости реакции от концентраций веществ
- Задачи с решениями на химическую кинетику и химическое равновесие
- Химическая кинетика и химическое равновесие
- Пример 59
- Задача 43
- Задача 44
- Задача 45
- Задача 46
- Задача 47
- Задача 48
- Задача 49
- Задача 50
- Задача 51
- Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17
- Описание и исходные данные задания, 50% решения + фотография:
- 🎬 Видео
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Скорости прямой и обратной реакци разложения СО
Задача 128
Выразите через концентрации скорости прямой и обратной реакций и константу равновесия для системы:
2CO(г) CO2(г) + С(т), ∆Н
1. Выражение для прямой и обратной реакции для системы: 2CO(г) CO2(г)+С(т), ∆Н
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. («действующая масса» – синоним современного понятия «концентрация»).
Закон действия масс (ЗДМ) выполняется только для элементарных химических реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.
ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Выражение скорости прямой реакции будет иметь вид: vпр. = kпр.[СО] 2 .
Выражение скорости обратной реакции будет иметь вид: vобр. = kобр.[СО2].
2. Константа равновесия
Можно выразить константу равновесия через скорость реакции. При этом константа равновесия определяется как
k1 — константа скорости прямой реакции, k-1 — константа скорости обратной реакции.
Можно выразить Кр через соотношение констант прямо и обратной реакций, получим:
3. Смещение равновесие в системе:
а) При повышении температуры равновесие сместится в сторону обратной реакции, так как прямая реакция – экзотермическая. Согласно принципу Ле-Шателье равновесие реакции смещается в сторону уменьшения оказываемого на систему действия. Данная реакция протекает с выделением тепла (∆Н
б) При понижении давления смещение равновесия будет наблюдаться в сторону прямой реакции, так как объм газообразного реагента в два раза больше объема продукта реакции системы равну: 2V(СО2) > V(CO).
в) Понижение концентрации продукта реакции (отведение из системы СО2) будет увеличивать скорость прямой реакции, поэтому согласно принципа Ле-Шателье при понижениии концентрации СО2 равновесие сместится в сторону прямой реакции, т. е. в сторону увеличения образования СО2.
Зависимость скорости реакции от концентраций веществ
Задача 129.
В закрытом сосуде находиться смесь газов, состоящая из 1 моль азота и 3 моль водорода которая реагирует по уравнению:
N2 + 3H2 = 2NH3.
Во сколько раз уменьшится скорость прямой реакции после того как прореагирует 0,65 моль азота.
Решение:
Зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Поэтому изменение концентрации хотя бы одного из реагирующих веществ ведет к изменению ее скорости.
Выражение для скорости реакции до изменения концентрации вещества можно записать в общем виде:
V = k . [N2] . [H2] 3
Обозначим скорость реакции до изменения концентраций v1, а после изменения концентраций v2.
Ответ: скорость прямой реакции уменьшится в 1,5 раза.
Видео:Химическое равновесие. Закон действующих масс.Скачать

Задачи с решениями на химическую кинетику и химическое равновесие
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
Пример 59
Для реакции 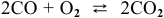
где 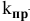
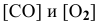
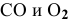
где 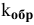
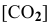
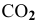
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 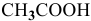
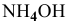
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
Согласно закону действия масс выражение скорости химической реакции
Для определения скорости реакции необходимо знать величину концентраций веществ 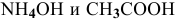
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 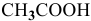
В исходном растворе гидроксида аммония содержится 1-3=3 моль 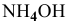
Определяем начальную скорость реакции:
Задача 44
Как изменится скорость прямой реакции
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
Согласно уравнению Менделеева-Клапейрона 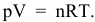
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
Скорость реакции после повышения давления
Повышение скорости реакции будет следующим:
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
Задача 46
Константа скорости реакции разложения HI равна 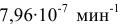
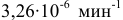
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
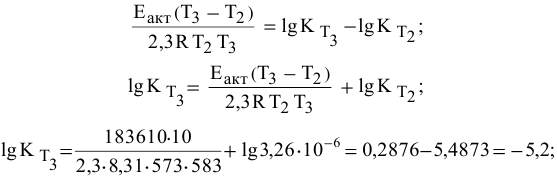
Определяем температурный коэффициент по следующей формуле:
Задача 47
Написать математические выражения констант равновесия следующих реакций:
Решение:
а) Для гомогенной реакции
б) Для гетерогенной реакции
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 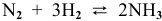
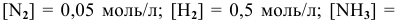
Решение:
Подставим в выражение константы равновесия значения равновесных концентрации:
Задача 49
Константа равновесия реакции 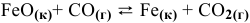

Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 
Математическое выражение константы равновесия данной реакции:
Отсюда находим значение X:
В состоянии равновесия значения концентрации будут следующими:
Задача 50
Для реакции 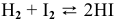
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
Рассчитываем вначале значение
Находим значение константы равновесия реакции в стандартных условиях 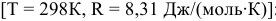
Задача 51
В каком направлении сместится равновесие следующих химических реакций:
если увеличить температуру?
если увеличить концентрацию 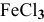
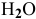
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 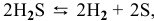
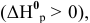
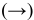
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 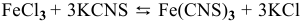
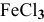
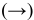
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 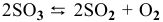


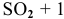
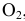
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Дано уравнение реакции (см. вариант в табл. 4).
1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция?
2. Рассчитайте скорость прямой реакции v0 в начальный момент времени при начальных концентрациях c0 реагентов. Рассчитайте, как изменится скорость прямой реакции к моменту времени vt , когда прореагирует 20 % вещества В.
3. Рассчитайте изменение скорости прямой реакции v при одновременном повышении давления в системе в два раза и температуры T на 20 ° С при g = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
1. Запишите выражение для константы равновесия Kc химической реакции через концентрации веществ.
2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
3. Укажите направление смещения равновесия при изменении каждого из факторов (c, p, V и Т).
Решение :
1. скорость прямой и обратной реакции:
Так как все вещества находятся в газообразном и твердом состоянии, то реакция является гетерогенной
2. в начальный момент времени скорость реакции равна:
Количество вещества H 2 , вступившего в реакцию: 3*0.2 = 0.6 моль, в системе останется непрореагировавшими 3-0,6=2,4 моль
По уравнению реакции на 0,6 моль H 2 требуется 0,6/2=0,3 моль SiCl 4 , в системе останется 2-0,3=1,7 моль SiCl 4 . И скорость реакции станет равной:
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5). Определите молярную концентрацию вещества (c), молярную концентрацию эквивалентов вещества (cэк). Номер варианта 17
- Имеется раствор слабого электролита или электролита средней силы (см. вариант в табл. 7). 1. Запишите уравнения диссоциации и выражения для констант диссоциации (Kд) Номер варианта 17
- Дана схема реакции (см. вариант в табл. 2): 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции; 2) составьте электронный баланс FeCl2 + HNO3 + HCl → FeCl3 + NO + H2O
- Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин Hf0298 и S0298 . SiCl4(г) + 2Н2(г) = Si(т) + 4HCl(г)
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🎬 Видео
Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Составляем кинетические уравненияСкачать

Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Скорость химических реакций. 9 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Интуитивное понимание формулы константы равновесия (не обязательно для продолжения курса)Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

83. Химическое равновесиеСкачать

Скорость реакции. Химия – ПростоСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать