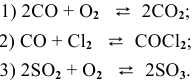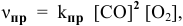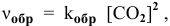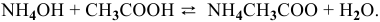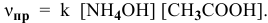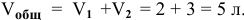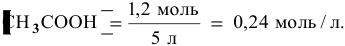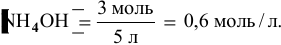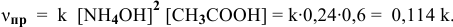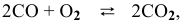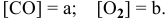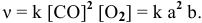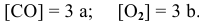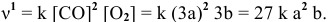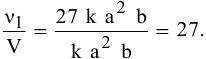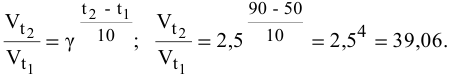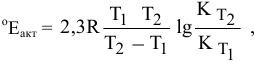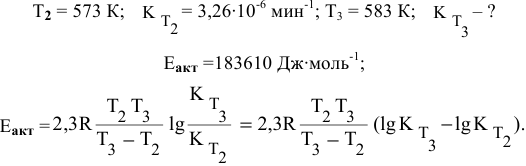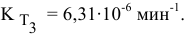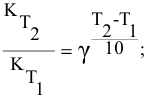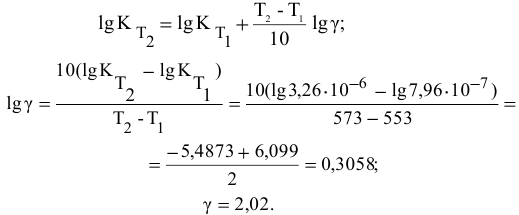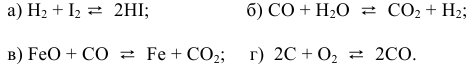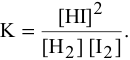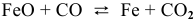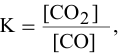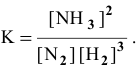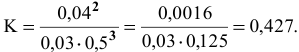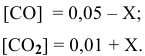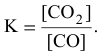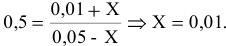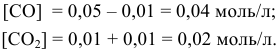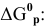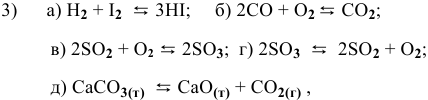- Скорости прямой и обратной реакци разложения СО
- Зависимость скорости реакции от концентраций веществ
- Задачи с решениями на химическую кинетику и химическое равновесие
- Химическая кинетика и химическое равновесие
- Пример 59
- Задача 43
- Задача 44
- Задача 45
- Задача 46
- Задача 47
- Задача 48
- Задача 49
- Задача 50
- Задача 51
- Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17
- Описание и исходные данные задания, 50% решения + фотография:
- 🌟 Видео
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Скорости прямой и обратной реакци разложения СО
Задача 128
Выразите через концентрации скорости прямой и обратной реакций и константу равновесия для системы:
2CO(г) CO2(г) + С(т), ∆Н
1. Выражение для прямой и обратной реакции для системы: 2CO(г) CO2(г)+С(т), ∆Н
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. («действующая масса» – синоним современного понятия «концентрация»).
Закон действия масс (ЗДМ) выполняется только для элементарных химических реакций, протекающих в одну стадию. Если реакция протекает последовательно через несколько стадий, то суммарная скорость всего процесса определяется самой медленной его частью.
ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Выражение скорости прямой реакции будет иметь вид: vпр. = kпр.[СО] 2 .
Выражение скорости обратной реакции будет иметь вид: vобр. = kобр.[СО2].
2. Константа равновесия
Можно выразить константу равновесия через скорость реакции. При этом константа равновесия определяется как
k1 — константа скорости прямой реакции, k-1 — константа скорости обратной реакции.
Можно выразить Кр через соотношение констант прямо и обратной реакций, получим:
3. Смещение равновесие в системе:
а) При повышении температуры равновесие сместится в сторону обратной реакции, так как прямая реакция – экзотермическая. Согласно принципу Ле-Шателье равновесие реакции смещается в сторону уменьшения оказываемого на систему действия. Данная реакция протекает с выделением тепла (∆Н
б) При понижении давления смещение равновесия будет наблюдаться в сторону прямой реакции, так как объм газообразного реагента в два раза больше объема продукта реакции системы равну: 2V(СО2) > V(CO).
в) Понижение концентрации продукта реакции (отведение из системы СО2) будет увеличивать скорость прямой реакции, поэтому согласно принципа Ле-Шателье при понижениии концентрации СО2 равновесие сместится в сторону прямой реакции, т. е. в сторону увеличения образования СО2.
Зависимость скорости реакции от концентраций веществ
Задача 129.
В закрытом сосуде находиться смесь газов, состоящая из 1 моль азота и 3 моль водорода которая реагирует по уравнению:
N2 + 3H2 = 2NH3.
Во сколько раз уменьшится скорость прямой реакции после того как прореагирует 0,65 моль азота.
Решение:
Зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ. Поэтому изменение концентрации хотя бы одного из реагирующих веществ ведет к изменению ее скорости.
Выражение для скорости реакции до изменения концентрации вещества можно записать в общем виде:
V = k . [N2] . [H2] 3
Обозначим скорость реакции до изменения концентраций v1, а после изменения концентраций v2.
Ответ: скорость прямой реакции уменьшится в 1,5 раза.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Задачи с решениями на химическую кинетику и химическое равновесие
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
Пример 59
Для реакции 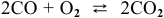
где 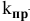
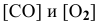
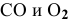
где 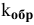
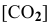
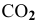
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 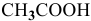
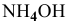
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
Согласно закону действия масс выражение скорости химической реакции
Для определения скорости реакции необходимо знать величину концентраций веществ 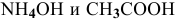
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 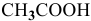
В исходном растворе гидроксида аммония содержится 1-3=3 моль 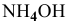
Определяем начальную скорость реакции:
Задача 44
Как изменится скорость прямой реакции
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
Согласно уравнению Менделеева-Клапейрона 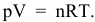
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
Скорость реакции после повышения давления
Повышение скорости реакции будет следующим:
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
Задача 46
Константа скорости реакции разложения HI равна 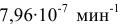
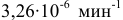
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
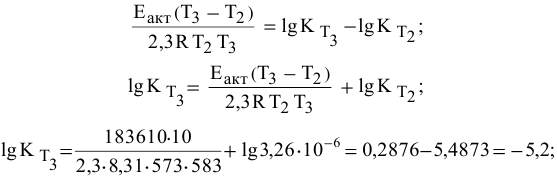
Определяем температурный коэффициент по следующей формуле:
Задача 47
Написать математические выражения констант равновесия следующих реакций:
Решение:
а) Для гомогенной реакции
б) Для гетерогенной реакции
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 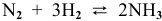
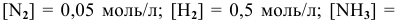
Решение:
Подставим в выражение константы равновесия значения равновесных концентрации:
Задача 49
Константа равновесия реакции 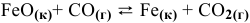

Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 
Математическое выражение константы равновесия данной реакции:
Отсюда находим значение X:
В состоянии равновесия значения концентрации будут следующими:
Задача 50
Для реакции 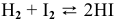
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
Рассчитываем вначале значение
Находим значение константы равновесия реакции в стандартных условиях 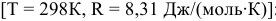
Задача 51
В каком направлении сместится равновесие следующих химических реакций:
если увеличить температуру?
если увеличить концентрацию 
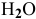
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 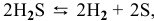
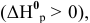
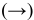
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 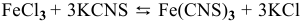
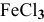
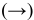
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 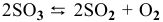


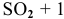
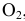
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химическое равновесие. Закон действующих масс.Скачать

Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Дано уравнение реакции (см. вариант в табл. 4).
1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция?
2. Рассчитайте скорость прямой реакции v0 в начальный момент времени при начальных концентрациях c0 реагентов. Рассчитайте, как изменится скорость прямой реакции к моменту времени vt , когда прореагирует 20 % вещества В.
3. Рассчитайте изменение скорости прямой реакции v при одновременном повышении давления в системе в два раза и температуры T на 20 ° С при g = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
1. Запишите выражение для константы равновесия Kc химической реакции через концентрации веществ.
2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
3. Укажите направление смещения равновесия при изменении каждого из факторов (c, p, V и Т).
Решение :
1. скорость прямой и обратной реакции:
Так как все вещества находятся в газообразном и твердом состоянии, то реакция является гетерогенной
2. в начальный момент времени скорость реакции равна:
Количество вещества H 2 , вступившего в реакцию: 3*0.2 = 0.6 моль, в системе останется непрореагировавшими 3-0,6=2,4 моль
По уравнению реакции на 0,6 моль H 2 требуется 0,6/2=0,3 моль SiCl 4 , в системе останется 2-0,3=1,7 моль SiCl 4 . И скорость реакции станет равной:
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5). Определите молярную концентрацию вещества (c), молярную концентрацию эквивалентов вещества (cэк). Номер варианта 17
- Имеется раствор слабого электролита или электролита средней силы (см. вариант в табл. 7). 1. Запишите уравнения диссоциации и выражения для констант диссоциации (Kд) Номер варианта 17
- Дана схема реакции (см. вариант в табл. 2): 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции; 2) составьте электронный баланс FeCl2 + HNO3 + HCl → FeCl3 + NO + H2O
- Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин Hf0298 и S0298 . SiCl4(г) + 2Н2(г) = Si(т) + 4HCl(г)
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🌟 Видео
Составляем кинетические уравненияСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Скорость химических реакций. 9 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Скорость реакции. Химия – ПростоСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

83. Химическое равновесиеСкачать

Интуитивное понимание формулы константы равновесия (не обязательно для продолжения курса)Скачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать