Задача 688.
Написать уравнения электродных процессов, протекающих при электролизе водных растворов ВаСI2 и РbNO3)2 с угольными электродами.
Решение:
а) электролиз водного раствора ВаСI2
ВаСI2 – соль активного металла и кислородной кислоты. Стандартный электродный потенциал системы: Ba 2+ = 2 
2H2O + 2 
На аноде будет происходить электрохимическое окисление хлора, стандартный потеннциал которого (+1,36 В) выше, чем воды (+1,23 В). Хлор будет окисляться, потому что наблюдается значительное перенапряжение процесса окисления воды, материал анода оказывает тормозящее воздействие на его протекание:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение:
Таким образом, при электролизе водного раствора хлорида бария одновременно с выделением газообразного водорода (катод) и газообразного хлора (анод), образуется гидроксид бария (катодное пространство).
б) электролиз водного раствора Рb(NO3)2
Рb(NO3)2 – соль средней активности металла и кислородной кислоты, которая в водном растворе диссоциирует по схеме:
Стандартный электродный потенциал электрохимической системы Pb 2+ /Pb (-0,13В) положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) незначительно. Поэтому на катоде будет выделяться свинец 

Pb2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O — 4 
Ионы NO3 -, движущиеся при гидролизе к аноду, будут накапливаться в анодном пространстве. Умножим уравнение катодного процесса на два и сложим его с уравнением анодного процесса, получим суммарное уравнение:
2Pb 2+ + 2H2O = 2Pb + O2↑ + 4H +
у катода у анода
Приняв во внимание, что одновременно происходит накопление ионов NO3 — в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, при электролизе водного раствора соли нитрата свинца одновременно с выделением свинца (катод) и газообразного кислорода (анод), образуется азотная кислота (анодное пространство).
Задача 689.
Написать уравнения электродных процессов, протекающих при электролизе водных растворов FeCl3 и Са(NO3)2 с инертным анодом.
Решение:
а) Электролиз водного раствора FeCl3
В водном растворе соль FeCl3 диссоциирует по схеме: FeCl3 ⇔ Fe 3+ + 3Cl — . Стандартный электродный потенциал системы Fe 3+ + 3 
Fe 3+ + 3 
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые, соединяясь друг с другом, образуют молекулу хлора:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложим, предварительно умножив уравнение катодного процесса на два и на три уравнения анодного процессов, получим суммарное уравнение:
2Fe 3+ + 6Cl — = 2Fe + 3Cl2
При электролизе FeCl3 в водном растворе с инертными электродами образуются металлическое железо, и выделяется газообразный хлор.
б) Электролиз водного раствора Са(NO3)2
Са(NO3)2 в водном растворе диссоциирует по схеме:
Стандартный электродный потенциал системы Ca 2+ + 2 
2H2O + 2 
а ионы кальция Са 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O — 4 
Иионы NO3 — на аноде разряжаться не будут, а будут накапливаться в анодном пространстве.
Умножив уравнение катодного процесса на два, и сложив, его с уравнением анодного процесса получим суммарное уравнение электролиза:
Приняв во внимание, что одновременно происходить накопление ионов кальция в катодном пространстве и нитрат-ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Молекулярная реакция после приведения членов, получим:
Таким образом, при электролизе раствора соли нитрата кальция одновременно с выделением водорода и кислорода образуется гидроксид кальция (в катодном пространстве) и азотная кислота (в анодном пространстве).
- Записать уравнения электродных процессов которые протекают при электролизе раствора k2co3
- Как написать хороший ответ?
- Задачи к разделу Электролиз солей
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- 🌟 Видео
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Записать уравнения электродных процессов которые протекают при электролизе раствора k2co3
Вопрос по химии:
Напишите схему электролиза раствора K2CO3 при нерастворимых электродах. Можно ли при этом получить гидроксид калия?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Электролиз. 10 класс.Скачать

Задачи к разделу Электролиз солей
В данном разделе представлены задачи по теме Электролиз: составление уравнений электродных реакций, протекающих при электролизе, расчеты с применением законов Фарадея.
Задача 1. Составьте уравнения электродных реакций, протекающих при электролизе с нерастворимыми анодами: а) MgCl2; б) MgCl2 и ZnSO4. Рассчитайте, сколько выделится хлора в литрах (н. у.) при пропускании тока силой 5А в течение 3 ч.
Решение.
Переведем часы в секунды: t = 3 ч = 10800 с
V = 11,2∙5∙10800/96500 = 6,3 л.
Составим уравнения электродных реакций, протекающих при электролизе:
MgCl2 расплав
К: Mg 2+ + 2e → Mg 0
A: 2Cl — — 2e → Cl2 0
MgCl2 раствор
К: 2H2O + 2e → H2 0 + 2OH —
A: 2Cl — — 2e → Cl2 0
MgCl2 и ZnSO4растворы
К: 2H2O + 2e → H2 0 + 2OH —
A: 2Cl — — 2e → Cl2 0
Задача 2. Составьте уравнения электродных реакций, протекающих при электролизе раствора CuSO4 с растворимым медным анодом и нерастворимым графитовым анодом. Рассчитайте, сколько растворится меди на аноде при пропускании тока силой 10 А в течение 3 ч.
Решение.
Применим II закон Фарадея
ЭCu = 64/2 = 32 г/моль
m =32∙10∙3∙3600/96500 = 35,8 г
E 0 (Cu 2+ /Cu) = 0,34 В
Растворимый медный анод:
На катоде возможно восстановление меди и воды. Но потенциал меди имеет более положительное значение, чем потенциал восстановления воды (E 0 (H2O/H + ) = -0,41 В), поэтому на катоде будет восстанавливаться медь. На аноде также возможно окисление меди или воды и, т.к. потенциал меди имеет меди имеет меньшее значение, чем потенциал окисления воды (E 0 (H2O/O2) = 0,82 В), то на аноде будет окисляться медь:
К: Cu 2+ + 2e = Cu 0
A: Cu 0 – 2e = Cu 2+
Cu 2+ + Cu 0 = Cu 0 + Cu 2+
Инертный нерастворимый анод:
Соль состоит из катиона неактивного металла и аниона кислородсодержащей кислоты. В этом случае на катоде происходит восстановление меди, а на аноде окисление воды:
K: Cu 2+ + 2e — = Cu
A: 2H 2 O -4e — = O 2 + 4H +
Задача 3. При электролизе соли трехвалентного металла ток силой в 3 А в течение 2 часов выделил на катоде 4,18 г металла. Определите, какой это металл. Напишите уравнения катодного и анодного процессов, а также суммарное уравнение электролиза расплава и водного раствора карбоната натрия с платиновым анодом.
Решение.
По закону Фарадея:
Подставим значения
М = 4,18∙3∙96500/(3∙2∙3600) = 56 г/моль
Молярную массу равную 56 г/моль имеет атом железа
Напишем уравнения катодного и анодного процессов:
Платиновый анод – инертный, поэтому он не будет участвовать в процессе.
Na2CO3– соль, образованная катионом активного металла и аниона кислородсодержащей кислоты, поэтому, в случае раствора, в обоих процессах будет участвовать вода:
К: 2H2O + 2e → H2 0 + 2OH —
А: 2 H 2 O — 4 e → O2 0 + 4 H +
К: Na + + e → Na 0
А : 2CO 3 2- — 4e — → 2CO2 + O 2
Задача 4. При рафинировании меди током 4,5 А за 1,5 часа выделяется 7,5 г меди. Рассчитайте выход по току. Напишите уравнения катодного и анодного процессов, а также суммарное уравнение электролиза водного раствора Pb(NO3)2: а) с угольным анодом; б) со свинцовым анодом.
Решение.
Применим закон Фарадея с учетом выхода по току:
Э(Cu) = 64/2 = 32 г/моль
Составим уравнения катодного и анодного процессов, а также суммарное уравнение электролиза водного раствора Pb(NO3)2:
Pb(NO3)2— соль, образованная катионом неактивного металла и аниона кислородсодержащей кислоты, поэтому
а) с угольным анодом
К: Pb 2+ + 2e → Pb 0
А: 2 H 2 O — 4 e → O 2 0 + 4 H +
2Pb 2+ + 2H2O → 2Pb 0 + O2 0 + 4H +
В прикатодном пространстве накапливается азотная кислота.
б) со свинцовым анодом
К: Pb 2+ + 2e → Pb 0
А: Pb 0 — 2 e → Pb 2+
Pb 2+ + Pb 0 → Pb 0 + Pb 2+
Задача 5. Найдите объем водорода, который выделится при пропускании тока силой в 5 А в течение 3,5 ч через водный раствор серной кислоты. Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора Н2SО4 с инертным анодом.
Решение.
Применим II закон Фарадея
V = 11,2∙5∙3,5∙3600/96500 = 7,3 л
Напишим уравнения анодного и катодного процессов, а также суммарное уравнение электролиза раствора Н2SО4 с инертным анодом:
К: 2H + + 2e → H2 0
А: 2 H 2 O — 4 e → O 2 0 + 4 H +
Таким образом, при электролизе серной кислоты с инертными анодами происходит разложение воды.
Задача 6. При электролизе одного из соединений олова ток силой в 2,5А за 20 мин выделил на электродах металл массой 0,9 г. Чему равна валентность олова в этом соединении. Какие продукты могут быть получены при электролизе раствора SnSO4 с графитовыми электродами.
Решение.
По закону Фарадея:
Следовательно, валентность олова z = 4
SnSO4 — соль, образованная катионом неактивного металла и аниона кислородсодержащей кислоты, поэтому в процессе будут участвовать Sn и H2O.
Электроды инертные, поэтому в процессах участия не принимают:
К: Sn 2+ + 2e → Sn 0
А: 2 H 2 O — 4 e → O 2 0 + 4 H +
2Sn 2+ + 2H2O → 2Sn 0 + O2 0 + 4H +
В прикатодном пространстве накапливается серная кислота.
Задача 7. Сколько времени потребуется на электролиз раствора KCl при силе тока 5 А, чтобы выделить хлор объемом 11,2 л (н.у.), если выход по току составляет 90%? Напишите уравнения анодного и катодного процессов, а также суммарное уравнение электролиза.
Решение
Применим закон Фарадея, учитывая при этом выход по току:
t =11,2∙96500∙2/(0,9∙22,4∙5∙3600) = 5,95 ч
KCl — соль, образованная катионом активного металла и аниона бескислородной кислоты, поэтому в катодном процессе участвует вода, а в анодном – хлор:
К: 2H2O + 2e → H2 0 + 2OH —
А: 2 Cl — — 2 e → Cl 2 0
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
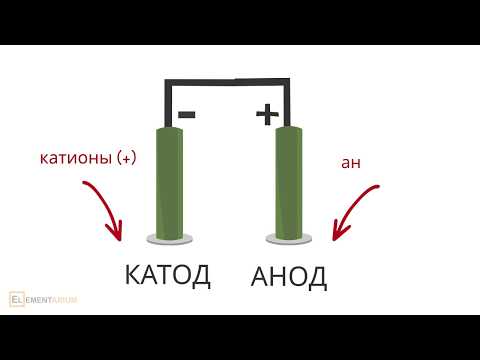
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз расплавов и растворов. 10 класс.Скачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:ХИМИЯ 11 класс : Электролиз растворовСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:ЭлектролизСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
🌟 Видео
Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Химия / 9 класс / ЭлектролизСкачать

91. Электролиз. Задачи (часть 2)Скачать

Электролиз: понять или заучить? | Химия ЕГЭ 2022 | УмскулСкачать

Всё об электролизе: как не терять баллы в 22 задании? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать
Электролиз раствора KIСкачать

74. Что такое электролиз. видео1. общее понятие элекролизаСкачать

Технологический институт - гальванический элемент, электролиз, коррозия. Задачи.Скачать

Решаю задачу №34 нового типа на электролиз | ЕГЭ по химии 2020Скачать




