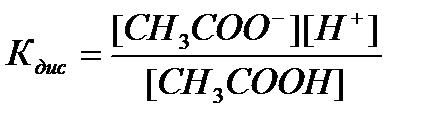Электрохимия — это раздел физической химии, в котором изучают физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц.
Проводники электрического тока делятся на электронные (проводники первого рода) и ионные (проводники второго рода).
Проводники первого рода — металлы в твердом и расплавленном состоянии. В них электрический ток осуществляется движением электронов электронного газа. При этом прохождение электрического тока в проводниках первого рода не сопровождается химическими изменениями их материала.
Проводники второго рода — некоторые растворы солей, кислот и оснований, а также некоторые вещества, главным образом соли, в расплавленном состоянии. Электрический ток в них осуществляется движением ионов (как положительных, так и отрицательных).
Электролиты — это химические соединения, которые в растворе (полностью или частично) диссоциируют на ионы. Диссоциация приводит к разъединению, отрыву ионов от молекулы или кристалла в результате взаимодействия ионов с молекулами растворителя.
Молекулы растворителей, обладающих хорошей диссоциирующей способностью, являются сильно полярными, и, следовательно, такие растворители имеют высокую диэлектрическую проницаемость.
Под действием электрических полей, создаваемых ионами электролита, полярные молекулы растворителя притягиваются ионами, ориентируются около них и в свою очередь, притягивая ионы к себе, ослабляют связь между ионами.
Подобным же образом они действуют и на ионы, составляющие решетку, например, ионного кристалла. Число ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности — сумма положительных зарядов равна сумме отрицательных. Таким образом, несмотря на наличие ионов, раствор электролита остается электронейтральным.
Электростатическое взаимодействие иона электролита с молекулами растворителя — сольватация — приводит к образованию вокруг иона молекулярного комплекса — сольвата. Совокупность молекул растворителя, окружающих ион, представляет собой сольватную оболочку. Сольватацию в водных растворах называют гидратацией.
Различают сильные и слабые электролиты.
Сильные электролиты диссоциируют в растворе почти полностью. В водных растворах сильными электролитами являются многие минеральные кислоты (HN03, НС1, НС104 и др.), основания (щелочи), большинство солей.
Слабые электролиты диссоциируют в растворе только частично. К слабым электролитам в водных растворах относятся почти все органические кислоты и основания.
Сильные и слабые электролиты являются двумя различными состояниями химических соединений (электролитов) в зависимости от природы растворителя. В одном растворителе данный электролит может быть сильным электролитом, в другом — слабым.
Процесс диссоциации слабых электролитов является обратимым, поскольку ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы.
Рассмотрим простейший случай слабого сильно разбавленного бинарного одно-одновалентного электролита, диссоциирующего по схеме
Важные характеристики электролита:
— степень диссоциации α — доля продиссоциировавших молекул из числа первоначально взятых
— константа диссоциации Kd, которую, для данного случая можно представить (используя закон действующих масс — при постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, в простейших случаях равной коэффициенту перед формулой данного вещества в уравнении реакции) в виде
Например,
Если 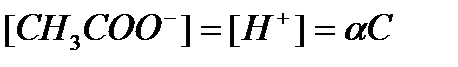
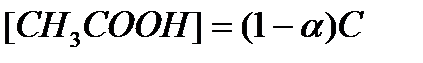
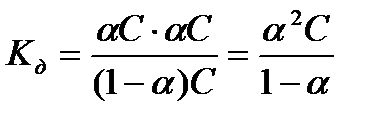
На медном электроде (положительном полюсе элемента — катоде) продолжается восстановление меди Си 2+ + 2е
Таким образом реализуется самопроизвольно протекающий процесс, в котором цинковая пластинка растворяется, на медной выделяется металлическая медь, а во внешней цепи протекает электрический ток. Суммарная окислительно-восстановительная реакция:
Cu 2+ + Zn —> Си + Zn 2+
С другой стороны, если при протекании химической реакции на каждом электроде выделяется или растворяется z моль-эквивалентов вещества (согласно закону Фарадея, во внешней цепи протекает zF Кл электричества), то максимальная работа, которую совершает гальванический элемент по перенесению заряда zF между электродами с разностью потенциалов Е равна zFE.
Электродвижущей силой (ЭДС) элемента Е называется разность потенциалов между полюсами обратимого электрохимического элемента.
Очень часто необходимо рассчитать потенциал в нестандартных условиях в этом случае используют уравнение Нернста, которое описывает зависимость потенциала от концентрации вещества и температуры.
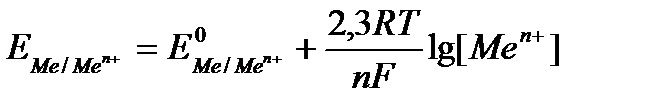
где R – газовая постоянная,
F – число Фарадея (96 500 Кл/моль),
Т- абсолютная температура,
n – число электронов участвующих в процессе.
При температуре 298 К данное уравнение принимает следующий вид:
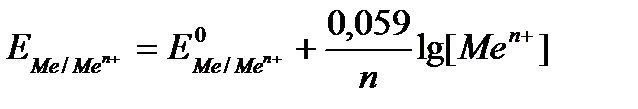
где Е — условный стандартный электродный потенциал по водородной шкале.
Для определения равновесного электродного потенциала по водородной шкале составляют элемент из этого электрода и стандартного водородного электрода. Который представляет собой платиновую нить, погруженную в
электролит, вдоль которой пропускается газообразный водород, H + |H2,Pt) с
активностью водородных ионов в растворе равной единице и давлением водорода равном 1 атм. Его потенциал при любой температуре условно принят равным нулю.
При этом: стандартный водородный электрод располагают слева.
Например, для определения потенциала цинкового электрода составляют электрохимическую цепь
Электродная реакция записывается как реакция восстановления, т.е.
присоединения электронов: в данном примере на водородном (левом)
электроде 2H + +2e
=H2, на цинковом (правом) электроде Zn 2+ +2е
=Zn. Общая реакция записывается как разность между реакциями на правом и левом элементах
Н2 + Zn 2+ = 2Н + + Zn
Стандартный электродный потенциал считается положительным, если электрод заряжен более положительно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента слева направо и ЭДС элемента будет положительной.
Стандартный электродный потенциал считается отрицательным, если электрод заряжен более отрицательно, чем стандартный водородный электрод. В этом случае электрический ток будет течь внутри элемента справа налево и ЭДС элемента будет отрицательной.
В рассматриваемом примере Н2 + Zn 2+ = 2Н + + Zn ток в элементе будет течь от цинкового электрода к водородному (справа налево) и ЭДС элемента так же, как и равный ей потенциал цинка, будет иметь отрицательный знак.
Стандартные электродные потенциалы, определенные по водородной шкале при 25 С (298 К) обычно располагают в ряд. Например
| Электрод | Li + |Li | Zn 2+ |Zn | H + |H2,Pt | Cu 2+ |Cu | F + |F2,Pt |
| Е°, В | -3,04 | -0,763 | 0,00 | +0,337 | +2,87 |
| Стандартный потенциал, расположенный правее в электрохимическом ряду, является более электроположительным по сравнению с потенциалом, расположенным левее. |
| | | следующая лекция ==> | |
| Суставной синдром в практике ВОП. Остеопороз. Нарушение функции суставов | | | Стрелочные переводы |
Дата добавления: 2015-12-08 ; просмотров: 3329 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Закон Фарадея для электролиза
- Что такое электролиз
- Законы Фарадея об электролизе
- Первый закон
- Второй закон
- Объединённый закон
- Практическое применение
- Видео по теме
- Электролиз. Законы Фарадея
- Первый закон
- Закон Фарадея
- Второй закон
- Законы Майкла Фарадея
- Математическая формула
- Значение постоянной F
- Пример решения задачи
- Что мы узнали?
- 43.Электролиз. Законы электролиза
- 🌟 Видео
Видео:Урок 282. Закон Фарадея для электромагнитной индукцииСкачать

Закон Фарадея для электролиза
В результате исследований Майкла Фарадея были открыты основополагающие законы электролиза. Этот процесс активно используется в современной технике и промышленности. Законы электролиза Фарадея позволяют рассчитать условия протекания процесса и его количественные показатели.
Видео:Закон ФарадеяСкачать

Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
- В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
- Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов. При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Видео:Урок 298. Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
Первый закон
Первый закон электролиза Фарадея рассматривает массу вещества, которое задержалось на электродах в результате химической реакции при пропускании электротока за определённое время.
Формулировка первого закона Фарадея имеет следующий вид: если взвесить вещество, образовавшееся на электродах в результате пропускания через раствор электротока, то его вес будет пропорционален заряду, прошедшему через этот раствор.
Формула содержит коэффициент пропорциональности k. Он является постоянным для определённого вещества. Его величина равна весу вновь образованного материала при прохождении заряда в 1 Кулон. Коэффициент носит название электрохимического эквивалента.
Уравнение представлено в двух вариантах — с учётом заряда или силы тока. В последнем случае закон Фарадея для электролиза формулируется следующим образом: количество вещества, выделенного на электродах за определённое время, пропорционально силе электротока, протекающего в жидкости.
Закономерность, которую выражает первый закон Фарадея, можно продемонстрировать с помощью опыта. Для этого нужно через раствор медного купороса пропустить электрический ток. Следует сравнить две ситуации, когда пропускается электроток различной силы. При более слабом количество меди, выделившейся на электроде, будет меньше.
Второй закон
Второй закон Фарадея тесно связан с первым. Он гласит следующее: масса, полученного при помощи электролиза вещества, пропорциональна его химическому эквиваленту.
К такому выводу Фарадей пришел, пропуская один и тот же электрический ток в жидкостях различного состава. Взвешивая каждый раз полученный металл, он увидел, что результат получается различным. Ученый понял, что результат зависит от химического состава вещества. Поэтому в законе используется понятие химического эквивалента. Он выражается отношением молярной массы вещества к валентности.
Фарадей провёл дополнительные эксперименты и выяснил, что получить один моль вещества можно, если на электролитическую реакцию затратить 96485 Кулонов. Это число называют постоянной Фарадея и обозначают буквой F.
Исходя из этого, можно записать выражение для определения электрохимического эквивалента:
Следовательно, зная химическую формулу вещества и массу, которую необходимо получить, можно вычислить, какой заряд необходимо в этом случае потратить.
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.
Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Видео:Закон Фарадея | ЕГЭ Физика | Николай НьютонСкачать

Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.
Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.
Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Видео:Закон Фарадея. Гибкий контурСкачать

Видео по теме
Видео:Закон Фарадея (теория + задача). Электролиз. Часть 4-1.Скачать

Электролиз. Законы Фарадея
Видео:Самый Интересный Закон ЭлектричестваСкачать

Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Рис. 1. Майкл Фарадей.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
Рис. 2. Первый закон Фарадея.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Видео:Закон Фарадея и плотность тока. Олимпиадная задача. Физика+химия.Скачать

Закон Фарадея
Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом Δq = IΔt в формуле (3.5.4):
Тогда формула (3.5.4) примет вид:
Следовательно, масса вещества, выделившегося на каждом из электродов, прямо пропорциональна силе тока и времени прохождения тока через раствор электролита.
Это утверждение, полученное нами теоретически, впервые было установлено в 1836 г. экспериментально М. Фарадеем и носит название закона электролиза Фарадея.
Коэффициент k в формуле (3.5.6) называют электрохимическим эквивалентом вещества и выражают в килограммах на кулон (кг/Кл). Из формулы (3.5.6) видно, что электрохимический эквивалент k численно равен массе вещества, выделившегося на электроде, при переносе ионами через раствор электролита заряда, равного 1 Кл.
Электрохимический эквивалент имеет простой физический смысл. Так как и еn = qi, то, согласно выражению (3.5.5),
т. е. электрохимический эквивалент данного вещества равен отношению массы иона этого вещества к его заряду.
Из формулы (3.5.5) следует также, что электрохимические эквиваленты веществ прямо пропорциональны молярным массам и обратно пропорциональны валентностям этих веществ.
При этом надо иметь в виду, что некоторые химические элементы в разных соединениях могут обладать различной валентностью. Так, например, медь одновалентна в соединениях CuCl, Cu2O и еще в некоторых других соединениях и двухвалентна в CuO, CuSO4 и еще в некоторых соединениях. В первом случае, когда медь одновалентна, ее электрохимический эквивалент равен 6,6 • 1-7 кг/Кл, а для двухвалентной меди электрохимический эквивалент в два раза меньше — он равен 3,3 • 10-7 кг/Кл.
Видео:Введение в закон Фарадея (видео 19)| Магнетизм | ФизикаСкачать

Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Рис. 3. Второй закон Фарадея.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Видео:Химическое действие электрического тока. Закон Фарадея. 8 класс.Скачать

Законы Майкла Фарадея
В результате проведения многих исследований в 1834 году английский физикохимик Майкл Фарадей (в его честь названа единица измерения электрической емкости — фарада) вывел два закона, которые способны количественно описать процесс электролиза. Хотя сам факт разложения соединений под действием проходящего электричества через их растворы был открыт задолго до Фарадея. В 1800 году другой английский ученый Уильям Николсон установил экспериментально этот факт.
Заслуги Фарадея в исследовании электролиза огромны. Он ввел в физикохимию основные термины, которые до сих пор используются для описания этого процесса. Два закона ученого в современной формулировке представляются следующим образом:
- Масса вещества, которая оседает на электроде в процессе электролиза, прямо пропорциональна количеству электричества, проходящему через рассматриваемый электрод. Под количеством электричества понимается заряд, который в системе СИ измеряется в кулонах.
- Для постоянного количества электричества масса химического соединения, которая образуется в ходе электролиза на электроде, является прямо пропорциональной величиной эквиваленту этого вещества. Под эквивалентом полагается отношение молярной массы к количеству молей электронов, участвующих в реакции. Это число совпадает с валентностью элемента, например, для Al3+ оно равно 3, а для H+ составляет 1.
Математическая формула
Оба закона получены Фарадеем экспериментальным путем. Их словесные формулировки можно легко объединить и перевести на математический язык. Общее уравнение, которое удобно использовать при решении любых практических задач, принимает следующую форму:
Здесь m — масса образующегося вещества на электроде, Q — заряд, прошедший через электрод в процессе реакции, F — коэффициент пропорциональности, который называют постоянной Фарадея, M — молярная масса вещества, участвующего в химической реакции, z — его валентность (безразмерное число).
Первый множитель этого уравнения математически отражает сформулированный первый закон Фарадея, соответственно, второй множитель является выражением пропорциональности массы вещества его эквиваленту (M/z).
Эту формулу можно преобразовать, если вспомнить из курса общей физики, что заряд вычисляется по формуле:
Здесь I — электрический ток в амперах, t — время его прохождения через электролит. Подставив это выражение в математический закон Фарадея, и преобразуя его, можно получить следующие формулы:
Буквой n здесь обозначено количество выделившегося вещества на электроде в молях (n = m/M).
Значение постоянной F
Численное значение постоянной Фарадея составляет приблизительно 96500 Кл/моль. Физический смысл этой величины заключается в том, что она говорит, какое количество электричества необходимо пропустить через раствор, чтобы выделилось на электроде 1 моль одновалентного вещества.
Величина F тесно связана с постоянной Авогадро NA и с элементарным зарядом электрона e следующим выражением:
Эта формула в XIX веке была использована учеными для точного определения числа NA. Сам Фарадей определил постоянную, носящую его фамилию, благодаря изучению процесса электролиза серебряного раствора.
В настоящее время проводятся эксперименты с целью точного определения величины F (а значит, NA), чтобы ее использовать для переопределения единицы измерения массы — килограмма.
Пример решения задачи
Рассмотрим электролиз хлорида кальция в водном растворе. Химическая формула соединения CaCl2. В воде оно хорошо растворяется с образованием ионов Ca2+ и Cl-. Пусть через этот раствор пропустили постоянный ток 5 ампер в течение 2 часов. Необходимо определить массы газообразного хлора и твердого кальция, которые выделятся на аноде и катоде, соответственно.
Известные данные задачи позволяют без проведения промежуточных вычислений провести расчет по современной формуле Фарадея:
- Для анода получается: 2*Cl- — 2*e = Cl2. m (Cl2) = (I*t/F)*(M/z) = (5*7200/96500)*(0,0355/1) = 13,2 грамма.
- Для катода получается: Ca2+ + 2*e = Ca. m (Ca) = (I*t/F)*(M/z) = (5*7200/96500)*(0,040/2) = 7,5 грамма.
Для проведения расчетов использовались молярные массы химических элементов Ca и Cl из таблицы Д. И. Менделеева.
Таким образом, законы Майкла Фарадея являются универсальными для их практического применения к любым химическим веществам, которые участвуют в процессах электролиза. Они позволяют количественно выразить результаты реакций на электродах.
Видео:Как решать задачи на закон Фарадея.Скачать

Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Видео:ЭЛЕКТРОЛИЗ катод анод ИОНЫСкачать

43.Электролиз. Законы электролиза
— физико-химический процесс, состоящий в выделении на
электродах
составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав
электролита
.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами
— проводниками, соединёнными с полюсами источника электрической энергии.
Анодом
при электролизе называется положительный электрод,
катодом
— отрицательный[1]. Положительные ионы —
катионы
— (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы —
анионы
— (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1700 дней
], диоксида марганца[2],пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция,электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества
. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
🌟 Видео
Электролиз. Задача на закон Фарадея с площадью поверхности и выходом по току.Скачать

Урок 186 (осн). Электрический ток в жидкостях. Закон Фарадея для электролизаСкачать

Опыт Фарадея — явление электромагнитной индукции | Физика ОГЭСкачать

Задачи на закон Фарадея. Средняя сложность. Электролиз. Часть 4-2.Скачать

Закон электромагнитной индукцииСкачать

ФИЗХА 10-11 класс | Электролиз, закон Фарадея | Олимпиадные задачи по химииСкачать

Закон электролиза ФарадеяСкачать

ЭлектролизСкачать