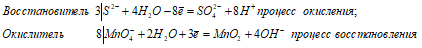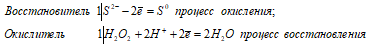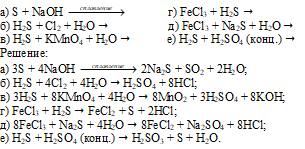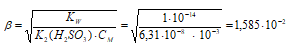Вопрос по химии:
4. Назовите оксиды по их формулам:
А) FeO , б) SO2 , в) BaO , г) NO2 , д) K2O , е) Cu2O .
5. Закончите уравнения химических реакций (сера в уравнении 4) проявляет валентность IV ) , расставьте коэффициенты, назовите продукты:
1) P + O2→ ? 2) AI+ O2→ ? 3) C+ O2→ ? 4) S+ O2→ ? 5) Zn + O2→?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
А) оксид железа 2
б) оксид серы 4
в) оксид бария
г) оксид азота 4
е) оксид меди 1
1) 4P+5O2 = 2P2O5 (оксид фосфора 5 )
2) 4AL+3O2=2AL2O3 (оксид алюминия )
3) C+O2=CO2 (оксид углерода 4 )
4)S+O2=SO2 ( оксид серы 4 )
5)2Zn+O2=2ZnO ( оксид цинка 2 )
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Видео:8 класс. Составление уравнений химических реакций.Скачать

Характеристика окислительно-восстановительных свойств серы на примере сероводорода и оксида серы Ⅳ
Задача 855.
Какие свойства проявляет сероводород при взаимодействии с водными растворами КМnO4, Н2O2, NaОН?
Решение:
а) При взаимодействии с водным раствором перманганата калия сероводород проявляет свойства восстановителя, окисляясь при этом S-2 до S+6:
Уравнения ионно-молекулярного баланса:
3S 2- + 8MnO4 — + 28H2O = 3SO4 2- + 8MnO2 + 24H + + 32OH —
После приведения членов в обеих частях равенства, получим:
3S 2- + 8MnO 4 — + 4H 2 O = 3SO 4 2- + 8MnO 2 +8 OH —
б) При взаимодействии с пероксидом водорода сероводород проявляет свойства восстановителя, окисляясь при этом S -2 до S 0 :
Уравнения ионно-молекулярного баланса:
в) С гидроксидом натрия сероводород проявляет свойства кислоты, вступает в реакцию нейтрализации:
Задача 856.
Закончить уравнения реакций:
Задача 857.
Привести примеры реакций получения SO2, которые: а) сопровождаются изменением степени окисленности серы; б) не сопровождаются изменением степени окисленности серы.
Решение:
а) Примеры реакций получения SO2, сопровождающиеся изменением степени окисления серы:
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от 0 до +4;
Здесь сера выступает в качестве восстановителя, повышая свою степень окисления от -2 до +4.
б) Пример реакции получения SO2, не сопровождающийся изменением степени окисления серы:
Задача 858.
Какова реакция среды в растворах Na2SO3 и NaHSO3? Вычислить рH 0,001 М раствора Na2SO3.
Решение:
1). Na2SO3 — средняя соль, а NaHSO3 – кислая соль сильного основания (гидроксида натрия) и слабой кислоты (угольной кислоты), которые гидролизуются по аниону:
а) Na2SO3 ↔ 2Na + + SO3 2-
I ступень SO3 2- + Н2О ↔ HSO3 — + OH — (ионно-молекулярная форма);
Na 2 SO 3 + Н2О ↔ NaНSO3 + NaOH (молекулярная форма).
II ступень HSO3 — + Н2О ↔ Н2SO3 + OH — (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Преимущественно соль гидролизуется по первой ступени. При гидролизе образуется избыток ионов ОН-, которые придают раствору основную среду, рН > 7.
б) NaHSO3 ↔ Na + + НSO3 —
НSO3 — +Н2О ↔ H2SO3 + OH — (ионно-молекулярная форма);
NaНSO3 + Н2О ↔ Н2SO3 + NaOH (молекулярная форма).
Таким образом, гидролиз Na 2 SO 3 и NaHSO3 протекает по аниону с образованием избытка гидроксид-ионов, что придаёт раствору основную среду.
2). Рассчитаем рН 0,001 М раствора Na 2 SO 3.
Рассчитаем концентрацию ионов ОН-, получим:
[OH — ] = β . CM = (1,585 . 10 -2 ) . 10 -3 = 1,585 . 10 -5 моль/л.
Рассчитаем рОН раствора, получим:
рОН = -lgOH = -lg1,585 . 10-5 = 5 — lg1,585 = 5 – 0,20 = 4,8
🌟 Видео
ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Как уравнивать коэффициенты (химия)Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать