методическая разработка по химии (8 класс)
В данном пособии пошагово рассмотрен алгоритм решения расчетных задач в 8 класс: вычисление массы и объема вещества по химическому уравнению. Предложены варианты проверочной работы.
- Скачать:
- Предварительный просмотр:
- Задачи расчет по химическим уравнениям 8 класс задачи с решениями
- Методическая памятка по химии для учащихся 8 классов по теме «Расчёты по химическому уравнению» Алгоритмы решения задач
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 🌟 Видео
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| reshenie_zadach_po_himicheskim_uravneniyam.docx | 19.04 КБ |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Предварительный просмотр:
Учитель : Батырева Л.В. ( эл. почта lvbatyreva@mail.ru )
Тема урока: Решение задач по химическим уравнениям
Сегодня мы вспомним решение задач по уравнениям. Прочитайте методические указания и попробуйте решить один из предложенных вариантов
Методические указания для учащихся
Пример 1. Найдите массу и объем кислорода (н.у.), который необходим для полного сжигания 4г серы.
Записываем условие задачи:
Решение: Записываем уравнение горения серы
Записываем данные задачи в уравнении:
1 моль 1моль ( число молей равно коэффициенту перед формулой)
Находим количество известного вещества( в данном случае – серы):
Формула: n = m/M, где n- количество вещества, моль
m – масса вещества, г
М – молярная масса вещества, г/моль
М(S) = 32 г/моль (из таблицы)
n(S)= 4: 32 = 0,125 (моль)
Записываем в виде пропорции соотношение реагирующих веществ:
n(S) : n(O 2 ) = 1моль : 1моль
Находим количество искомого вещества –О 2 :
0,125 моль : х = 1моль : 1моль
Находим массу кислорода по формуле: m = n *M M (O 2 ) = 32г/моль
m(O 2 ) = 0,125 * 32 = 4(г)
Объем кислорода (V) найдем по формуле: V = nV m , где V m – молярный объем. Для любых газов( при н.у.) : V m =22,4 л/моль
V(O 2 ) = 0,125 * 22,4 = 2,8(л)
Ответ: V(O 2 ) = 2,8л m(O 2 ) = 4г
Практическая работа «Расчеты по химическим уравнениям»
- Найдите массу кислорода, который выделится при разложении 72 г воды. ( Ответ: 64г)
- Найдите объем водорода, который вступит в реакцию с 7 г азота N 2 , если в результате получается аммиак NH 3 . (Ответ:16,8 л)
- Сколько л аммиака получится в результате этой реакции? ( Данные возьмите из задачи №2)
- Найдите массу магния, который вступит в реакцию с 44, 8 л кислорода, измеренного при н.у.? (Ответ: 96г)
- Найдите объем водорода, который выделится при взаимодействии 13 г цинка с серной кислотой? (Ответ: 4, 48 л)
- Сколько граммов серной кислоты потребуется для растворения всего этого цинка?( см. задачу №2)
- Найдите массу водорода который вступит в реакцию с 16г серы, если получается сероводород H 2 S ? (Ответ: 1 г)
- Какой объем кислорода потребуется для сгорания 448л метана СН 4 , если образуются вода и углекислый газ? ( Ответ: 896л)
- Сколько литров СО 2 образуется в задаче №2?
Желающие могут прислать решение выбранного варианта на оценку на мою электронную почту
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Задачи расчет по химическим уравнениям 8 класс задачи с решениями
Урок посвящен закреплению умений производить расчеты по уравнению реакции с учетом количественных соотношений участников реакции.
I. Алгоритмы решения задач по уравнению химических реакций
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
5. Для вычисления искомого количества вещества,
6. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
Последовательность выполнения действий
Оформление решения задачи
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
5. Вычислим количества вещества, массу которого требуется найти. Для этого составим соотношение.
6. Вычисляем массу вещества, которую требуется найти
7. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ, о которых, идёт речь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции
и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Для вычисления искомого количества вещества, составим соотношение
7. Запишем ответ
- Используя алгоритм, решите самостоятельно задачу:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г (3Fe + 4O2=Fe3O4).
Алгоритм №4
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт реь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Вычислим количества вещества, массу которого необходимо найти
7. Найдем массу вещeства, которую требуется вычислить
8. Запишем ответ
II. Задачи для самостоятельного решения
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Видео:Расчёты по химическим уравнениям. Учимся решать задачиСкачать
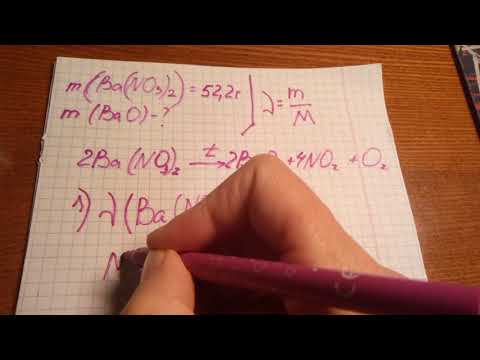
Методическая памятка по химии для учащихся 8 классов по теме «Расчёты по химическому уравнению» Алгоритмы решения задач
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Алгоритмы решения задач .
1. Расчётная задача по уравнению.
1.1. Записать данные задачи и определить искомую величину.
1.3. Составить расчётное уравнение.
1.4. Подчеркнуть одной чертой формулы веществ, о которых идёт речь в условии задачи
(известное и искомое).
1.5. Над этими формулами подписать известные значения с единицами измерения. Неизвестную
величину обозначить «Х» и указать её размерность.
1.6. Под формулами записать значения количества веществ (совпадает с коэффициентом),
молярные массы (по таблице ПСХЭ) или значение молярного объёма (22,4 л/моль).
Рассчитайте массу или объём.
1.7. Составить пропорцию и найти числовое значение неизвестной величины.
1.9. Записать ответ задачи.

m ( P 2 O 5 ) = 14,2 г. 14,2 г. Х г.

Н2О n = 1 моль n = 2 моль
___________________ М = 142 г/ моль М = 98 г/ моль


2. Задача на выход продукта реакции .
1. В алгоритм 1 добавить пункт 1.8. расчёт практической массы продукта реакции по формуле:

Значение m теорет. рассчитывается по расчетному уравнению (см. алгоритм 1).
ή (выход вещества) или рассчитывается как неизвестная величина, или входит в данные задачи.
2. Далее по алгоритму 1 без изменений.
3. Задача на примеси в исходном веществе.
1. В алгоритм 1 добавить пункт 1.2 и рассчитать массу чистого вещества по формуле:
m технич ∙ w примесей
m чист.в-ва = m технич. _ _______________________
Значение m технич. обычно находится в данных задачи, как и значение w примесей.
2. Далее по алгоритму 1 без изменений.
Приложение. Единицы измерения нужных величин.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 860 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 47 человек из 21 региона
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 377 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 845 249 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С., Остроумов И.Г., Сладков С.А.
§ 29. Расчёты по химическим уравнениям
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 29.09.2021
- 99
- 1
- 29.09.2021
- 119
- 0
- 29.09.2021
- 198
- 7
- 29.09.2021
- 241
- 17
- 29.09.2021
- 111
- 3
- 29.09.2021
- 8089
- 346
- 29.09.2021
- 402
- 3
- 29.09.2021
- 309
- 1
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 29.09.2021 669
- DOCX 39.5 кбайт
- 21 скачивание
- Оцените материал:
Настоящий материал опубликован пользователем Машковцева Ольга Николаевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 1 год
- Подписчики: 0
- Всего просмотров: 973
- Всего материалов: 3
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Вузы РФ не будут повышать стоимость обучения на первом курсе
Время чтения: 1 минута
В Госдуме предложили унифицировать школьные программы
Время чтения: 1 минута
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Онлайн-семинар о здоровом образе жизни и организации секций
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
🌟 Видео
Расчеты по уравнениям химических реакций. 2 часть. 8 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Задачи по химическим уравнениям. Урок 15. Химия 8 классСкачать

Химия. 8 класс. Решение задач по уравнениям химических реакций /25.11.2020/Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Расчеты по химическим уравнениям. Учимся решать задачи. Химия 8 классСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Задачи по уравнениям реакций - 8 классСкачать

Химия 8 класс: Расчеты по химическим уравнениямСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Габриелян О. С. 8 класс §29 "Расчёты по химическим уравнениям"Скачать

8 класс. Вычисления по уравнениям химических реакций. Часть 1.Скачать







