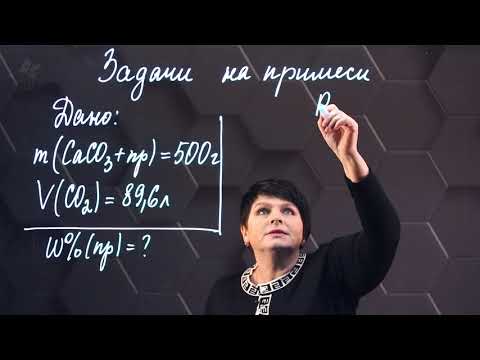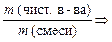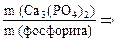Задачи на примеси — это разновидность задач на материальный баланс (массовую долю). Большинство минералов природного происхождения состоит из смеси разных веществ. Чистые вещества в природе встречаются крайне редко. Образцы породы, минералы и т.д. зачастую содержат основное вещество и примеси.
Примеси — это дополнительные вещества, которые содержатся в минерале, помимо основного вещества, и доля которых относительно невелика.
Как правило, в химических задачах не уточняют состав примесей. Такие примеси считаются химически инертными и не вступают в химические реакции. Если указан состав примесей, необходимо проверять, не вступают ли они в химические реакции.
Для решения задач на примеси можем использовать формулу массовой доли примеси:
mприм. — масса примеси, г
m — масса образца, г
Например , в образце технического карбоната кальция массой 200 г содержится 5% примесей. Тогда масса примесей:
1. Какой объем воздуха (н. у.) необходим для сгорания 10 г серы, содержащей 2% негорючих примесей?
2. Какой объем углекислого газа (н.у.) выделится при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты?
3. Из 12 кг цинковой обманки, содержащей 75% cульфида цинка и несульфидные примеси, при действии избытка соляной кислоты, теоретически можно получить _____ л сероводорода.
4. Сколько килограммов фосфора может быть получено из 1 тонны фосфорита Ca3(PO4)2, содержащего 40% нефосфатных примесей?
5.Сколько грамм оксида алюминия, содержащего 8% примесей, потребуется для получения 500 г нитрата алюминия в реакции с азотной кислотой.
6.Сколько кг 96%-ного раствора серной кислоты получится из 10 кг пирита, содержащего 5% примесей?
7.Технический образец сульфида железа (II) массой 25г содержащий 2,5% примесей, обработали избытком разбавленного раствора серной кислоты. Выделившийся газ пропустили через избыток раствора нитрата свинца (II). Вычислите массу выделившегося осадка
8.Определить массовую долю примесей в образце известняка, если при действии на 1 кг его избытком азотной кислоты выделяется 200 л (н.у.) углекислого газа.
9. Технический цинк массой 150 г обработали избытком соляной кислоты. При этом выделилось 44,8 л газа (н.у.). Определить массовую долю примесей в образце цинка.
10. Чему равна масса пирита, содержащего 10% примесей, если при обжиге этой порции пирита получили 44,8 л сернистого газа?
11. Образец хлорида бария, загрязненный хлоридом натрия обработали в водном растворе избытком сульфита натрия. Выпавший осадок отфильтровали и затем обработали избытком бромоводородной кислоты. Объем выделившегося газа оказался равным 4,09 л (н.у.). Вычислите массовую долю основного вещества в образце, которого взяли 40 г.
12. При обработке избытком хлороводородной кислоты 25 г цинковой руды, содержащей ZnS и нерастворимые в кислотах примеси, выделяется газ. При полном поглощении этого газа раствором сульфата меди (II) образуется осадок, при прокаливании которого в избытке кислорода получается 8 г оксида меди (II). Определите, содержали примесей в руде в массовых процентах.
13. Образец карбоната кальция массой 20,0 г, загрязненный сульфатными примесями, обработали избытком азотной кислоты. Объем образовавшегося газа, измеренный при 25°С и нормальном давлении, составил 4,66 л. Вычислить массовую долю примесей в исходном образце.
14. При дегидроциклизации технического гептана массой 147,4 г получен толуол массой 128,8 г. Найдите массовую долю примесей в техническом гептане.
15. При действии избытка раствора соляной кислоты на 48 г технического карбида кальция образовалось 13,44 л ацетилена (н.у.). Найдите массовую долю примесей в техническом карбиде кальция.
16. Найдите массовую долю примесей в техническом карбиде кальция, если при пропускании газа, полученного действием воды на 1,6 г карбида, через бромную воду в реакцию вступило 7,2 г брома.
17. Какая масса образца иодида калия, загрязненного примесью нитрата калия (массовая доля его равна 3%) была обработана избытком нитрата серебра, если при этом образовалось 47 г осадка?
18. Фосфор, полученный восстановлением 77,5 т руды, содержащей по массе 80% фосфата кальция и 20 % невосстанавливающихся примесей, использовали для получения ортофосфорной кислоты. Определите массу полученной кислоты, если выход на всех стадиях процесса считать равным 100 %.
19. Образец сульфида алюминия, загрязненный сульфидом цинка (массовая доля 0,02), обработали избытком воды. Образовавшийся газ полностью прореагировал с хлоридом меди (II) в водном растворе, при этом выпало 5,28 г осадка. Чему была равна масса взятого образца сульфида алюминия?
20. Какой объем ацетилена (н. у.) образуется, если 10 г карбида кальция, содержащего 4% примесей, обработать избытком воды?
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

«Методика решения химических задач по уравнениям реакций по известным параметрам исходного вещества без примесей и с примесями. в формате ОГЭ и ЕГЭ»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
СЛУШАТЕЛЯ ПРОГРАММЫ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ «МЕТОДИЧЕСКИЕ ПОДХОДЫ К РЕШЕНИЮ РАСЧЁТНЫХ И ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ДЛЯ ПОДГОТОВКИ К ОГЭ И ЕГЭ ПО ХИМИИ»
По теме « Методика решения химических задач по уравнениям реакций по известным параметрам исходного вещества без примесей и с примесями.
в формате ОГЭ и ЕГЭ »
Учителя МБОУ Нахабинская СОШ № 3
Г.о. Красногорск п. Нахабино
Новиковой Татьяны Юрьевны
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
расширять кругозор учащихся;
развивать умение логически мыслить;
воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе в форме ОГЭ и ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Использование задач в школе позволяет решать основные функции обучения и воспитания.
Обучающие функции обеспечиваются формированием важных структурных элементов знаний, осмыслением химической сущности явлению, умением применять усвоенные знания в конкретно заданной ситуации. Решение задач – это активный познавательный процесс.
Воспитывающие функции реализуются формированием мировоззрения, расширением кругозора. Учебные задачи являются действенным средством воспитания трудолюбия, настойчивости, воли, характера.
Развивающиеся функции проявляются в результате формирования логического, творческого мышления, развитие смекалки учащихся. Решение задач – это мыслительный процесс.
Традиционная методика обучения решения химических задач (чаще всего – это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) — количество вещества — позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин .
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
При решении задач необходимо руководствоваться несколькими простыми правилами:
Порядок решения задачи :
Прочитайте задачу, запишите краткое условие.
Составьте уравнение химической реакции.
Рассчитайте массу чистого вещества, необходимого для реакции по уравнению реакции .
Вычислите массу примесей в образце по условию.
Вычислите массовую долю примесей по формуле: ω прим. = m прим. / m смеси .
Определите массовую долю примесей в техническом образце карбида кальция, если из 200 г его получили 56 л ацетилена.
Записываем уравнение химической реакции:
Определяем количество вещества ацетилена:
n = V / Vm n = 56/22,4 =2,5 моль,
следовательно, по уравнении химической реакции чистого CaC 2 вступило в реакцию 2,5 моль
m примесей = 200-160=40 г
3) определяем массовую долю примесей:
ω прим = 40 г/ 200 г = 0,2 (или 20%).
Решение расчетных задач «на примеси» и определение массовой доли вещества в растворе после реакции.
При решении задач такого типа считается, что примеси – это вещества, не способные вступать в реакцию по составленному для решения уравнению.
Пример 1 . 10 г железа, содержащего 16 % примесей, растворили в 150 мл 10 % раствора соляной кислоты (плотностью 1,05 г/мл). Вычислите объем выделяющегося газа (н. у.) и массовую долю хлороводорода в полученном растворе.
Составляем уравнение реакции по условию задачи, расставляем коэффициенты.
16% от 10 г – примеси, которые не реагируют по составленному уравнению. Находим массу чистого вещества железа. m(Fe) = 10 . (1 – 0,16) = 8,4
Находим количество вещества железа по формуле n = m/M,
(n(Fe) = 8,4/56 = 0,15 моль
Учитываем, что коэффициенты в любом химическом уравнении указывают на соотношение количеств веществ участников реакции. Следовательно, количество вещества израсходованной HCl будет в два раза больше, чем количество вещества железа (коэффициенты 2 и 1, соответственно), а количество вещества водорода будет равно количеству вещества железа (коэффициенты 1 и 1, соответственно).
Находим массу израсходованного хлороводорода m(HCl) = 0,3 . 36,5 = 10,95 г
Объем образующегося водорода (н. у.) рассчитываем по формуле V = n . 22,4, что составит V(HCl) = 0,15 . 22,4 = 3,36 л.
По условию задачи требуется найти массовую долю хлороводорода в растворе после прохождения реакции (соляная кислота – это раствор хлороводорода в воде). Массовую долю находим по формуле w = m части/mцелого.
В данном случае часть – это масса оставшегося после прохождения реакции хлороводорода, целое — масса раствора после реакции.
Очень важно понимать, что в состав раствора входит растворитель (вода в данном случае) и вещества, растворенные в этом растворителе. Образующийся нерастворимый в воде газ и осадки не входят в состав раствора.
Находим массу исходного раствора соляной кислоты по формуле:
mраствора = Vраствора . p(плотность раствора)
После чего массу вещества хлороводорода в растворе рассчитываем по формуле
m = mраствора × массовую долю вещества (выраженную десятичным числом).
Соединяем две последние формулы и получаем m(HCl) = 150 × 1,05 ×0.1 = 15,75 г.
Из этой массы израсходовано на растворение железа 10,95 г хлороводорода, следовательно осталось 15,75 – 10,95 = 4,8 г.
Находим массу раствора после реакции. Для этого надо сложить массу исходных железа (оно растворилось в кислоте полностью) и раствора соляной кислоты, затем вычесть из полученной суммы массу улетевшего из раствора водорода
m(раствора после реакции) = 8,4 + 150 . 1,05 – 0,15 . 2 = 166,2 г
Определяем массовую долю хлороводорода в растворе после прохождения реакции
w = 4,8/166,2 = 0,0289 или 2,89 %.
Пример 2 . 11,2 г мрамора растворили в избытке соляной кислоты и получили 2, 24 л газа (н.у.). Рассчитайте массовую долю примесей в израсходованном образце мрамора.
Мрамор – это минерал, основу которого составляет карбонат кальция. Составляем уравнение реакции, расставляем коэффициенты
Рассчитываем количество вещества газа (газ — это углекислый газ)
n (CO2) = 2,24/22,4 = 0,1 моль
Исходя из соотношения количеств веществ в уравнении (1 к 1 при формуле карбоната кальция и углекислого газа), количество вещества карбоната кальция такое же, 0,1 моль. 2. Находим массу чистого карбоната кальция в образце мрамора.
m (CaCO3) = 0,1 . 100 = 10 г
Следовательно, масса примесей составит 11,2 – 10 = 1,2 г
Массовая доля примесей w (примесей) = 1,2/11,2 = 0,1071 или 10,71%.
Пример 3 . Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде.
Дано: m = 20 г; m(C2H2Br4)=86,5 г.
Решение: записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
Находим количество вещества тетрабромэтана.
n (C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что n (C2H2Br4) = n (C2H2) = n (СаC2) =0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) = n (СаC2) • М(СаC2) = 0,25• 64 = 16 г.
Определяем массовую долю СаC 2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Пример 4 . В бензоле объемом 170 мл растворили серу массой 1,8 г. Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать массу раствора. Определяем массу бензола.
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
Задачи для самостоятельного решения 9 класс
1.Какая масса азотной кислоты образуется при взаимодействии серной кислоты с 200г нитрата натрия, содержащего 10% примесей?
2.Какой объем газа выделится при разложении 300г нитрата лития, содержащего 20% примесей?
3. Какая масса азотной кислоты образуется при взаимодействии 196г серной кислоты и 100г нитрата калия, сод.20% примесей?
4.При разложении 250г нитрата натрия выделился газ объемом 22,4л. Найдите долю чистого вещества нитрата натрия в исходном образце?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Дидактический материал: «Решение расчетных задач на примеси»
Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего определенную массовую долю примесей (в %)
При решении задач этого типа необходимо вначале рассчитать массу или объем чистого вещества, которое содержится в исходной смеси, а потом решать как обычную задачу по химическому уравнению. Массу чистого вещества (как и объем) можно вычислить двумя способами.
С п о с о б 1. Массу чистого вещества (или объем) определяют по формуле:
w (чист. в-ва) = 100 % – w (примеси),
w (чист. в-ва) =
m (чист. в-ва) = m (смеси) · w (чист. в-ва)
Способ 2. Вначале определяют массу примеси:
m (примеси) = m (смеси) · w (примеси), а затем вычитают ее из массы смеси: m (чист. в-ва) = m (смеси) – m (примеси).
П р и м е р 1. На завод было доставлено 50 т фосфорита, содержащего 35 % пустой породы. Определите массу фосфата кальция в природном фосфорите.
С п о с о б 1. Массовая доля фосфата кальция в руде составляет:
Способ 2. m (примеси) = 50 т · 0,35 = 17,5 т, тогда
П р и м е р 2. Определите, какой объем ацетилена можно получить из карбида кальция массой 10 кг, массовая доля примесей в котором 15 %.
1. Определяем массу примесей:
m (примеси) = 10 · 0,15 = 1,5 (кг)
2. Масса чистого карбида кальция равна
m (CaC2) = 10 – 1,5 = 8,5 (кг).
3. Составляем уравнение реакции:
0,133 моль х моль
4. Рассчитываем ν ( CaC2):
ν ( CaC2) = 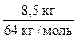
5. По уравнению реакции определяем ν ( C2Н2):
6. Определяем объем ацетилена:
П р и м е р 3. Вычислите, какая масса фосфорита с массовой долей примесей 12 % необходима для получения фосфора массой 200 кг.
х моль 6,452 моль
Ca3(PO4)2 + 3SiO2 + 5C 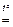
1. Определяем ν ( P ) : ν ( P) = 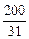
2. По уравнению реакции определяем ν ( Ca3(PO4)2) чистого:
ν ( Ca3(PO4)2 ) : ν ( P) = 1 : 2 Þ ν ( Ca3(PO4)2) = 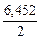
3. Находим массу чистого фосфата кальция, необходимую для получения фосфора массой 200 кг:
4. Находим массовую долю чистого фосфата кальция:
w (Ca3(PO4)2) = 100 % – w (примесей) = 100 % – 12 % = 88 %.
5. Определяем массу фосфорита, необходимую для получения фосфора массой 200 кг:
w (Ca3(PO4)2) =
Þ m (фосфорита) = 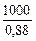
П р и м е р 4. При взаимодействии кальцинированной соды массой 10,8 г с избытком соляной кислоты получили оксид углерода (IV) объемом 2,24 л (н. у.). Вычислите массовую долю (%) примесей в кальцинированной соде.
1. Находим количество вещества СО2:
ν ( СО2) = 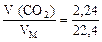
2. Вычисляем массу Na2CO3 в кальцинированной соде.
Из уравнения реакции следует:
3. Находим массу примесей в кальцинированной соде:
m (прим.) = m (кальц. сода) – m (Na2CO3) = 10,8 – 10,6 = 0,2 (г)
4. Вычисляем массовую долю примесей:
w примесей = 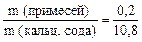
1. Определите массу NaOH, которую можно получить при взаимодействии соды с известковым молоком, полученным из 5 кг известняка, содержащего 80 % CaCO3. (3,2 кг.)
2. Вычислите объем (в м 3 ) оксида углерода (IV) и массу жженой извести (CaO), которые можно получить при обжиге 500 кг известняка, содержащего 92 % карбоната кальция. (257,6 кг CaO и 103 м 3 СО2.)
3. Какая масса раствора с массовой долей серной кислоты 70 % потребуется для получения фосфорной кислоты из фосфорита массой 200 кг, содержащего 70 % Ca3(PO4)2? (189,7 кг.)
4. При взаимодействии 5,0 г технического магния с избытком соляной кислоты выделилось 3,36 л водорода (н. у.). Вычислите массовую долю (в %) чистого магния в техническом магнии. (72,0 %.)
5. Оксид углерода (IV), полученный при сжигании угля массой 50 г, пропустили через раствор гидроксида бария. Какая масса осадка образовалась, если массовая доля углерода в угле составляет 96 %? (788 г.)
6. Песок массой 2 кг сплавили с избытком гидроксида калия, получив в результате реакции силикат калия массой 3,82 кг. Определите выход продукта реакции, если массовая доля оксида кремния (IV) в песке равна 90 %. (82,7 %.)
7. При сгорании технической серы массой 10 г выделился газ, который пропустили через избыток раствора гидроксида натрия. В реакцию вступил гидроксид натрия массой 24 г. Определите массовую долю серы в техническом продукте. (96 %.)
8. Вычислите массу раствора кислоты с массовой долей HCℓ 30 %, затраченную на растворение цинка массой 200 г с массовой долей примесей 35 %. (487 г.)
9. Для обжига сульфида цинка массой 2 т с массовой долей негорючих веществ 3 % израсходовали 6000 м 3 воздуха. Определите объемные доли газов в образовавшейся газовой смеси. (83,1 % N2; 7,76 % SO2; 9,14 % О2.)
10. Вычислите, какая масса магнетита Fe3O4, содержащего 10 % примесей, необходима для получения железа массой 4 т. (6,134 т.)
11. При действии на мрамор массой 10,5 г соляной кислотой выделился оксид углерода (IV) объемом 2,24 л (н. у.). Определите массовую долю (%) карбоната кальция в мраморе. (95,24 %.)
12. При прокаливании на воздухе пирита массой 5 кг получен оксид серы (IV) массой 5,12 кг. Определите массовую долю FeS2 в пирите. (96 %.)
13. Вычислите число атомов углерода и кислорода в карбонате кальция массой 11 кг, в котором находится 9,1 % примесей, не содержащих углерод и кислород. (6 · 10 22 атомов углерода; 1,8 · 10 23 атомов кислорода.)
14. Вычислите число атомов цинка и хлора в хлориде цинка массой 42,5 г, в котором находится 20 % примесей, не содержащих цинк и хлор. (1,5 · 10 23 атомов цинка; 3 · 10 23 атомов хлора.)
15. Массовая доля ZnS в цинковой обманке составляет 97 %. Определите, какой объем сероводорода образуется из 500 кг цинковой обманки. (112 м 3 .)
16. Какое количество бензола можно получить из ацетилена, выделившегося при обработке водой карбида кальция массой 42,8 г с массовой долей примесей 18,4 %? Массовая доля выхода бензола составляет 30 %. (0,054 моль.)
17. Из карбида кальция массой 7,5 г с массовой долей примесей 4 % получили ацетилен, который был превращен в альдегид по реакции Кучерова. Какая масса серебра выделится при взаимодействии всего полученного альдегида с аммиачным раствором оксида серебра? (24,3 г.)
18. Природный газ объемом 235,8 л (н. у.) использовали для получения ацетилена. Объемная доля метана в газе составляет 95 %. Определите объем образовавшегося ацетилена (н. у.), если его выход составил 60 %. (67,2 л.)
19. Вычислите массу раствора с массовой долей гидроксида натрия 10 %, необходимую для полной нейтрализации продукта сгорания природного газа объемом 23,33 л (н. у.). Объемная доля метана составляет 96 %. (800 г.)
20. Какой объем природного газа (н. у.) потребуется для получения муравьиной кислоты массой 69 г путем каталитического окисления метана? Объемная доля метана в природном газе составляет 98 %. (34,28 л.)
21. Образец технического карбида алюминия массой 16 г обработали избытком воды. Определите объем газа (н. у.), который получили, если массовая доля примесей в карбиде составляет 10 %, а выход продукта реакции равен 75 %. (5,04 л.)
💥 Видео
Задачи на примеси. 1 часть. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Новые 28 задачи на примесь ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

9 класс. Решение задач «Вычисление массы, если известна масса другого вещества, содержащего примеси»Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Вычисление массы продукта реакции по изв-ной массе исходного вещ-ва, сод-го примеси. 10 класс. 1ч.Скачать

Расчёты по уравнению реакции, если вещество содержит примеси.Скачать

Новые задачи №28 на выход реакции. ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

9 класс. Решение задач (с использованием примесей)Скачать

Химия. 9 класс. Вычисление массы вещества по уравнению реакции, если известна масса другого веществаСкачать

Задачи на примеси. 2 часть. 9 класс.Скачать