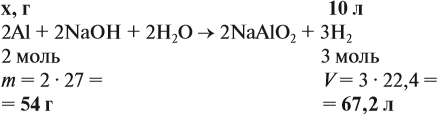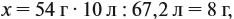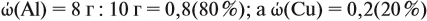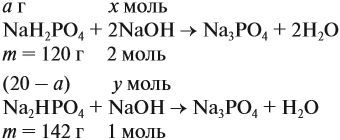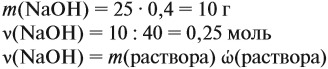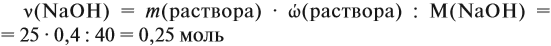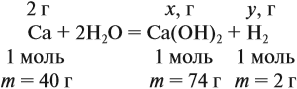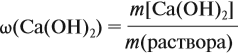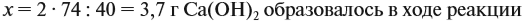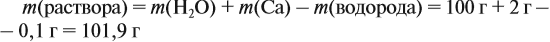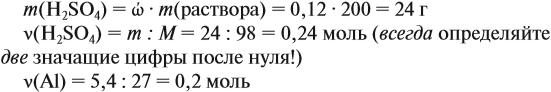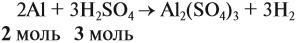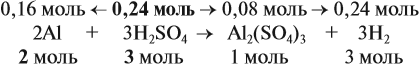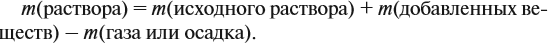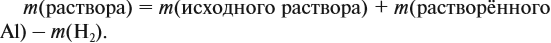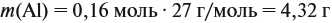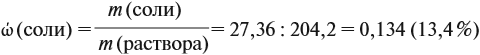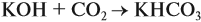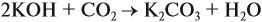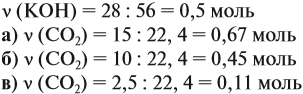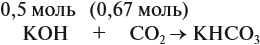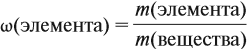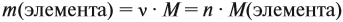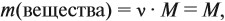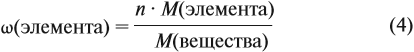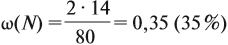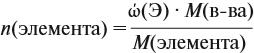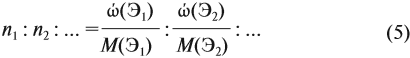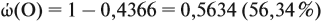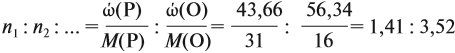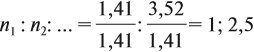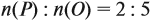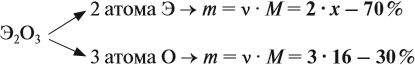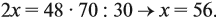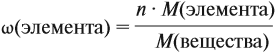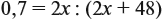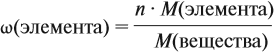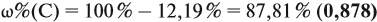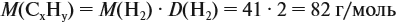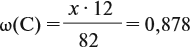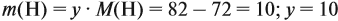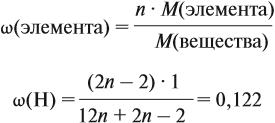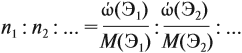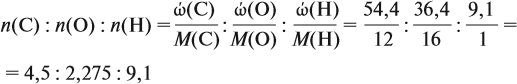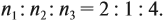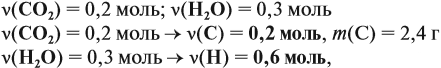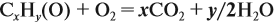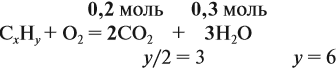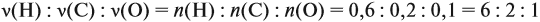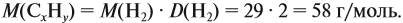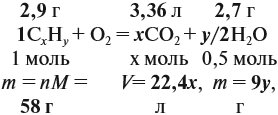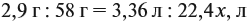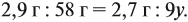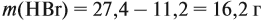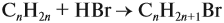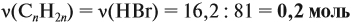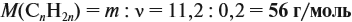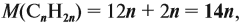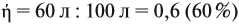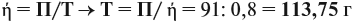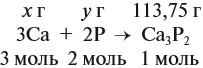Для того чтобы решить любую задачу из этого раздела, необходимо знать
- теоретические основы задачи;
- общие принципы оформления расчёта по уравнению химической реакции.
Поскольку теоретические основы изложены в различных разделах Самоучителя и других учебниках, нужно перед решением задачи повторить нужный раздел.
Рассмотрим общие принципы оформления расчётов по уравнениям реакций.
- Оформление расчётов по уравнениям реакций
- Задачи для самостоятельного решения
- Задачи по теме «Количественный состав смесей»
- Задачи для самостоятельного решения
- Задачи на «избыток–недостаток»
- Задачи на установление формулы вещества
- Задачи для самостоятельного решения
- Задачи, в которых учитывается «выход» полученного вещества
- Задачи для самостоятельного решения
- Задачи по химии на тему «Расчеты по химическим уравнениям»(8 класс)
- Задачи на расчет по уравнениям химических реакций
- Краткое описание документа:
- Задачи на расчет по уравнениям химических реакций
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Задачи по химии 8 класс с решениями с уравнениями химических реакций
- 🎦 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
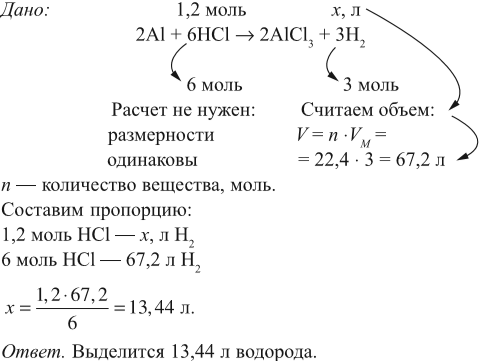
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.
В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Задачи по теме «Количественный состав смесей»
Состав смесей очень часто определяют в различных задачах, например в которых упоминаются растворы. Дело в том, что растворы — это однородные смеси. Задачи такого типа решаются по разному, но в любом случае следует помнить, что массу (объём) смеси нельзя подставлять в уравнение реакции и нельзя находить по уравнению реакции. По уравнению реакции можно найти только массу или объём компонента смеси.
Внимание! Если в условии упоминается смесь веществ или раствор, то составлять уравнения реакций нужно для всех компонентов смеси, указывая, идёт реакция или нет, а затем выполнять расчёт, оформляя решение задачи по каждому уравнению так, как показано выше.
Задачи такого типа можно условно разделить на две группы:
- задачи, в которых имеется хотя бы одна величина, которую можно сразу подставить в уравнение реакции и сделать необходимый расчёт;
- задачи, в которых таких данных нет.
Рассмотрим задачу первого типа.
Задача 20. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:
Составим пропорцию и определим массу алюминия в смеси:
Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
В задачах второго типа в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции. В этих случаях нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в задачи), принимается за известную, и обозначается А.
Задача 21. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
Составим уравнения реакций:
Определим количество вещества NaOH, которое содержится в растворе (можно считать, используя значение массы этого вещества, но более простые числа получаются, если используется величина «моль»):
Внимание: количество вещества щёлочи можно рассчитать сразу:
Теперь используем приём, который был отработан в задаче 16: пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:
Поскольку х + у = 0,25 моль, получаем уравнение
Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
При получении растворов происходят не только физические процессы (дробление вещества, диффузия), но и взаимодействие вещества и растворителя. (Подробнее см. урок 6) Иногда в результате такого взаимодействия образуются совершенно новые вещества. В этом случае необходимо составить уравнение или схему происходящего процесса, а в расчётной формуле указывать, о каком веществе идёт речь.
Задача 22. В 100 мл воды растворили 2 г кальция. Определить массовую долю вещества в полученном растворе.
Решение. Поскольку кальций реагирует с водой, составим уравнение соответствующей реакции:
Таким образом, в растворе содержится не кальций, а гидроксид кальция. Отразим это в расчётной формуле:
Значит, нам нужно вычислить m[Са(ОН)2] по уравнению реакции:
а затем массу раствора:
Обратите внимание: массу полученного раствора вычисляют, исходя из массы исходных веществ или смесей, добавляя к ним массы тех веществ, которые были добавлены, и, вычитая массы веществ, которые вышли из сферы реакции в виде газа или осадка.
Ответ. Массовая доля щёлочи составит 3,6 %.
Задачи для самостоятельного решения
43. Через известковую воду пропустили 3 л воздуха. Выпало 0,1 г осадка. Определить объёмную долю (φ) углекислоты (CO2) в воздухе.
44. 20 г мела опустили в соляную кислоту. При этом выделилось 4 л газа. Определить массовую долю (ώ) карбоната кальция в образце этого мела.
45. В 200 г воды растворили 15 г оксида лития. Найти массовую долю веществ в полученном растворе.
46. 20 г смеси хлорида натрия и карбоната натрия обработали соляной кислотой. При этом выделилось 2,24 л газа. Установить состав смеси в масс.%.
47. Для превращения 2,92 г смеси гидроксида и карбоната натрия потребовалось 1,344 л хлороводорода. Вычислить состав смеси.
48. При растворении 3 г сплава меди и серебра в разбавленной азотной кислоте получено 7,34 г смеси нитратов. Определить процентный состав смеси и объём газов, полученных при прокаливании образовавшихся солей.
49. Сколько граммов 30 %-ной азотной кислоты нужно взять для нитрования 5,6 л пропана?
50. Какой, объём кислорода потребуется для сжигания смеси, состоящей из 8 г метана и 11,2 л этана?
51. Какой объём метана можно получить при нагревании 20 г смеси, содержащей 25 % ацетата натрия, остальное — щёлочь?
52. Через бромную воду пропустили смесь, которая состоит из 8 г метана и 5,6 л этена. Сколько граммов брома вступит в реакцию?
53. Какой объём природного газа, который содержит 98 % метана, потребуется для получения 52 кг ацетилена?
54. Из 10 г загрязнённого карбида кальция получили 2,24 л ацетилена. Чему равна массовая доля карбида кальция в исходном образце?
55. Какой объём кислорода нужен для сжигания смеси, которая состоит из 4 г метана, 10 л этена и 1 моль этина?
56. Сколько граммов 40 %-ной азотной кислоты нужно взять для получения 24,2 г нитробензола?
57. Сколько граммов азотной кислоты потребуется для нитрования 4,7 г фенола, если ώ(кислоты) в исходном растворе равна 30 %.
58. Сколько граммов 30 %-ной муравьиной кислоты нужно для растворения 2,7 г алюминия?
59. Сколько граммов 40 %-ного раствора КОН требуется для омыления (гидролиза) 3 моль тристеарина?
60. Рассчитать объём газа, который должен выделиться при брожении 160 г 20 %-ного раствора глюкозы (брожение прошло полностью).
61. На реакцию с 50 мл раствора анилина пошло 4,2 г брома. Рассчитать массовую долю анилина в исходном растворе (плотность раствора равна единице).
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Задачи на «избыток–недостаток»
Такие задачи имеют в условии легко узнаваемый признак: указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ.
Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) ведутся последующие расчёты.
Задача 23. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
Составим уравнение реакции:
Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:
Теперь можно ответить на все вопросы задачи. Объём водорода рассчитать несложно, поскольку мы уже определили количество (моль) этого вещества.
Задание. Рассчитайте объём водорода.
Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по количеству вещества её.
Массу раствора всегда следует рассчитывать по формуле:
В данном случае:
Обратите внимание: следует добавить не ту массу алюминия, которую, добавили в раствор, а только ту, которая вступила в реакцию:
Задание. Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитаем массовую долю соли в полученном растворе:
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Анализ на «избыток — недостаток» позволяет установить и качественный и количественный состав реакционной смеси. Особенно важен этот анализ в случае, когда могут получаться кислые или основные соли.
Задача 24. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При решении подобных задач следует учитывать, что при взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. В данном случае, если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
А если щёлочь в избытке (2 : 1 и более), то получается средняя соль:
Поэтому в начале нужно рассчитать количество вещества обоих компонентов:
В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) Задачи для самостоятельного решения
62. Через 200 мл 13 %-ного раствора гидроксида бария (пл. = 1,1 г/мл) пропустили 2 л хлороводорода. Определить цвет индикатора в полученном растворе и массу полученной соли.
63. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59 %-ной ортофосфорной кислоты. Определить состав и массовую долю соли в полученном растворе.
64. 8,4 г карбоната магния растворили в 250 мл 15 %-ного раствора серной кислоты (пл. = 1,08 г/мл). Определить массовую долю соли в полученном растворе.
65. 8,4 г цинка растворили в 70 г 120 %-ной соляной кислоты. Определить массовую долю соли в полученном растворе.
66. 25 л СО2 пропустили через 500 г 7,5 %-ного раствора едкого натра. Рассчитать массовые доли солей в полученном растворе.
67. Рассчитать массовую долю кислоты в растворе, полученном смешением 200 мл 15 %-ного раствора серной кислоты (пл. = 1,2 г/мл) с 150 мл 10 %-ного раствора нитрата бария (пл. = 1,04 г/мл).
68. Какой объём газа выделится, если 3,2 г меди растворить в 50 г 30 %-ной азотной кислоты? Чему равны массовые доли растворённых веществ в полученном растворе?
69. Твёрдое вещество, полученное при прокаливании карбоната кальция, растворили в воде. Через полученный раствор пропустили сернистый газ, в результате чего образовалась кислая соль массой 101 г. Определить массу карбоната и объёмы газов.
70. Смешали 200 г 12 %-ного раствора дигидрофосфата натрия и 150 г 5 %-ного раствора гидроксида натрия. Какие вещества содержатся в полученном растворе? Определить их массовые доли и реакцию среды раствора.
71. Через 100 мл 1,48 %-ного раствора сульфата меди (пл. = 1,08 г/мл) пропустили 300 мл сероводорода. Рассчитать массу осадка и массовую долю кислоты в полученном растворе.
72. Смешали 12 л бутена и 12 л кислорода. Смесь подожгли. Какой из этих газов и в каком объёме останется в смеси после реакции? Какой объём газа и жидкой воды образуется при этом?
73. Вычислить массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия.
74. Сколько граммов карбида кальция, который содержит 16 % примесей, нужно для получения 30 г уксусной кислоты?
Видео:8 класс. Составление уравнений химических реакций.Скачать

Задачи на установление формулы вещества
Молекулярная формула вещества отражает его количественный состав. Количественный состав вещества, как и количественный состав раствора, выражают при помощи массовых долей элементов в нём:
Поскольку масса вещества в условии задачи, как правило, не указывается, применяем уже опробованный способ:
Пусть количество вещества равно 1 моль, тогда:
где n — число атомов этого элемента в веществе;
так как количество вещества равно 1 моль.
Задача 26. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
Зная массовые доли химических элементов в веществе (элементный состав), можно определять молекулярную формулу неизвестного вещества.
Задача 27. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы (4) следует, что:
Поэтому отношение числа атомов n элементов данном в веществе равно:
Согласно этой формуле, нам нужно найти ώ(О) в этом оксиде:
Подставим все данные в формулу (5):
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число:
Поскольку число атомов не может быть дробным, обе величины умножим на 2:
Ответ. Искомая формула — Р2О5.
Если в задаче не указано, какой элемент входит в состав оксида, но указана его валентность, задача упрощается.
Задача 28. Массовая доля трёхвалентного элемента в оксиде равна 70 %. Установить формулу этого оксида.
Решение. Формула оксида Э2О3:
Из выделенной жирным шрифтом пропорции получаем:
Ответ. Формула оксида Fe2O3.
Эту задачу можно решить и по формуле:
Подставив данные задачи, получаем:
если М(элемента) = х, то М(вещества) равна 2х + 48.
Решите теперь полученное уравнение:
Ответ. х = 56, значит, формула оксида Fe2O3.
Задача 29. Установить формулу углеводорода, если он содержит 12,19 % водорода. Плотность по водороду равна 41.
Решение. Сначала составим общую формулу углеводорода СхHу и рассчитаем массовую долю Н в нём:
где n — число атомов.
По данным задачи рассчитаем массовую долю углерода:
и молярную массу вещества:
Подставив эти данные в формулу, получаем:
Решив полученное уравнение, получаем n = 6 (атомов углерода).
Найдём массу атомов водорода:
Поэтому формула углеводорода С6H10. Если известен гомологический ряд вещества (общая формула этого ряда), то задача упрощается.
Задача 30. Установить формулу алкина, если он содержит 12,19 % водорода.
Решение. Сначала составим общую формулу алкина СnH2n–2 и рассчитаем массовую долю Н в нём:
Решив полученное уравнение, получаем n = 6 (атомов углерода). Поэтому формула алкина С6H10.
Аналогично задаче 27 решаются все задачи, в которых дан элементный состав вещества, независимо от числа элементов.
Задача 31. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:
Подставим данные задачи в эту формулу:
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число (2,275):
Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2. Это может быть или одноосновная предельная кислота, или её эфир.
Задача 32. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:
поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:
получаем молярные соотношения продуктов реакции:
Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:
Молекулярная формула вещества С2Н6О.
Этот способ определения молекулярной формулы оптимален, когда неизвестна молекулярная масса вещества, поскольку, если молярная масса дана и задана в задаче через плотность или иначе, то задача решается «в лоб» — по уравнению химической реакции.
Задача 33. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
Теперь составим схему реакции, обозначив формулу исходного вещества СхНу
Из выделенных параметров составим пропорции, сначала для СО2:
а затем для воды:
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Задача 34. Установить формулу алкена, если 11,2 г его при взаимодействии с бромоводородом образует 27,4 г бромида с положением брома у третичного атома углерода.
Решение. Вначале рассчитаем массу бромоводорода, согласно закону сохранения массы:
и составим уравнение реакции, используя общую формулу алкенов:
откуда найдём количество вещества алкена:
Теперь легко определить молярную массу неизвестного вещества:
Определим молярную массу неизвестного вещества через n:
отсюда: 14n = 56; n = 4.
Ответ. Состав искомого алкена С4Н8; это 2-метилпропен.
Задачи для самостоятельного решения
75. Оксид неметалла (V), содержащего 56,3 % кислорода, растворили в воде. Определить массовую долю вещества в этом растворе, если исходный оксид был получен из 3,1 г неметалла.
76. Какой щелочной металл образует сульфат с массовой долей кислорода 23,9 %?
77. Плотность паров алкана равна 3,214 г/л. Определите его молекулярную массу. Какую формулу имеет этот углеводород?
78. Один литр алкена имеет массу 1,25 г. Определите молярную массу этого вещества. Составьте его графическую формулу.
79. Углеводород с плотностью по гелию 28,5 содержит 15,8 % водорода. Установить его формулу.
80. При сгорании 2,24 л углеводорода получили 8,96 л СО2 и 7,2 мл воды. Определить формулу углеводорода.
81. Органическое вещество содержит 37,7 % С, 6,3 % Н и 56 % Сl; 6,35 г его паров занимает объём 11,2 л. При гидролизе этого соединения образуется вещество, которое при восстановлении даёт вторичный спирт. Определить состав и строение исходного вещества.
82. При сгорании 1 л газообразного углеводорода, обесцвечивающего раствор перманганата калия, расходуется 4,5 л кислорода и образуется 3 л СО2. Определить формулу углеводорода.
83. Установить формулу вещества, при сгорании 4,6 г которого образуется 4,48 л СО2 и 5,4 мл воды. Плотность паров этого вещества по водороду равна 23.
84. При взаимодействии 16 г одноатомного спирта с натрием выделилось 5,6 л водорода. Какой спирт был взят для реакции?
85. Одноосновная кислота имеет состав: ώ(С) = 40 %; ώ(Н) = 6,67 %; ώ (О) = 53,33 %. Плотность паров её по аргону 1,5. Какая это кислота?
86. Определить строение сложного эфира предельной α-аминоуксусной кислоты, если известно, что он содержит 15,73 % азота.
87. Имеется смесь четырёх изомеров, каждый из которых реагирует с НСl и содержит в молекуле 23,7 % азота. Определить строение этих соединений и массу исходной смеси, если известно, что вещества предельные, а при сгорании смеси образуется 4,48 л азота.
Видео:8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Задачи, в которых учитывается «выход» полученного вещества
Реальные химические процессы никогда не происходят со 100 %-ным выходом, который рассчитывается по уравнению реакции. Например, вы рассчитали, что должно выделиться 100 л газа, а реально его получено 60 л. Значит, выход (ή) в этой реакции равен:
Выход продукта выражается в долях единицы или в процентах. В нашем примере:
Задача 35. Рассчитать массы исходных веществ, необходимых для получения 91 г нитрида кальция, что составляет 80 % от теоретически возможного.
Следует помнить, что в уравнение химической реакции можно подставлять данные только теоретического выхода. Поэтому рассчитаем его (Т):
Подставим полученную величину в уравнение реакции и найдём искомые величины:
Задание. Остальной расчёт сделайте самостоятельно.
Задачи для самостоятельного решения
88. Какой объем этилена можно получить из 92 граммов спирта? Выход составляет 80 % от теоретически возможного количества.
89. Сколько граммов хлорвинила можно получить из 56 л ацетилена, если выход составляет 80 %?
90. 46 г глицерина обработали азотной кислотой. Рассчитайте массу полученного вещества, если выход составляет 40 %. Где применяется это вещество?
91. Из 56 л ацетилена получили 88 г этаналя. Рассчитайте выход в % от теоретически возможного.
92. Сколько граммов спирта нужно взять, чтобы получить 7,4 г этилформиата, что составляет 80 % от теоретического выхода?
93. При нагревании 2,84 г иодметана с 0,69 г натрия получено 179,2 мл углеводорода. Определить выход в % от теоретически возможного.
94. 184 г толуола прореагировали с 1,5 моль хлора в присутствии хлорида алюминия. Реакция протекала с выходом 90 % от теоретически возможного. Вычислить объём полученного газа, водный раствор которого не окрашивает раствор фенолфталеина.
95. При нагревании 28,75 мл алканола (ρ = 0,8 г/мл) с концентрированной серной кислотой, получили газ, который может присоединить 8,96 л водорода. Определить строение спирта, если выход газа составляет 80 %.
96. Какой объём 40 %-ного формалина с плотностью 1,1 г/мл можно получить из 48 мл метанола? Плотность спирта 0,8 г/мл. Выход 80 %.
97. Сколько граммов эфира можно получить при взаимодействии 30 г уксусной кислоты и 30 г этанола с выходом 30 %?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Задачи по химии на тему «Расчеты по химическим уравнениям»(8 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Видео:Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Задачи на расчет по уравнениям химических реакций
Рассчитайте массу сульфата натрия, образовавшегося при нейтрализации гидроксида натрия массой 12 г. серной кислотой.
Какова масса кальция, вступившего в реакцию с водой, если при этом образуется гидроксид массой 4,44 г.
При действии цинка на соляную кислоту было получено 5 г. водорода. Найдите объем кислоты, вступившей в химическую реакцию.
Какой объем хлора прореагировал с иодидом калия, если при этом получилось
Рассчитайте объем углекислого газа (н.у.), выделившегося при разложении 40 г. карбоната кальция.
Рассчитайте объем водорода образовавшегося при взаимодействии 6,5 г. цинка с соляной кислоты.
Найдите массу и количество вещества нитрата меди ( II ), образовавшегося при взаимодействии оксида меди ( II ) массой 4 г. с азотной кислотой.
Рассчитайте объем (н.у.) кислорода, который необходим для полного сгорания магния массой 4,8 г.
Рассчитайте массу и объем углекислого газа , который образуется при разложении 50 г. карбоната кальция
Рассчитайте объем хлороводорода при нормальных условиях, полученный при действии серной кислоты на 5,85 г. хлорида натрия.
Рассчитайте массу соли, которая образуется при взаимодействии 40 г. цинка с раствором хлороводорода.
При взаимодействии водорода с оксидом меди ( II ) образовалось 0,1 моль меди. Рассчитайте массу оксида вступившего в реакцию.
Сколько надо взять серы, чтобы при взаимодействии ее с железом получилось 44 г. сульфата меди ( II )?
Определите массу магния, вступившего в реакцию с кислородом, если образовалось 4 г. оксида.
Рассчитайте объем хлороводорода при нормальных условиях полученный при взаимодействии 11,7 г. хлорида натрия с концентрированной серной кислотой.
Краткое описание документа:
Видео:Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

Задачи на расчет по уравнениям химических реакций
Рассчитайте массу сульфата натрия, образовавшегося при нейтрализации гидроксида натрия массой 12 г. серной кислотой.
Какова масса кальция, вступившего в реакцию с водой, если при этом образуется гидроксид массой 4,44 г.
При действии цинка на соляную кислоту было получено 5 г. водорода. Найдите объем кислоты, вступившей в химическую реакцию.
Какой объем хлора прореагировал с иодидом калия, если при этом получилось
Рассчитайте объем углекислого газа (н.у.), выделившегося при разложении 40 г. карбоната кальция.
Рассчитайте объем водорода образовавшегося при взаимодействии 6,5 г. цинка с соляной кислоты.
Найдите массу и количество вещества нитрата меди ( II ), образовавшегося при взаимодействии оксида меди ( II ) массой 4 г. с азотной кислотой.
Рассчитайте объем (н.у.) кислорода, который необходим для полного сгорания магния массой 4,8 г.
Рассчитайте массу и объем углекислого газа , который образуется при разложении 50 г. карбоната кальция
Рассчитайте объем хлороводорода при нормальных условиях, полученный при действии серной кислоты на 5,85 г. хлорида натрия.
Рассчитайте массу соли, которая образуется при взаимодействии 40 г. цинка с раствором хлороводорода.
При взаимодействии водорода с оксидом меди ( II ) образовалось 0,1 моль меди. Рассчитайте массу оксида вступившего в реакцию.
Сколько надо взять серы, чтобы при взаимодействии ее с железом получилось 44 г. сульфата меди ( II )?
Определите массу магния, вступившего в реакцию с кислородом, если образовалось 4 г. оксида.
Рассчитайте объем хлороводорода при нормальных условиях полученный при взаимодействии 11,7 г. хлорида натрия с концентрированной серной кислотой.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 864 человека из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 48 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 39 человек из 23 регионов
«Профессиональный имидж педагога: стереотипы и методы их преодоления»
Свидетельство и скидка на обучение каждому участнику
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 839 220 материалов в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 01.05.2017
- 1494
- 1
- 01.05.2017
- 330
- 0
- 01.05.2017
- 1173
- 8
- 01.05.2017
- 972
- 5
- 01.05.2017
- 681
- 0
- 01.05.2017
- 1207
- 6
- 01.05.2017
- 791
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 01.05.2017 49132
- DOCX 32 кбайт
- 1443 скачивания
- Рейтинг: 4 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Ахатова Руфина Лифовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года и 11 месяцев
- Подписчики: 0
- Всего просмотров: 66760
- Всего материалов: 15
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Российские школьники начнут изучать историю с первого класса
Время чтения: 1 минута
Школам будет оказана поддержка в обеспечении государственной символикой
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
В Брянской области часть школ переводят на дистанционное обучение
Время чтения: 0 минут
Инфофорум о буллинге в школе: итоги и ключевые идеи
Время чтения: 6 минут
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Химия. 8 класс. Решение задач по уравнениям химических реакций /25.11.2020/Скачать

Задачи по химии 8 класс с решениями с уравнениями химических реакций
Урок посвящен закреплению умений производить расчеты по уравнению реакции с учетом количественных соотношений участников реакции.
I. Алгоритмы решения задач по уравнению химических реакций
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
5. Для вычисления искомого количества вещества,
6. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
Последовательность выполнения действий
Оформление решения задачи
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
5. Вычислим количества вещества, массу которого требуется найти. Для этого составим соотношение.
6. Вычисляем массу вещества, которую требуется найти
7. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ, о которых, идёт речь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции
и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Для вычисления искомого количества вещества, составим соотношение
7. Запишем ответ
- Используя алгоритм, решите самостоятельно задачу:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г (3Fe + 4O2=Fe3O4).
Алгоритм №4
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт реь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Вычислим количества вещества, массу которого необходимо найти
7. Найдем массу вещeства, которую требуется вычислить
8. Запишем ответ
II. Задачи для самостоятельного решения
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
🎦 Видео
Интенсив к РЭ Максвелла для 7-8 классов | Динамика и виды силСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия. 8 класс. Решение задач по уравнениям химических реакций /19.03.2021/Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать