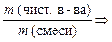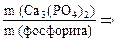учебно-методический материал по химии (8 класс) на тему
Разноуровневые задачи для учащихся 8 класса по теме «Массовая доля вещества в растворе»
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Скачать:
| Вложение | Размер |
|---|---|
| zadachi_na_rastvory.docx | 14.91 КБ |
| zadachi_povyshennogo_urovnya_slozhnosti.docx | 14.29 КБ |
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Предварительный просмотр:
Задачи на растворы
- Какую массу соли и воды необходимо взять для приготовления 260г 25%-ного раствора?
- Какую массу соли и воды необходимо взять для приготовления 500г 60%-ного раствора?
- Какую массу соли и воды необходимо взять для приготовления 340г 8%-ного раствора?
- Какую массу соли и воды необходимо взять для приготовления 800г 2%-ного раствора?
- Смешали 5 г соли и 160 мл воды. Какова массовая доля соли в полученном растворе?
- Смешали 30 г сахара и 320 мл воды. Какова массовая доля сахара в полученном растворе?
- Смешали 10 г сахара и 140 мл воды. какова массовая доля сахара в полученном растворе?
- Смешали 2 г соли и 50 мл воды. Какова массовая доля соли в полученном растворе?
- Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор?
- Какой объем воды надо прилить к 20 г сахара, чтобы получить 70 %-ный раствор?
- Какой объем воды надо прилить к 12 г соли, чтобы получить 98 %-ный раствор?
- Какой объем воды надо прилить к 5 г сахара, чтобы получить 5 %-ный раствор?
- К 200 г 10 %-ного раствора соли прилили 300 мл воды. Каково процентное содержание соли во вновь полученном растворе?;
- К 200 г 20 %-ного раствора соли прилили 50 мл воды. Каково процентное содержание соли во вновь полученном растворе?
- К 60 г 2 %-ного раствора поваренной соли прилили 20 мл воды. Каково процентное содержание поваренной соли во вновь полученном растворе?
- К 120 г 35 %-ного раствора сахара долили 230 мл воды. Каково процентное содержание сахара во вновь полученном растворе?
- К 200 г 10 %-ного раствора добавили 50г соли. Каково процентное содержание соли во вновь полученном растворе?;
- К 200 г 20 %-ного раствора соли добавили 60г соли. Каково процентное содержание соли во вновь полученном растворе?
- К 60 г 2 %-ного раствора добавили 16г соли. Каково процентное содержание поваренной соли во вновь полученном растворе?
- К 120 г 35 %-ного раствора добавили 30г соли. Каково процентное содержание соли во вновь полученном растворе?
- Сколько миллилитров воды надо прилить к 60 г 40 %-ного раствора соли, чтобы получить 12 %-ный раствор?
- Сколько грамм соли надо добавить к 250 г 1 %-ного раствора этой соли, чтобы получить 5 %-ный раствор?
- Сколько миллилитров воды надо прилить к 110 г 8 %-ного раствора сахара, чтобы получить 3 %-ный раствор сахара?
- Сколько грамм сахара надо добавить к 500 г 32 %-ного раствора, чтобы получить 54 %-ный раствор?
- Смешали 200 г 2 %-ного раствора соляной кислоты с 150 г 10 %-ного раствора соляной кислоты. Каково процентное содержание соляной кислоты во вновь полученном растворе?
- Смешали 50 г 10 %-ного раствора серной кислоты с 30 г 20 %-ного раствора серной кислоты. Каково процентное содержание серной кислоты во вновь полученном растворе?
- Смешали 140 г 30 %-ного раствора азотной кислоты с 50 г 35 %-ного раствора азотной кислоты. Каково процентное содержание азотной кислоты во вновь полученном растворе?
- Смешали 200 г 2 %-ного раствора поваренной соли с 800 г 48 %-ного раствора поваренной соли. Каково процентное содержание поваренной соли во вновь полученном растворе?
К ____ г ___%-ного раствора соли прилили ____ г воды, добавили еще ___ г соли, потом добавили ___ г ___%-ного раствора этой же соли, выпарили _____ г воды, добавили ___г ___%-ного. Какой стала массовая доля растворенного вещества в полученном растворе?
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Предварительный просмотр:
Задачи повышенного уровня сложности
- Какая масса соли образуется при действии на гидроксид меди 400 г 12,6% -ного раствора азотной кислоты?
- Какая масса соли может быть получена при действии алюминия на 150 г 18%-ного раствора нитрата железа (П)?
- Какая масса гидроксида натрия может вступить в реакцию с 250 г 15,2% -ного раствора сульфата железа (П)?
- 70г технического железа, содержащего 10 % примесей, нагрели с избытком серы. Определите массу образовавшегося сульфида железа (II)?
- Какой объём кислорода потребуется для полного сжигания 4 кг серы, содержащей 3% примесей?
- Стальную проволоку массой 5 г сожгли в кислороде, при этом получили 0,1 г углекислого газа. Вычислите массовую долю (в %) углерода в этой стали.
- Какая масса раствора серной кислоты с массовой долей кислоты 0,1 требуется для растворения 5,6г железа.
- Какая масса 20%-ного раствора серной кислоты потребуется для полного растворения 8,1 г алюминия?
Задачи повышенного уровня сложности
- Какая масса соли образуется при действии на гидроксид меди 400 г 12,6% -ного раствора азотной кислоты?
- Какая масса соли может быть получена при действии алюминия на 150 г 18%-ного раствора нитрата железа (П)?
- Какая масса гидроксида натрия может вступить в реакцию с 250 г 15,2% -ного раствора сульфата железа (П)?
- 70г технического железа, содержащего 10 % примесей, нагрели с избытком серы. Определите массу образовавшегося сульфида железа (II)?
- Какой объём кислорода потребуется для полного сжигания 4 кг серы, содержащей 3% примесей?
- Стальную проволоку массой 5 г сожгли в кислороде, при этом получили 0,1 г углекислого газа. Вычислите массовую долю (в %) углерода в этой стали.
- Какая масса раствора серной кислоты с массовой долей кислоты 0,1 требуется для растворения 5,6г железа.
- Какая масса 20%-ного раствора серной кислоты потребуется для полного растворения 8,1 г алюминия?
Задачи повышенного уровня сложности
- Какая масса соли образуется при действии на гидроксид меди 400 г 12,6% -ного раствора азотной кислоты?
- Какая масса соли может быть получена при действии алюминия на 150 г 18%-ного раствора нитрата железа (П)?
- Какая масса гидроксида натрия может вступить в реакцию с 250 г 15,2% -ного раствора сульфата железа (П)?
- 70г технического железа, содержащего 10 % примесей, нагрели с избытком серы. Определите массу образовавшегося сульфида железа (II)?
- Какой объём кислорода потребуется для полного сжигания 4 кг серы, содержащей 3% примесей?
- Стальную проволоку массой 5 г сожгли в кислороде, при этом получили 0,1 г углекислого газа. Вычислите массовую долю (в %) углерода в этой стали.
- Какая масса раствора серной кислоты с массовой долей кислоты 0,1 требуется для растворения 5,6г железа.
- Какая масса 20%-ного раствора серной кислоты потребуется для полного растворения 8,1 г алюминия?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

По теме: методические разработки, презентации и конспекты
Массовая доля вещества в растворе
Презентация к уроку по теме: Массовая доля вещества в растворе для учащихся 8 класса. Можно использовать при изучении нового материала и при выполнении практической ратоты по данной теме.
Контрольная работа по теме «Массовая доля вещества в растворе».
Материал предназначен для проведения контроля знаний. Содержит два варианта работы. В работе есть инвариантный блок, обязательный для решения всеми учащимися, и два вариативных блока разной сложности.
задание №27 егэ по химии 2018 — расчёты с использованием понятия «массовая доля вещества в растворе»
В помощь школьникам, которые собираются сдавать ЕГЭ по химии в 2018 году, сделан подбор задач к заданию №27 — расчёты с использованием понятия «массовая доля вещества в растворе».
Решение расчётной задачи №27 (определение массовой доли вещества в растворе) в ЕГЭ по химии с использованием метода «Стаканов».
Представленный в презентации метод позволяет существенно сэкономить время на экзамене при расчёте задач на определение массовой доли вещества в растворе. Приведено несколько примеров: — расчёт ма.
Открытый урок по теме:«Решение задач с использованием понятия «массовая доля вещества в растворе»»
Открытый урок по теме: «Решение задач с использованием понятия «массовая доля вещества в растворе»».
Конспект урока «Массовая доля вещества в растворе. Решение задач».
Приводится конспект урока в 8 классе с использованием технологии проблемного обучения.
Проверочная работа «Растворы. Массовая доля вещества в растворе»
Проверочная работа для учащихся 8 класса по теме «Растворы» в 12 вариантах для текущего контроля.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Дидактический материал: «Решение расчетных задач на примеси»
Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего определенную массовую долю примесей (в %)
При решении задач этого типа необходимо вначале рассчитать массу или объем чистого вещества, которое содержится в исходной смеси, а потом решать как обычную задачу по химическому уравнению. Массу чистого вещества (как и объем) можно вычислить двумя способами.
С п о с о б 1. Массу чистого вещества (или объем) определяют по формуле:
w (чист. в-ва) = 100 % – w (примеси),
w (чист. в-ва) =
m (чист. в-ва) = m (смеси) · w (чист. в-ва)
Способ 2. Вначале определяют массу примеси:
m (примеси) = m (смеси) · w (примеси), а затем вычитают ее из массы смеси: m (чист. в-ва) = m (смеси) – m (примеси).
П р и м е р 1. На завод было доставлено 50 т фосфорита, содержащего 35 % пустой породы. Определите массу фосфата кальция в природном фосфорите.
С п о с о б 1. Массовая доля фосфата кальция в руде составляет:
Способ 2. m (примеси) = 50 т · 0,35 = 17,5 т, тогда
П р и м е р 2. Определите, какой объем ацетилена можно получить из карбида кальция массой 10 кг, массовая доля примесей в котором 15 %.
1. Определяем массу примесей:
m (примеси) = 10 · 0,15 = 1,5 (кг)
2. Масса чистого карбида кальция равна
m (CaC2) = 10 – 1,5 = 8,5 (кг).
3. Составляем уравнение реакции:
0,133 моль х моль
4. Рассчитываем ν ( CaC2):
ν ( CaC2) = 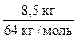
5. По уравнению реакции определяем ν ( C2Н2):
6. Определяем объем ацетилена:
П р и м е р 3. Вычислите, какая масса фосфорита с массовой долей примесей 12 % необходима для получения фосфора массой 200 кг.
х моль 6,452 моль
Ca3(PO4)2 + 3SiO2 + 5C 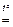
1. Определяем ν ( P ) : ν ( P) = 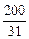
2. По уравнению реакции определяем ν ( Ca3(PO4)2) чистого:
ν ( Ca3(PO4)2 ) : ν ( P) = 1 : 2 Þ ν ( Ca3(PO4)2) = 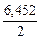
3. Находим массу чистого фосфата кальция, необходимую для получения фосфора массой 200 кг:
4. Находим массовую долю чистого фосфата кальция:
w (Ca3(PO4)2) = 100 % – w (примесей) = 100 % – 12 % = 88 %.
5. Определяем массу фосфорита, необходимую для получения фосфора массой 200 кг:
w (Ca3(PO4)2) =
Þ m (фосфорита) = 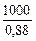
П р и м е р 4. При взаимодействии кальцинированной соды массой 10,8 г с избытком соляной кислоты получили оксид углерода (IV) объемом 2,24 л (н. у.). Вычислите массовую долю (%) примесей в кальцинированной соде.
1. Находим количество вещества СО2:
ν ( СО2) = 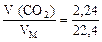
2. Вычисляем массу Na2CO3 в кальцинированной соде.
Из уравнения реакции следует:
3. Находим массу примесей в кальцинированной соде:
m (прим.) = m (кальц. сода) – m (Na2CO3) = 10,8 – 10,6 = 0,2 (г)
4. Вычисляем массовую долю примесей:
w примесей = 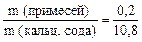
1. Определите массу NaOH, которую можно получить при взаимодействии соды с известковым молоком, полученным из 5 кг известняка, содержащего 80 % CaCO3. (3,2 кг.)
2. Вычислите объем (в м 3 ) оксида углерода (IV) и массу жженой извести (CaO), которые можно получить при обжиге 500 кг известняка, содержащего 92 % карбоната кальция. (257,6 кг CaO и 103 м 3 СО2.)
3. Какая масса раствора с массовой долей серной кислоты 70 % потребуется для получения фосфорной кислоты из фосфорита массой 200 кг, содержащего 70 % Ca3(PO4)2? (189,7 кг.)
4. При взаимодействии 5,0 г технического магния с избытком соляной кислоты выделилось 3,36 л водорода (н. у.). Вычислите массовую долю (в %) чистого магния в техническом магнии. (72,0 %.)
5. Оксид углерода (IV), полученный при сжигании угля массой 50 г, пропустили через раствор гидроксида бария. Какая масса осадка образовалась, если массовая доля углерода в угле составляет 96 %? (788 г.)
6. Песок массой 2 кг сплавили с избытком гидроксида калия, получив в результате реакции силикат калия массой 3,82 кг. Определите выход продукта реакции, если массовая доля оксида кремния (IV) в песке равна 90 %. (82,7 %.)
7. При сгорании технической серы массой 10 г выделился газ, который пропустили через избыток раствора гидроксида натрия. В реакцию вступил гидроксид натрия массой 24 г. Определите массовую долю серы в техническом продукте. (96 %.)
8. Вычислите массу раствора кислоты с массовой долей HCℓ 30 %, затраченную на растворение цинка массой 200 г с массовой долей примесей 35 %. (487 г.)
9. Для обжига сульфида цинка массой 2 т с массовой долей негорючих веществ 3 % израсходовали 6000 м 3 воздуха. Определите объемные доли газов в образовавшейся газовой смеси. (83,1 % N2; 7,76 % SO2; 9,14 % О2.)
10. Вычислите, какая масса магнетита Fe3O4, содержащего 10 % примесей, необходима для получения железа массой 4 т. (6,134 т.)
11. При действии на мрамор массой 10,5 г соляной кислотой выделился оксид углерода (IV) объемом 2,24 л (н. у.). Определите массовую долю (%) карбоната кальция в мраморе. (95,24 %.)
12. При прокаливании на воздухе пирита массой 5 кг получен оксид серы (IV) массой 5,12 кг. Определите массовую долю FeS2 в пирите. (96 %.)
13. Вычислите число атомов углерода и кислорода в карбонате кальция массой 11 кг, в котором находится 9,1 % примесей, не содержащих углерод и кислород. (6 · 10 22 атомов углерода; 1,8 · 10 23 атомов кислорода.)
14. Вычислите число атомов цинка и хлора в хлориде цинка массой 42,5 г, в котором находится 20 % примесей, не содержащих цинк и хлор. (1,5 · 10 23 атомов цинка; 3 · 10 23 атомов хлора.)
15. Массовая доля ZnS в цинковой обманке составляет 97 %. Определите, какой объем сероводорода образуется из 500 кг цинковой обманки. (112 м 3 .)
16. Какое количество бензола можно получить из ацетилена, выделившегося при обработке водой карбида кальция массой 42,8 г с массовой долей примесей 18,4 %? Массовая доля выхода бензола составляет 30 %. (0,054 моль.)
17. Из карбида кальция массой 7,5 г с массовой долей примесей 4 % получили ацетилен, который был превращен в альдегид по реакции Кучерова. Какая масса серебра выделится при взаимодействии всего полученного альдегида с аммиачным раствором оксида серебра? (24,3 г.)
18. Природный газ объемом 235,8 л (н. у.) использовали для получения ацетилена. Объемная доля метана в газе составляет 95 %. Определите объем образовавшегося ацетилена (н. у.), если его выход составил 60 %. (67,2 л.)
19. Вычислите массу раствора с массовой долей гидроксида натрия 10 %, необходимую для полной нейтрализации продукта сгорания природного газа объемом 23,33 л (н. у.). Объемная доля метана составляет 96 %. (800 г.)
20. Какой объем природного газа (н. у.) потребуется для получения муравьиной кислоты массой 69 г путем каталитического окисления метана? Объемная доля метана в природном газе составляет 98 %. (34,28 л.)
21. Образец технического карбида алюминия массой 16 г обработали избытком воды. Определите объем газа (н. у.), который получили, если массовая доля примесей в карбиде составляет 10 %, а выход продукта реакции равен 75 %. (5,04 л.)
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Задачи на примеси. Химия 8 класс.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Задачи на тему: «Вычисление массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего определенную массовую долю примесей»
1.Вычислитеобъем (м 3 ) оксида углерода ( IV ) и массу жженой извести ( CaO ), которые можно получить при обжиге 500 кг известняка, содержащего 92% карбоната кальция.
2.При взаимодействии 5,0 г технического магния и избытком соляной кислоты выделилось 3,36 л водорода (н. у.). Вычислите массовую долю (%) чистого магния в техническом магнии (72,0%)
3.Оксид углерода ( IV ), полученный при сжигании угля массой 50 г, пропустили через раствор гидроксида бария. Какая масса осадка образовалась, если массовая доля углерода в угле составляет 96%?
4.Вычислите массу раствора кислоты с массовой долей HCl 30%, затраченную на растворение цинка массой 200 г с массовой долей примесей 35%.
5.Вычислите, какая масса магнетита Fe 3 O 4 , содержащего 10% примесей, необходима для получения железа массой 4 т.
6.При действии на мрамор массой 10,5 г соляной кислоты выделился оксид углерода ( IV ) объёмом 2,24 л (н.у.). Определите массовую долю (%) карбоната кальция в мраморе.
7.При прокаливании на воздухе пирита массой 5 кг получен оксид серы ( IV ) массой 5,12 кг. Определите массовую долю FeS 2 в пирите.
8.Массовая доля ZnS в цинковой обманке составляет 97%. Определите, какой объём сероводорода образуется из 500 кг цинковой обманки.
🌟 Видео
8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ по уравнению реакции | Массовая доля растворенного веществаСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Определение массовых долей элементов в соединениях. 8 класс.Скачать

Задачи по химическим уравнениям. Урок 15. Химия 8 классСкачать

Как решать задачи с МАССОВОЙ ДОЛЕЙ | Массовая доля растворенного веществаСкачать

Решение задач на массовую долю. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Задачи на примеси. 1 часть. 9 класс.Скачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

8 класс Химия Решение задач. Массовая доля вещества в растворе.Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Химия. 8 класс. Решение задач по уравнениям химических реакций /25.11.2020/Скачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать