Предлагаются алгоритмы решения задач на вывод молекулярной формулы углеводородов и образцы решения.
- Просмотр содержимого документа «Задачи на вывод молекулярной формулы углеводородов (алгоритмы)»
- Химия, часть С. Задача С5. Определение формул органических веществ.
- Типы задач в задании С5.
- Необходимые теоретические сведения.
- Определение формул веществ по массовым долям атомов, входящих в его состав.
- Определение формул веществ по продуктам сгорания.
- Определение формул веществ по химическим свойствам.
- Урок химии в 10-м классе. Тема: «Решение задач на нахождение формулы органического вещества»
- 📸 Видео
Просмотр содержимого документа
«Задачи на вывод молекулярной формулы углеводородов (алгоритмы)»
Анна Валерьевна Дзенис
Задачи на вывод молекулярной формулы углеводородов
I. По массовым долям элементов
1) Пусть имеется углеводород СхНу, тогда ω%(C) – массовая доля углерода 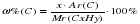
преобразуя эту формулу, можно выразить «х» — число атомов углерода: 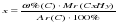
Аналогично: 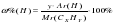
преобразуем эту формулу, выражая число атомов водорода («у»):
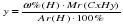
[Примечание: если по условию задачи известна массовая доля только одного элемента, то массовую долю второго элемента можно определить из формулы: 
2) Относительную молекулярную массу углеводорода можно вычислить, зная величину относительной плотности данного углеводорода по какому-либо газу «А» (водород, кислород, гелий, азот или воздух и др):
где
Задача-образец: Определите молекулярную формулу углеводорода, содержащего 84% углерода, если относительная плотность данного вещества по азоту = 3,57.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химия, часть С. Задача С5. Определение формул органических веществ.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
| Массовая доля атома Э в веществе = | Атомная масса атома Э | • | число атомов Э в | молекуле |
| Аr(Э) • z | ||||
| —————— | ||||
| Mr(вещ.) | ||||
| Молекулярная масса вещества | ||||
Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
| Вещество | Молекулярная формула | Соотношение атомов | Простейшая формула |
| Этанол | С2Н6О | С:Н:О = 2:6:1 | С2Н6О |
| Бутен | С4Н8 | С:Н = 1:2 | СН2 |
| Уксусная кислота | С2Н4О2 | С:Н:О = 1:2:1 | СН2О |
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm ,
а молярную массу газа можно найти, умножая плотность на молярный объём.
Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
| Класс органических веществ | Общая молекулярная формула | Формула с выделенной кратной связью и функциональной группой | ||||||||||
| Алканы | CnH2n+2 | — | ||||||||||
| Алкены | CnH2n | CnH2n+1–CH=CH2 | ||||||||||
| Алкины | CnH2n−2 | CnH2n+1–C≡CH | ||||||||||
| Диены | CnH2n−2 | — | ||||||||||
| Гомологи бензола | CnH2n−6 | С6Н5–СnH2n+1 | ||||||||||
| Предельные одноатомные спирты | CnH2n+2O | CnH2n+1–OH | ||||||||||
| Многоатомные спирты | CnH2n+2Ox | CnH2n+2−x(OH)x | ||||||||||
| Предельные альдегиды | CnH2nO |
| ||||||||||
| Кетоны | CnH2nO |
| ||||||||||
| Фенолы | CnH2n−6O | С6Н5(СnH2n)–OH | ||||||||||
| Предельные карбоновые кислоты | CnH2nO2 |
| ||||||||||
| Сложные эфиры | CnH2nO2 |
| ||||||||||
| Амины | CnH2n+3N | СnH2n+1NH2 | ||||||||||
| Аминокислоты (предельные одноосновные) | CnH2n+1NO2 |
|
Видео:10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать

Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Решение примера 1.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•10 23 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•10 22 / 6,02•10 23 = 0,05 моль ,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль .
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.
В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0 , т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2.
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2→ CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
Масса всего вещества 9,8 г.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

Определение формул веществ по химическим свойствам.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2→ СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
| 0,005 | 0,01 | |
| СnH2n−2 | + 2Br2 → | СnH2n−2Br4 |
Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль .
Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH .
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
Получим два уравнения, из которых найдём m и n:
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH .
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1 .
Это аланин — аминопропановая кислота.
Видео:Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

Урок химии в 10-м классе. Тема: «Решение задач на нахождение формулы органического вещества»
Разделы: Химия
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения задач;
- закрепить навыки работы с алгоритмами;
- показать взаимосвязь химии и математики.
1. Оргмомент
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) =
(2)
б) если СО2 дано в объеме:
n(C) =
(3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2
(4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = 
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в данной формулу один атом N.
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
1. Вычисляем молярную массу вещества.
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = 
б) если w дана в долях:
n(Э) = 
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества равна молярной массе вещества (1), тогда задача решена правильно; если молярная масса полученного вещества отличается от молярной массы вещества (1), вычисляем разность и определяем количество атомов кислорода, если вещество кислородосодержащие, или азота, если вещество азотосодержащее.
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = 
3. Находим количество атомов Н по формуле (2)
n(Н) = 
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
6. Домашнее задание
Гара Н.Н., Горбусева Н. И. Сборник задач. – М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
📸 Видео
Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

10 класс 12 урок Задачи на вывод формул в органической химии на примере углеводородовСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Поиск формулы вещества по продуктам его сгоранияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

2 ГЛАВНЫХ формулы в Химии при решении задачСкачать

Решение простых задач на вывод формулСкачать

Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

Задачи на вывод формул веществаСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать


 (2)
(2) (3)
(3) (4)
(4)