учебно-методическое пособие по химии (10 класс)
Алгоритм решения задач. Определение молекулярной формулы по продуктам сгорания.
- Скачать:
- Предварительный просмотр:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Химия, часть С. Задача С5. Определение формул органических веществ.
- Типы задач в задании С5.
- Необходимые теоретические сведения.
- Определение формул веществ по массовым долям атомов, входящих в его состав.
- Определение формул веществ по продуктам сгорания.
- Определение формул веществ по химическим свойствам.
- Решение задач на определение формул органических веществ (подготовка к ЕГЭ по химии)
- 📹 Видео
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| algoritm_resheniya_zadach._opredelenie_molekulyarnoy_formuly_po_produktam_sgoraniya.doc | 68 КБ |
| zadachi_na_vyvod_formuly.docx | 67.76 КБ |
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Предварительный просмотр:
Алгоритм решения задач на вывод формул органических веществ.
Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле. Если продуктами горения являются СО 2 и Н 2 О, то вещество может содержать 3 элемента (C x H у O z ). Частный случай: продуктом горения кроме СО 2 и Н 2 О является азот (N 2 ) для азотсодержащих веществ (C x H у O z N m ).
Пример. При сжигании органического вещества массой 0,46 г, было получено 0,88 г оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу.
1. Истинную относительную молекулярную массу вещества вычисляем по его плотности по водороду: Мr (в-ва) = D(н 2 ) ∙ Мr(н 2 ) = 23 · 2 = 46
2. Найдем массы углерода и водорода в веществе:
С → CO 2 х = 0,24 г
2Н → H 2 O у = 0,06 г
3. Определим массу кислорода в веществе:
m(O) = m(в-ва) – (m(С) + m(Н))= 0,46 г – (0,24 г + 0,06 г) = 0,16 г
4. Вычислим количества вещества атомов углерода, водорода, кислорода:
ν(C) = m/M = 0,24/12 = 0,02 моль
ν(Н) = m/M = 0,06/1 = 0,06 моль
ν(О) = m/M = 0,16/16 = 0,01 моль
5. Найдем отношение индексов х:y:z
х:y:z = ν(C) : ν(Н) : ν(O) = 0,02 : 0,06 : 0,01 = 2: 6 : 1
Эмпирическая (простейшая) формула вещества С 2 Н 6 О
6. По дополнительному условию задачи определим истинную формулу вещества.
Относительная молекулярная масса простейшей формулы:
Мr(С 2 Н 6 О) = 12 · 2 + 1 ∙ 6 + 16 · 1 = 46
Следовательно, найденная эмпирическая формула вещества является истинной.
Ответ: С 2 Н 6 О.
Решение задач на вывод формул органических веществ, содержащих кислород.
Задача 1 . При сжигании 0.46 г органического вещества было получено 0.88 г оксида углерода (IV) и 0.54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Задача 2. При сгорании органического вещества массой 2,3 г образовались оксид углерода (IV) объемом 2,24 л и вода массой 2,7 г. Относительная плотность паров этого вещества по воздуху равна 1, 59. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Задача 3. При сжигании 1,8 г органического вещества образовалось 2, 016 л оксида углерода (IV) (н.у.) и 2,16 г водяных паров. Напишите структурные формулы и названия всех возможных изомеров этого вещества, если известно. Что 1 л его паров при нормальных условиях имеет массу 2, 679 г (Ответ: С 3 Н 7 О).
Алгоритм решения задач на вывод формул органических веществ.
Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле. Если продуктами горения являются СО 2 и Н 2 О, то вещество может содержать 3 элемента (C x H у O z ). Частный случай: продуктом горения кроме СО 2 и Н 2 О является азот (N 2 ) для азотсодержащих веществ (C x H у O z N m ).
Пример. При сжигании органического вещества массой 0,46 г, было получено 0,88 г оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу.
1. Истинную относительную молекулярную массу вещества вычисляем по его плотности по водороду: Мr (в-ва) = D(н 2 ) ∙ Мr(н 2 ) = 23 · 2 = 46
2. Найдем массы углерода и водорода в веществе:
С → CO 2 х = 0,24 г
2Н → H 2 O у = 0,06 г
3. Определим массу кислорода в веществе:
m(O) = m(в-ва) – (m(С) + m(Н))= 0,46 г – (0,24 г + 0,06 г) = 0,16 г
4. Вычислим количества вещества атомов углерода, водорода, кислорода:
ν(C) = m/M = 0,24/12 = 0,02 моль
ν(Н) = m/M = 0,06/1 = 0,06 моль
ν(О) = m/M = 0,16/16 = 0,01 моль
5. Найдем отношение индексов х:y:z
х:y:z = ν(C) : ν(Н) : ν(O) = 0,02 : 0,06 : 0,01 = 2: 6 : 1
Эмпирическая (простейшая) формула вещества С 2 Н 6 О
6. По дополнительному условию задачи определим истинную формулу вещества.
Относительная молекулярная масса простейшей формулы:
Мr(С 2 Н 6 О) = 12 · 2 + 1 ∙ 6 + 16 · 1 = 46
Следовательно, найденная эмпирическая формула вещества является истинной.
Ответ: С 2 Н 6 О.
Решение задач на вывод формул органических веществ, содержащих кислород.
Задача 1 . При сжигании 0.46 г органического вещества было получено 0.88 г оксида углерода (IV) и 0.54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Задача 2. При сгорании органического вещества массой 2,3 г образовались оксид углерода (IV) объемом 2,24 л и вода массой 2,7 г. Относительная плотность паров этого вещества по воздуху равна 1, 59. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Задача 3. При сжигании 1,8 г органического вещества образовалось 2, 016 л оксида углерода (IV) (н.у.) и 2,16 г водяных паров. Напишите структурные формулы и названия всех возможных изомеров этого вещества, если известно. Что 1 л его паров при нормальных условиях имеет массу 2, 679 г (Ответ: С 3 Н 7 О).
Задача 4. Выведите формулу вещества, содержащего 52% углерода, кислорода – 35% и 13% водорода. Относительная плотность паров этого вещества по водороду равна 23. (Ответ: С 2 Н 6 О).
Задача 5. При сгорании органического вещества массой 13,8 г образовались оксид углерода (IV) объемом 13,44 л и вода массой 16,2 г. Плотность этого вещества равна 2,054 г/мл. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Решение задач на смеси по теме «Спирты. Фенолы»
Задача 1. На 15 г смеси этанола и фенола подействовали избытком бромной воды, при этом выпало 33,1 г осадка. Вычислите массовую долю (в %) каждого компонента в смеси (Ответ: 62,7% С 6 Н 5 ОН, 37,3% С 2 Н 5 ОН).
Задача 2. При взаимодействии 19 г смеси метилового спирта и фенола с бромной водой образовалось 33,1 г осадка. Определите массовую долю (в %) метилового спирта в исходной смеси (Ответ: 50,5% СН 3 ОН).
Задача 3. При взаимодействии смеси этанола и фенола с избытком бромной воды выпал осадок массой 33,1 г. Такое же количество исходной смеси может прореагировать с 13,8 г металлического натрия. Определите количественный состав исходной смеси (Ответ: 9,4 г С 6 Н 5 ОН, 23 г С 2 Н 5 ОН).
Задача 4. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси (Ответ: 40,66% С 2 Н 5 ОН).
Задача 4. Выведите формулу вещества, содержащего 52% углерода, кислорода – 35% и 13% водорода. Относительная плотность паров этого вещества по водороду равна 23. (Ответ: С 2 Н 6 О).
Задача 5. При сгорании органического вещества массой 13,8 г образовались оксид углерода (IV) объемом 13,44 л и вода массой 16,2 г. Плотность этого вещества равна 2,054 г/мл. Определите его молекулярную формулу. (Ответ: С 2 Н 6 О).
Решение задач на смеси по теме «Спирты. Фенолы»
Задача 1. На 15 г смеси этанола и фенола подействовали избытком бромной воды, при этом выпало 33,1 г осадка. Вычислите массовую долю (в %) каждого компонента в смеси (Ответ: 62,7% С 6 Н 5 ОН, 37,3% С 2 Н 5 ОН).
Задача 2. При взаимодействии 19 г смеси метилового спирта и фенола с бромной водой образовалось 33,1 г осадка. Определите массовую долю (в %) метилового спирта в исходной смеси (Ответ: 50,5% СН 3 ОН).
Задача 3. При взаимодействии смеси этанола и фенола с избытком бромной воды выпал осадок массой 33,1 г. Такое же количество исходной смеси может прореагировать с 13,8 г металлического натрия. Определите количественный состав исходной смеси (Ответ: 9,4 г С 6 Н 5 ОН, 23 г С 2 Н 5 ОН).
Задача 4. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси (Ответ: 40,66% С 2 Н 5 ОН).
Задача 1. При сжигании 6,6 г органического вещества было получено 13,2 г оксида углерода (IV) и 5,4 г воды. Плотность паров вещества по азоту равна 1,57. Определите его молекулярную формулу и назовите вещество. (Ответ: С 2 Н 4 О).
Задача 2. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси. (Ответ: 40,66%).
Задача 1. При сжигании 0,46 г органического вещества было получено 0,448 л оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу и составьте структурные формулы 2 изомеров. (Ответ: С 2 Н 6 О).
Задача 2. Для нейтрализации смеси уксусной кислоты и фенола потребовалось 95,2 мл 6,4% раствора гидроксида натрия (плотность 1,05 г/см 3 ). При обработке такой же массы исходной смеси бромной водой выпало 20 г осадка. Определите массовую долю (в %) уксусной кислоты в исходной смеси. (Ответ: 51,5%).
Задача 1. При сжигании 6,6 г органического вещества было получено 13,2 г оксида углерода (IV) и 5,4 г воды. Плотность паров вещества по азоту равна 1,57. Определите его молекулярную формулу и назовите вещество. (Ответ: С 2 Н 4 О).
Задача 2. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси. (Ответ: 40,66%).
Задача 1. При сжигании 0,46 г органического вещества было получено 0,448 л оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу и составьте структурные формулы 2 изомеров. (Ответ: С 2 Н 6 О).
Задача 2. Для нейтрализации смеси уксусной кислоты и фенола потребовалось 95,2 мл 6,4% раствора гидроксида натрия (плотность 1,05 г/см 3 ). При обработке такой же массы исходной смеси бромной водой выпало 20 г осадка. Определите массовую долю (в %) уксусной кислоты в исходной смеси. (Ответ: 51,5%).
Задача 1 . При сжигании 6,6 г органического вещества было получено 13,2 г оксида углерода (IV) и 5,4 г воды. Плотность паров вещества по азоту равна 1,57. Определите его молекулярную формулу и назовите вещество. (Ответ: С 2 Н 4 О).
Задача 2. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси. (Ответ: 40,66%).
Задача 1 . При сжигании 0,46 г органического вещества было получено 0,448 л оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу и составьте структурные формулы 2 изомеров. (Ответ: С 2 Н 6 О).
Задача 2. Для нейтрализации смеси уксусной кислоты и фенола потребовалось 95,2 мл 6,4% раствора гидроксида натрия (плотность 1,05 г/см 3 ). При обработке такой же массы исходной смеси бромной водой выпало 20 г осадка. Определите массовую долю (в %) уксусной кислоты в исходной смеси. (Ответ: 51,5%).
Задача 1 . При сжигании 6,6 г органического вещества было получено 13,2 г оксида углерода (IV) и 5,4 г воды. Плотность паров вещества по азоту равна 1,57. Определите его молекулярную формулу и назовите вещество. (Ответ: С 2 Н 4 О).
Задача 2. Для нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40% раствора гидроксида калия (плотность 1,4 г/см 3 ). При обработке такой же массы исходной смеси металлическим натрием выделилось 6,72 л газа. Определите массовую долю (в %) этилового спирта в исходной смеси. (Ответ: 40,66%).
Задача 1 . При сжигании 0,46 г органического вещества было получено 0,448 л оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу и составьте структурные формулы 2 изомеров. (Ответ: С 2 Н 6 О).
Задача 2. Для нейтрализации смеси уксусной кислоты и фенола потребовалось 95,2 мл 6,4% раствора гидроксида натрия (плотность 1,05 г/см 3 ). При обработке такой же массы исходной смеси бромной водой выпало 20 г осадка. Определите массовую долю (в %) уксусной кислоты в исходной смеси. (Ответ: 51,5%).
Видео:Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

Предварительный просмотр:
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
- Образовательные:
- закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
- научить школьников решать задачи на нахождение молекулярной формулы органического вещества;
- сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
- Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
- Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для учащихся 10 класса, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом C x H y , в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH 3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C 2 H 6 , C 3 H 9 , C 4 H 12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая D H2 = 15.
Тогда M(C x H y ) = 15 M(H 2 ) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH 3 ) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C 2 H 6 .
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу M r (C х H y ) по относительной плотности:
3. Найти индексы х и y по отношению 
4. Записать простейшую формулу: С 3 Н 8 .
Проверка: М r (C 3 H 8 ) = 44, следовательно, C 3 H 8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
1. Записать условие задачи.
2. Найти массовую долю водорода:

3. Найти индексы и простейшую формулу для углеводорода C х H y :
следовательно, простейшая формула – C 2 H 5 .
4. Найти истинную формулу. Поскольку общая формула алканов С n H 2 n +2 , то истинная формула – С 4 Н 10 .
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
M r = D возд • М r (возд.),
M r (C х H y )= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:


5. Найти количество вещества воды:

6. Найти количество вещества водорода в сожженном веществе:



7. Найти простейшую формулу углеводорода:


следовательно, простейшая формула – С 2 Н 5 .
8. Найти истинную формулу углеводорода:
М r (C 2 H 5 ) = 29,
M r (C х H y ) = 58,
следовательно, истинная формула – C 4 H 10 .
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:


4. Найти количества веществ воды и водорода:


5. Найти сумму масс углерода и водорода:
m (C) + m (H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода C х H y :


следовательно, простейшая формула – СН 2 .
8. Найти истинную формулу углеводорода:
M r (в-ва) : M r (CH 2 ) = 42 : 14 = 3,
следовательно, истинная формула – С 3 Н 6 .
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
- Общая формула алканов C n H 2n+2 , общая формула монохлоралканов C n H 2n+1 Cl
- Cоставим выражение для расчета массовой доли хлора:
М(C n H 2n+1 Cl) 14n+36,5
Формула монохлоралкана С 4 Н 9 Сl
3. Графические формулы изомеров:
СН 3 – СН 2 – СН 2 – СН 2 Сl 1-хлорбутан
СН 3 – СН 2 – СНCl– СН 3 2- хлорбутан
СН 3 – СН – СН 2 Сl 2-метил-1-хлорпропан
СН 3 – СCl – СН 3 2-метил-2-хлорпропан
Задача 2 . Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
- Общая формула монобромлканов C n H 2n+1 Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
- Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
- Формула бромалкана С 3 Н 7 Br, исходного алкана С 3 Н 6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
C n H 2n + Н Сl = C n H 2n+1 Cl
C n H 2n + Н Br = C n H 2n+1 Br
- Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(C n H 2n+1 Cl) = n(C n H 2n+1 Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С 3 Н 6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
- Находим количество вещества алкена:
n(C n H 2n ) = 1,012/22,4 = 0,045 моль
C n H 2n +Сl 2 = C n H 2n Cl 2
n(C n H 2n Cl 2 )= n(C n H 2n ) =0,045 моль
- М(C n H 2n Cl 2 )=m/n=5,09/0,045=113г/моль
Формула алкена С 3 Н 6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Задача 2 . Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО 2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода.
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана.
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5 . При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9 . Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11 . При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14 . При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO 2 и 7,2 г Н 2 О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

По теме: методические разработки, презентации и конспекты
Блок-схема «Решение задач по теме: Вывод формул органических веществ»
Демонстрация двух основных вариантов решения задач по органической химии, связанных с выводом химических формул соединений.
задачи на вывод формул органических веществ
16 вариантов задач для 10 класса.
Алгоритм решения задач на вывод формул органических веществ, содержащих кислород.
Алгоритм решения задач на вывод формул органических веществ, содержащих кислород.
Решение задач на вывод формул органических соединений
В данном методическом материале находятся задачи, которые можно использовать на уроке» Решение задач на вывод молекулярной формулы органических веществ».
Интегрированный урок (математика + химия), 10-й класс «Решение задач на вывод формул органических веществ» Учитель математики: Гугняева АА(МАОУ СОШ №107г.Пермь) Учитель химии: Коковина ЛЕ(МАОУ СОШ
Интегрированный урок (математика + химия), 10-й класс «Решение задач на вывод формул органических веществ» .
Интегрированный урок (математика + химия), 10-й класс (2 часа). «Решение задач на вывод формул органических веществ»
Интегрированный урок (химии и математики) по решению задач на вывод формул органических веществ различными способами. Даны алгоритмы решения задач в приложении.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химия, часть С. Задача С5. Определение формул органических веществ.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
| Массовая доля атома Э в веществе = | Атомная масса атома Э | • | число атомов Э в | молекуле |
| Аr(Э) • z | ||||
| —————— | ||||
| Mr(вещ.) | ||||
| Молекулярная масса вещества | ||||
Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
| Вещество | Молекулярная формула | Соотношение атомов | Простейшая формула |
| Этанол | С2Н6О | С:Н:О = 2:6:1 | С2Н6О |
| Бутен | С4Н8 | С:Н = 1:2 | СН2 |
| Уксусная кислота | С2Н4О2 | С:Н:О = 1:2:1 | СН2О |
Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm ,
а молярную массу газа можно найти, умножая плотность на молярный объём.
Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.
| Класс органических веществ | Общая молекулярная формула | Формула с выделенной кратной связью и функциональной группой | ||||||||||
| Алканы | CnH2n+2 | — | ||||||||||
| Алкены | CnH2n | CnH2n+1–CH=CH2 | ||||||||||
| Алкины | CnH2n−2 | CnH2n+1–C≡CH | ||||||||||
| Диены | CnH2n−2 | — | ||||||||||
| Гомологи бензола | CnH2n−6 | С6Н5–СnH2n+1 | ||||||||||
| Предельные одноатомные спирты | CnH2n+2O | CnH2n+1–OH | ||||||||||
| Многоатомные спирты | CnH2n+2Ox | CnH2n+2−x(OH)x | ||||||||||
| Предельные альдегиды | CnH2nO |
| ||||||||||
| Кетоны | CnH2nO |
| ||||||||||
| Фенолы | CnH2n−6O | С6Н5(СnH2n)–OH | ||||||||||
| Предельные карбоновые кислоты | CnH2nO2 |
| ||||||||||
| Сложные эфиры | CnH2nO2 |
| ||||||||||
| Амины | CnH2n+3N | СnH2n+1NH2 | ||||||||||
| Аминокислоты (предельные одноосновные) | CnH2n+1NO2 |
|
Видео:10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать
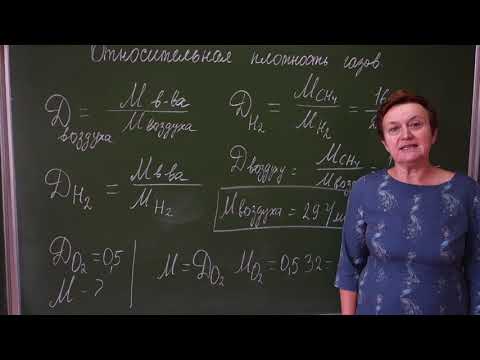
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Решение примера 1.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•10 23 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•10 22 / 6,02•10 23 = 0,05 моль ,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль .
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Видео:Установление формулы органического вещества (простейшие задачи)Скачать

Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду.
Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.
В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0 , т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2.
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2→ CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
Масса всего вещества 9,8 г.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
Видео:Решение задачи по химии на установление формулы органического вещества | Химия ЦТ, ЕГЭСкачать

Определение формул веществ по химическим свойствам.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2→ СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
| 0,005 | 0,01 | |
| СnH2n−2 | + 2Br2 → | СnH2n−2Br4 |
Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль .
Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH .
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:
Соответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:
Получим два уравнения, из которых найдём m и n:
Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH .
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:
Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1 .
Это аланин — аминопропановая кислота.
Видео:Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

Решение задач на определение формул органических веществ (подготовка к ЕГЭ по химии)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Решение задач на определение формулы органического вещества.
Разработала: Куст И.В. — учитель биологии и химии МБОУ Колюдовская СОШ
1.Определение формулы вещества по продуктам сгорания.
1.При полном сгорании углеводорода образовалось 27г воды и 33,6г углекислого газа (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу.
2.При сгорании 0,45г газообразного органического вещества выделилось 0,448л углекислого газа, 0,63г воды и 0,112л азота. Плотность исходного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
3.При сгорании бескислородного органического вещества образовалось 4,48л углекислого газа. 3,6 г воды, 3,65г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
4.При сгорании вторичного амина симметричного строения выделилось 0,896л углекислого газа и 0,99г воды и 0,112л азота. Установите молекулярную формулу этого амина.
1.Определим молекулярную массу углеводорода : M ( CxHy )= M (по газу)хД(газа)
2.Определим количество вещества воды: п ( Н2О)= т (Н2О) : М( Н2О)
3.Определим количество вещества водорода : п(Н)=2п(Н2О)
4. Определим количество вещества углекислого газа: : п ( СО2)= т (СО2) : М( СО2)или
п ( СО2)= V (СО2) : Vm
5.Определим количество вещества углерода: п ( С)= п ( СО2)
6.Определим соотношение С:Н = п ( С): п(Н)(оба числа делим на наименьшее из этих чисел)
7.простейшая формула (из пункта 6).
8.Молекулярную массу углеводорода (из первого пункта) делим на молекулярную массу простейшей формулы (из пункта 7) : полученное целое число означает – во столько раз надо увеличить число атомов углерода и водорода в простейшей формуле.
9.Определить молекулярную массу истинной формулы (найденной в пункте 8).
10.Записываем ответ – найденную формулу.
Решение задачи №1.
1. Определим молекулярную массу углеводорода: M ( CxHy )= M (по газу)хД(газа)
M ( CxHy )=1,05х40г/моль=42 г/моль
2. Определим количество вещества воды: п ( Н 2 О)= т (Н 2 О) : М( Н 2 О)
п ( Н 2 О)=27г : 18г/моль=1,5моль
3. Определим количество вещества водорода: п(Н)=2п(Н 2 О)
4. Определим количество вещества углекислого газа: п ( СО 2 )= V (СО 2 ) : Vm
п ( СО 2 )=33,6л : 22,4л/моль=1,5моль
5. Определим количество вещества углерода: п ( С)= п ( СО 2 )
6. Соотношение С:Н = п ( С): п(Н)=1,5моль:3моль=(1,5:1,5):(3:1,5)=1:2
7. Простейшая формула: СН 2
9. С 3 Н 6 – истинная (М(С 3 Н 6 )=36+6=42г/моль
10. Ответ: . С 3 Н 6 .
2.Определение формулы вещества, используя общую формулу и уравнения химической реакции.
5.При сгорании 1,8г первичного амина выделилось 0,448л азота. Определите молекулярную формулу этого амина.
6.При сгорании 0,9г некоторого предельного первичного амина выделилось 0,224г азота Определите молекулярную формулу этого амина.
7.При взаимодействии 22г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6л газа. Определите молекулярную формулу кислоты.
8.Установите молекулярную формулу алкена, если известно что 0,5г его способны присоединить 200мл водорода.
9.Установите молекулярную формулу алкена. Если известно, что 1,5г его способны присоединить 600мл хлороводорода.
10.Установите молекулярную формулу циклоалкана, если известно, что 3г его способны присоединить 1,2л бромоводорода.
1.Определим количество известного вещества (азота, углекислого газа, водорода, хлороводорода, бромоводорода) : п = т : М или п= V : Vm
2.По уравнению сравним количество вещества известного вещества с количеством вещества которое надо определить :
3.Определим молекулярную массу искомого вещества: М=т:п
4.Найдем молекулярную массу искомого вещества используя его общую формулу:(М(СпН 2п )=12п+2п=14п)
5.Приравняем значение пункта 3 и пункта 4.
6.Решим уравнение с одним неизвестным , найдем п.
7.Подставим в общую формулу значение п.
Решение задачи №5.
т(СпН 2п+1 NH 2 )=1,8г
Найти СпН 2п+1 NH 2 .
1.Схема реакции: 2 СпН 2п+1 NH 2 = N 2 (или)
2.Уравнение реакции: 2 СпН 2 п+ 1 NH 2 +(6п+3)/2О 2 =2пСО 2 + (2п+3)Н 2 О+ N 2
3.Определим количество вещества азота по формуле: п= V : Vm
п( N 2)= 0,448л:22,4л/моль=0,02моль
4.Определим количество вещества амина (используя уравнения: коэффициент стоящий перед амином делим на коэффициент стоящий перед азотом)
п(СпН 2 п+ 1 NH 2)= 2п( N 2) =2х0,02моль=0,04моль
5.Определим молярную массу амина по формуле: М=т:п
М((СпН 2 п+ 1 NH 2 )=1,8г:0,04моль=45 г/моль
6.Определаем молярную массу амина по общей формуле:
М(СпН 2 п+ 1 NH 2 )=12п+2п+1+14+2=14п+17г/моль
8.Подставляем в общую формулу: СпН 2 п+ 1 NH 2= С 2 Н 5 N Н 2
9.Ответ: С 2 Н 5 N Н 2
3.Определение формулы вещества используя уравнения химической реакции и закон сохранения массы веществ.
11.Некоторый сложный эфир массой 7,4г подвергнут щелочному гидролизу. При этом получено 9,8г калиевой соли предельной одноосновной карбоновой кислоты и 3,2г спирта. Установите молекулярную формулу этого эфира.
12.Сложный эфир массой 30г подвергнут щелочному гидролизу, при этом получено 34г натриевой соли предельной одноосновной кислоты и 16г спирта. Установите молекулярную формулу эфира.
1.Составим уравнение гидролиза.
2.По закону сохранения массы веществ (масса вступивших в реакцию веществ равна массе образовавшихся ) : масса эфира +масса гидроксида калия = масса соли + масса спирта .
3.Находим массу ( KOH ) = массу (соли) + массу (спирта) – массу (эфира)
4.Определим количество вещества KOH : n = m ( KOH ) : М( KOH ).
5.По уравнению n ( KOH ) = п (эфира)
6.Определим молярную массу эфира : M = m : n
7.По уравнению количество вещества KOH = количеству вещества соли ( n )= количеству вещества спирта ( n ).
8.Определим молекулярную массу соли: M = m (соли): n (соли).
9.Определим молекулярную массу соли по общей формуле и приравняем значения из пункта 8 и 9 .
10.От молекулярной массы эфира отнимем молекулярную массу функциональной группы кислоты найденной в предыдущем пункте без массы металла:
11. Определим функциональную группу спирта.
Найти формулу эфира
1.Составим уравнения гидролиза сложного эфира:
СпН 2п + 1 СООСмН 2 м+ 1 +КОН=СпН 2п + 1 СООК + СмН 2 м+ 1 ОН
2.Находим массу (КОН)= т(соли)+т(спирта)-т(эфира)=(9,8г+3,2г)-7,4г=5,6г
4.По уравнению :п(КОН)=п(соли)=п(спирта)=0,1моль
5.Определим молярную массу соли: М (СпН 2п + 1 СООК)=т:п=9,8г:0,1моль=98г/моль
6.Определим молярную массу по общей формуле:М (СпН 2п + 1 СООК)=12п+2п+1+12+32+39=14п+84 (г/моль)
Формула соли СН3СООК
8.Определим молярную массу спирта: М(СмН 2 м+ 1 ОН)=3,2г:0,01моль=32г/моль
9.Определим М(СмН 2 м+ 1 ОН)=12м+2м+1+16+1=14м+18 (г/моль)
Формула спирта:СН 3 ОН
11.Формула эфира: СН3СООСН 3 -метилацетат.
4. Определение формулы вещества используя уравнения реакции, записанное с помощью общей формулы класса органических соединений.
13.Определите молекулярную формулу алкена, если известно, что одно и тоже количество его, взаимодействуя с различными галогеноводородами образует, соответственно, или 5,23г хлорпроизводного, или 8,2г бромпроизводного.
14.При взаимодействии одного и того же количества алкена с различными галогенами образуется 11,3г дихлорпроизводного или 20,2г дибромпроизводного .Определите формулу алкена. Напишите его название и структурную формулу.
1.Записываем два уравнения реакций (формулу алкена в общем виде)
2.Находим молекулярные массы продуктов по общим формулам в уравнениях реакций (через п).
3.Находим количества вещества продуктов: n = m : M
4.Приравниваем найденные количества вещества и решаем уравнения. Найденное п подставляем в формулу.
Решение задачи №13.
т(СпН 2п+1 Cl )=5,23г
т (СпН 2п+1 Br )=8,2г
1.Составим уравнения реакций:
СпН 2 п+НС l = СпН 2п+1 Cl
СпН 2 п + НВ r = СпН 2п+1 Br
2.Определим М( СпН 2п+1 Cl )=12п+2п+1+35,5=14п+36,5(г/моль)
3.Определим п( СпН 2п+1 Cl )=т:М=5,23г:(14п+36,5)г/моль
4.Определим М( СпН 2п+1 Br )=12п+2п+1+80=14п+81(г/моль)
5.Определим п( СпН 2п+1 Br )=т:М=8,2г : (14п+81)г/моль
6.Приравниваем п( СпН 2п+1 Cl )= п( СпН 2п+1 Br )
5,23г:(14п+36,5)г/моль = 8,2г : (14п+81)г/моль (решаем уравнение)
7.Формула алкена: С 3 Н 6
5.Определение формулы вещества через введение переменной Х.
15.В результате сжигания 1,74г органического соединения получено 5,58г смеси углекислого газа и воды. Количества веществ углекислого газа и воды в этой меси оказалось равными. Определите молекулярную формулу органического соединения. Если относительная плотность его по кислороду равна 1,81.
16. В результате сжигания1,32г органического соединения получено 3,72г смеси углекислого газа и воды. Количества веществ углекислого газа и воды в этой меси оказалось равными. Определите молекулярную формулу органического соединения. Если относительная плотность его по азоту равна 1,5714.
Алгоритм решения задачи:
1.Определим молярную массу органического вещества: М(СхН y О z )=Д(по газу)хМ(газа)
2.Определим количество органического вещества: п (СхН y О z )=т:М
3.Введение переменной х:Пусть Х-количество углекислого газа в смеси: п(СО2)=Хмоль, тогда столько же и воды (по условию):п(Н2О)=Хмоль.
4.Масса углекислого газа в смеси:т(СО2)=п(СО2)хМ(СО2)=44Х(г)
5.Масса воды в смеси: п(Н2О)=п(Н2О)хМ(Н2О)=18Х(г)
6.По условию задачи:т(смеси)=т(Н2О)+т(СО2)=44Х+18Х (Решаем уравнение с одним неизвестным, находим Х-число молей СО2 и Н2О)
7.Определим количество вещества углерода (С):п(С)=п(СО2):п(СхН y О z )
8.Определим количество вещества водорода (Н): п(Н)=2хп(Н2О): п(СхН y О z )
9.Проверяем наличие кислорода в органическом соединении: М(О)=М(СхН y О z )-М(С)-М(Н)
10.Определяем количество вещества (число атомов) кислорода: п(О)=М(О):А r (О)
Решение задачи №15.
1.Определяем молекулярную массу органического вещества: М(СхН y О z )=1,82х32г/моль=58г/моль
2.Определяем количество органического вещества: п (СхН y О z )=т:М
п (СхН y О z )=1,74г:58г/моль=0,03моль
3.Пусть Х-п(СО2) в смеси, тогда п(Н2О)-Хмоль(по условию)
4..Масса углекислого газа в смеси: т(СО2)=п(СО2)хМ(СО2)=44Х(г)
5.Масса воды в смеси: п(Н2О)=п(Н2О)хМ(Н2О)=18Х(г)
6.Составим и решим уравнение:44Х+18Х=5,58(масса смеси по условию)
7.Определим количество вещества углерода (С ):п(С)=п(СО2):п(СхН y О z )
п(С)=0,09:0,03=3(моль)-число атомов С в органическом веществе.
8.Определим количество вещества водорода (Н): п(Н)=2хп(Н2О): п(СхН y О z )
п(Н)=2х0,09:0,03=6(моль)-число атомов водорода в органическом веществе
9.Проверяем наличие кислорода в органическом соединении: М(О)=М(СхН y О z )-М(С)-М(Н)
10.Определяем количество вещества (число атомов) кислорода: п(О)=М(О):А r (О)
п(О)=16:16=1(моль)-число атомов кислорода в органическом веществе.
11.Формула искомого вещества: (С3Н6О).
6. Определение формулы вещества по массовой доли одного из элементов, входящих в вещество.
17.Определите молекулярную формулу дибромалкана, содержащего 85,11% брома.
18.Определите строение сложного эфира аминокислоты, образованного производными предельных углеводородов, если известно, что он содержит 15,73% азота.
19.Определите молекулярную формулу предельного трехатомного спирта, массовая доля кислорода в котором равна 45,28%.
Алгоритм решения задачи.
1.Используя формулу нахождения массовой доли элемента в сложном веществе определяем молекулярную массу вещества: W (элемента)= Ar (элемента)хп(элемента):М r (вещества)
М r (вещества)=А r (элемента)хп(элемента): W (элемента), где п(элемента)-число атомов данного элемента
2.Определяем молекулярную массу по общей формуле
3.Приравниваем пункт 1 и пункт 2. Решаем уравнение с одним неизвестным.
4.Записываем формулу, подставив значение п в общую формулу.
Решение задачи №17.
Найти СпН 2 пВ r 2
1.Определяем молекулярную массу дибромалкана:
2 Определяем молекулярную массу по общей формуле: М r (СпН 2 пВ r 2 )=12п+2п+160=14п+160
3.Приравниваем и решаем уравнение: 14п+160=188
4.Формула: С 2 Н 4 В r 2
7.Определение формулы органического вещества, используя уравнения химических реакции, отражающие химические свойства данного вещества.
20.При межмолекулярной дегидратации спирта образуется 3,7г простого эфира. А при внутримолекулярной дегидратации этого спирта 2,24л этиленового углеводорода. Определите формулу спирта.
21.При внутримолекулярной дегидратации некоторого количества первичного спирта выделилось 4,48л алкена, а при межмолекулярной дегидратации образуется10,2г простого эфира. Какое строение имеет спирт.
Алгоритм решения задачи.
1.Записываем уравнения химических реакций , о которых говорится в задачи (обязательно уравниваем)
2.Определяем количество газообразного вещества по формуле: п= V : Vm
3.Определяем количество исходного вещества, затем количество вещества второго продукта реакции (по уравнению реакции и по условию задачи)
4.Определяем молярную массу второго продукта по формуле:М=т:п
5.Определяем молярную массу по общей формуле и приравниваем (п.4 и п.5)
6.Решаем уравнение и находим п- число атомов углерода.
Решение задачи №21.
Найти СпН 2п+1 ОН
1.Записываем уравнения реакций:
СпН 2п + 1 ОН=СпН 2п +Н 2 О
2СпН 2п + 1 ОН=СпН 2 п+ 1 ОСпН 2п+1 +Н2О
2.Определяем количество вещества алкена (газ): п= V : Vm
п(СпН 2п )=4,48л:22,4л/моль=0,2моль
3.По первому уравнению количество вещества алкена равно количеству вещества спирта. По второму уравнению количество вещества эфира в 2 раза меньше, чем количество вещества спирта т.е. п(СпН 2 п +1 ОСпН 2п+1 )=0,1моль
4.Определяем молярную массу эфира: М=т:п
5.Определяем молярную массу по общей формуле: М(СпН 2 п+ 1 ОСпН 2п+1 )=12п+2п+1+16+12п+2п+1=28п+18
6.Приравниваем и решаем уравнение: 28п+18=102
📹 Видео
Решение задач на определение молекулярной формулы органического вещества -три типаСкачать

ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ. ХИМИЯ ЕГЭСкачать

Поиск формулы вещества по продуктам его сгоранияСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Определение формулы органических соединений. 1 часть. Практическая часть - решение задачи. 9 класс.Скачать

Решение задач на вывод формул органических соединений | Химия 10 класс #8 | ИнфоурокСкачать

Вывод формулы органического вещества по уравнению химической реакцииСкачать

Задача на нахождение формулы органического вещества из реального ЕГЭ по химии 2019 года.Скачать

















