Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
ТЕМА: Решение задач по теме «Уравнение состояния идеального газа»
Учебная: Диагностика степени усвоения знаний по теме «Уравнение состояния идеального газа» и формирование практических умений по их применению .
Развивающая: Развивать интерес к физике, развивать практические умения учащихся при решении задач.
Воспитательная : воспитывать сознательное отношение к учебе и заинтересованность в изучении физики.
Тип урока: урок комплексного применения знаний
I. Организационно — мотивационный этап
1) Организация начала урока
2) Проверка домашнего задания
II. Организационно — мотивационный этап
3) Актуализация имеющихся знаний.
4) Закрепление знаний и способов действия
6) Первоначальная проверка понимания
III. Рефлексийна — заключальны этап
7) Подведение итогов занятия. Выставление оценок
8) Домашнее задание
I. Организационно — мотивационный этап
1) Организация начала урока
Приветствие учащихся и учителя. Проверить подготовленность учащихся к уроку, правильную организацию рабочего места. Отметить отсутствующих в журнале.
2) Проверка домашнего задания
Фронтальная проверка выполнения домашнего задания. Обсуждения результатов выполнения
II. Операционно — познавательный этап.
3) Актуализация имеющихся знаний.
А) Фронтальный опрос
— Перечислите макроскопические параметры состояния идеального газа ( Р,V,Т)
— Какое уравнение называют уравнением состояния? (Уравнение, выражающее связь между макроскопическими параметрами состояния вещества)
-В чем заключается основная задача МКТ? ( Установление связи между макроскопическими параметрами, т.е. нахождение уравнения состояния того или иного тела)
-Сформулировать и доказать закон Дальтона (Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов, p=p1 +…рn )
-Записать уравнение Клапейрона. При каких условиях оно справедливо? (PVT=P0V0\T0, m=const, M=const)
— Записать уравнение Менделеева — Клапейрона.
4) Закрепление знаний и способов действия
Задачи решаются на доске:
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
Дано: V = 20 л, р = 830 кПа, t = 17 ° C , М = 2·10-3 кг/моль, R = 8,31 Дж/(моль·К).
Решение 
Ответ: m = 1,38·10 -2 кг.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
Дано: V — const , р1 = 40 МПа, t 1 = 27 °С, t 2 = -33 °С, m 2 = 2/5 m 1
Решение
Ответ: р2 = 12,8 Па.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
6) Первоначальная проверка понимания
Задачи решаются самостоятельно учениками
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
Р е ш е н и е. Согласно уравнению Менделеева—Клапейрона 

2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?

III. Рефлексийно – заключительный этап
7) Подведение итогов занятия. Выставление оценок
8) Домашнее задание упр.3(5-7). Подготовится к проверочной работе
9) Рефлексия: Ребята высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске: Сегодня я узнал… Было интересно… Было трудно… Я понял, что…
Решение задач по теме «Уравнение состояния идеального газа»
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?
Решение задач по теме «Уравнение состояния идеального газа»
1. Определить массу водорода, находящегося в баллоне вместимостью 20 л при давлении 830 кПа, если температура газа равна 17 °С.
2 . Газ при давлении 0,2 МПа и температуре 15 0 С имеет объем 5 л. Чему будет равен объем этой массы газа при нормальных условиях?
3. В баллоне находится газ под давлением 40 Па и при температуре 27 °С. Когда из баллона выпустили 3/5 газа, содержавшегося в нем, его температура понизилась до -33 °С. Определить давление газа, оставшегося в сосуде.
4. При уменьшении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
1. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10 6 Па. Молярная масса кислорода М = 0,032 кг/моль.
2. Найти плотность водорода при температуре 15 0 С и давлении 9,8·10 4 Па. (0,085 кг/м 3 )
3. В баллоне находится газ при температуре 15 0 С. Во сколько раз уменьшится давление газа, если 40 % его выйдет из баллона, а температура при этом понизится на 8 0 С?
Видео:Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

Задача на применение уравнения состояния идеального газа с решением
Репетитор
по физике
Репетитор
по алгебре
( P ) — Давление газа (Паскали)
( nu ) — Количество вещества
( R ) — Универсальная газовая посиоянная
( T ) — Температура в Кельвинах
В баллоне находится газ под давлением (P= 8,31 cdot 10^6 ; Па ), температура газа (T=300 К ).
Количество вещества газа ( nu=100 Моль ).
Найти объем баллона
Универсальная газовая постоянная ( R=8,31 frac )
Дать ответ в литрах.
Показать ответ Показать решение Видеорешение
Запишем уравнение Менделеева-Клапейрона :
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Решение задач на уравнения состояния идеального газа.
Задача 1. При какой максимальной температуре взорвется баллон, содержащий 0,195 кг водорода, если он рассчитан на хранение 1 кг азота при температуре 293 К при десятикратном запасе прочности?
ДАНО: 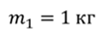 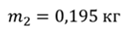 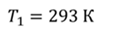 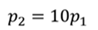 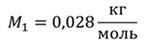 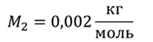 | РЕШЕНИЕ Запишем уравнение Менделеева — Клапейрона для каждого состояния газа в отдельности 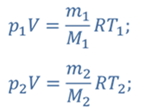 Выразим объём из первого уравнения Выразим объём из первого уравнения 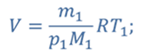 Подставим полученное выражение во второе уравнение Подставим полученное выражение во второе уравнение  Под максимальной температурой для водорода в баллоне будем понимать температуру, которой соответствует предельное давление газа, еще выдерживаемое баллоном; его превышение приводит к взрыву. Под максимальной температурой для водорода в баллоне будем понимать температуру, которой соответствует предельное давление газа, еще выдерживаемое баллоном; его превышение приводит к взрыву. 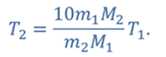 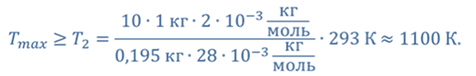 |
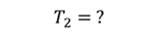 |
Ответ:баллон взорвется при температуре 1100 К.
Задача 2.В баллоне объемом 40 л находится кислород при температуре 27 о С и давлении 1 МПа. После того как из баллона выпустили 50 г кислорода, температура в баллоне понизилась до 17 о С. Определите установившееся давление.
ДАНО: 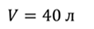 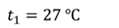 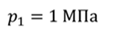 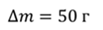 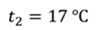 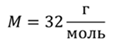 | СИ 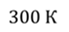 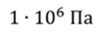 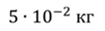 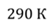 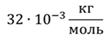 | РЕШЕНИЕ запишем выражения, для определения массы выпущенного из баллона кислорода, как разницу между первоначальной массой газа в баллоне и массой оставшегося газа 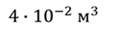 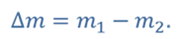 Применим уравнение Менделеева-Клапейрона к начальному и конечному состояниям кислорода в баллоне Применим уравнение Менделеева-Клапейрона к начальному и конечному состояниям кислорода в баллоне 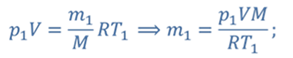 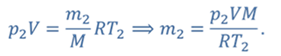 Тогда Тогда  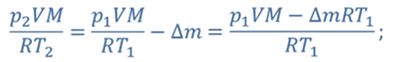  Проверим размерности Проверим размерности 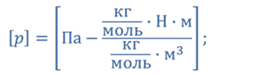 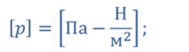  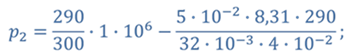  |
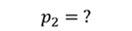 |
Задача 3.Велосипедный насос при каждом ходе поршня захватывает 4 ∙ 10 −5 м 3 воздуха. Сколько ходов должен совершить поршень, чтобы давление в велосипедной камере объемом 2 ∙ 10 −3 м 3 стало равным 1,53 ∙ 10 5 Па. Атмосферное давление 1,01 ∙ 10 5 Па. Нагреванием воздуха при сжатии в насосе пренебречь.
ДАНО: 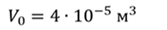 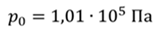 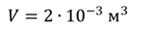 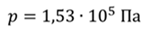 | РЕШЕНИЕ Запишем для этого состояния уравнение Менделеева-Клапейрона  где m0 – масса воздуха захватываемого насосом за один ход поршня. В накаченной камере содержится воздух массой m, параметры состояния которого p, V и T. Для него также должны запишем уравнение состояния где m0 – масса воздуха захватываемого насосом за один ход поршня. В накаченной камере содержится воздух массой m, параметры состояния которого p, V и T. Для него также должны запишем уравнение состояния 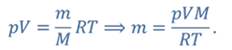 Масса накаченного воздуха Масса накаченного воздуха  Тогда число ходов поршня Тогда число ходов поршня 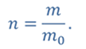 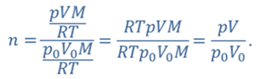 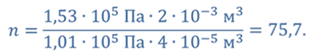 |
 |
Ответ: поршень должен совершить 76 ходов.
Задача 4.В цилиндре под поршнем находится газ при температуре 300 К. Вес поршня составляет 6 Н, а его площадь — 2 ∙ 10 −3 м 2 . С какой силой надо действовать на поршень, чтобы объем газа уменьшился вдвое, если при этом процессе температуру газа повысили до 400 К? Атмосферное давление 10 5 Па.
ДАНО: 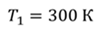 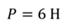 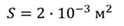 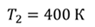 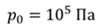 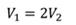 | РЕШЕНИЕ Исходя из условия задачи, масса газа под поршнем не изменяется. Поэтому основным уравнением, характеризующим данный процесс, служит объединенный газовый закон (уравнение Клапейрона) 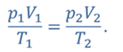 Поскольку газ в начальном состоянии находится в равновесии, то давление газа равно внешнему давлению, которое складывается из атмосферного давления воздуха и давления, оказываемого весом поршня Поскольку газ в начальном состоянии находится в равновесии, то давление газа равно внешнему давлению, которое складывается из атмосферного давления воздуха и давления, оказываемого весом поршня 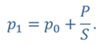 Аналогично выражаем давления газа в конечном состоянии, но уже с учетом дополнительного давления, создаваемого искомой силой Аналогично выражаем давления газа в конечном состоянии, но уже с учетом дополнительного давления, создаваемого искомой силой 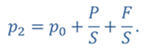 Тогда Тогда 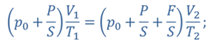 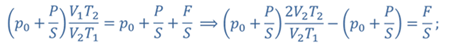 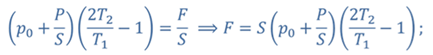 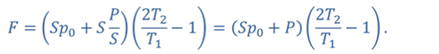 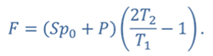 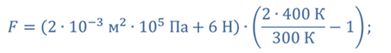 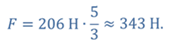 |
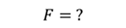 |
Ответ: к поршню следует приложить силу в 343 Н.
Задача 5.Цилиндрическая пробирка длиной l, содержащая воздух при температуре Т1, погружалась в воду до тех пор, пока закрытый конец пробирки не оказался на одном уровне с поверхностью воды. Когда температура воздуха в пробирке и воды уравнялась, оказалось, что вода в пробирке поднялась на высоту 2/3l. Определите температуру Т2 воды. Атмосферное давление воздуха р0.
🎥 Видео
Уравнение состояния идеального газа. 10 класс.Скачать

Физика, 11-й класс, Решение задач на применение уравнения состояния идеального газаСкачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Решение задач на основное уравнение МКТ идеального газа | Физика 10 класс #29 | ИнфоурокСкачать

Задача на применение основного уравнения идеального газаСкачать

ЕГЭ. Физика. Уравнение состояния идеального газа. ПрактикаСкачать

Решение графических задач на тему Газовые законыСкачать

Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Уравнение состояния идеального газаСкачать

10 класс, 4 урок, Уравнение состояния идеального газаСкачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

10 класс урок №39 Уравнение состояния идеального газаСкачать



