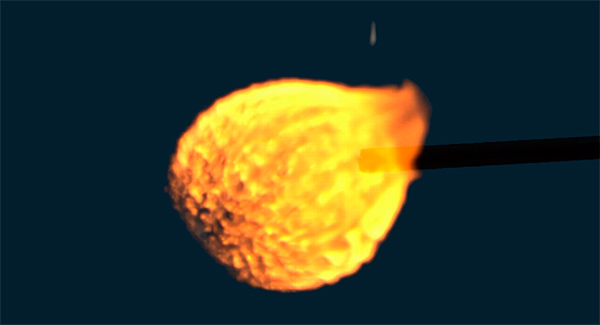
Смесь водорода и кислорода — взрывоопасна, это «гремучий газ».
Дело в том, что водород сгорает в кислороде с выделением большого количества теплоты:
Для начала реакции достаточно поднести к смеси горящую спичку. По уравнению реакции две молекулы водорода реагируют с одной молекулой кислорода, значит оптимальное соотношение водорода и кислорода — два к одному. В нашем опыте используется не чистый кислород, а воздух, в котором кислорода ‑ только пятая часть (21%). Поэтому «гремучее», наиболее взрывоопасное соотношение водород – воздух составляет два к пяти. Проверим это на практике. Приготовим несколько вариантов смеси водорода с воздухом.
Три пробирки заполнены водой на 1/3, 1/2 и 2/3 объема. Место воды займет водород. Остальной объем заполнен воздухом. Водород будет поступать по газоотводной трубке из колбы с соляной кислотой и цинком: Zn + 2 HCl = ZnCl 2 + H 2 ↑ .
Соотношение водород- воздух в первой пробирке составит 1:2, во второй 1:1, а в третьей 2:1. Гремучее соотношение водород-воздух 2:5, и в первой пробирке – почти такое же соотношение. Поэтому взрыв в первой пробирке получается самым сильным.
Скопления водорода – опасны, на производстве важно не допускать скопления водорода в гальванических цехах, где водород выделяется в больших объемах при нанесении защитных покрытий на металлы. Взрыв водорода грозит разрушением зданию.
Оборудование: штатив, пробирки, держатель для пробирок, стеклянный цилиндр с водой, пробирка с газоотводной трубкой, пинцет, лучина.
Техника безопасности . Следует соблюдать правила работы с горючими газами и правила работы с кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
- Температура горения водорода: описание и условия реакции, применение в технике
- Что такое водород?
- Химическая реакция горения
- Механизм процесса горения водорода
- Инициация реакции
- Процентное содержание газов в горючей смеси
- Безопасность горения
- Температура реакции горения
- Количество выделяемой теплоты
- Применение водородной горючей смеси в технике: проблемы
- Реакция взаимодействия водорода и кислорода
- 📸 Видео
Видео:Опыты по химии. Взрыв кислорода с водородомСкачать

Температура горения водорода: описание и условия реакции, применение в технике
Одной из актуальных проблем является загрязнение окружающей среды и ограниченность энергетических ресурсов органического происхождения. Многообещающим способом решения этих проблем является использование водорода в качестве источника энергии. В статье рассмотрим вопрос горения водорода, температуру и химию этого процесса.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Что такое водород?
Прежде чем рассматривать вопрос, какая температура сгорания водорода, необходимо вспомнить, что собой представляет это вещество.
Водород — это самый легкий химический элемент, состоящий всего из одного протона и одного электрона. При нормальных условиях (давление 1 атм., температура 0 o C) он присутствует в газообразном состоянии. Его молекула (H2) образована 2 атомами этого химического элемента. Водород является 3-м по распространенности элементом на нашей планете, и 1-м во Вселенной (около 90 % всей материи).
Водородный газ (H2) не имеет запаха, вкуса и цвета. Он не токсичен, однако, когда содержание его в атмосферном воздухе составляет несколько процентов, то человек может испытывать удушье, по причине недостатка кислорода.
Любопытно отметить, что хотя с химической точки зрения все молекула H2 идентичны, физические свойства их несколько отличаются. Дело все в ориентации спинов электронов (они ответственны за появление магнитного момента), которые могут быть параллельными и антипараллельными, такую молекулу называют орто- и параводородом, соответственно.
Видео:Реакция водорода с кислородомСкачать

Химическая реакция горения
Рассматривая вопрос, температуры горения водорода с кислородом, приведем химическую реакцию, которая описывает этот процесс: 2H2 + O2 => 2H2O. То есть в реакции участвуют 3 молекулы (две водорода и одна кислорода), а продуктом являются две молекулы воды. Эта реакция описывает горение с химической точки зрения, и по ней можно судить, что после ее прохождения остается только чистая вода, которая не загрязняет окружающую среду, как это происходит при сгорании органического топлива (бензина, спирта).
С другой стороны, эта реакция является экзотермической, то есть помимо воды она выделяет некоторое количества тепла, которое можно использовать для приведения в движение машин и ракет, а также для его перевода в другие источники энергии, например, в электричество.
Видео:Взаимодействие водорода с кислородом. Гремучая смесьСкачать

Механизм процесса горения водорода
Описанная в предыдущем пункте химическая реакция известна любому школьнику старших классов, однако она является очень грубым описанием того процесса, который происходит в действительности. Отметим, что до середины прошлого века человечество не знало, как происходит горение водорода в воздухе, а в 1956 году за ее изучение была присуждена Нобелевская премия по химии.
В действительности, если столкнуть молекулы O2 и H2, то никакой реакции не произойдет. Обе молекулы являются достаточно устойчивыми. Чтобы горение происходило, и образовывалась вода, необходимо существование свободных радикалов. В частности, атомов H, O и групп OH. Ниже приводится последовательность реакций, которые происходят в действительности при горении водорода:
Что видно из этих реакций? При горении водорода образуется вода, да, верно, но происходит это только, когда группа из двух атомов OH встречается с молекулой H2. Кроме того, все реакции происходят с образованием свободных радикалов, это означает, что запускается процесс самоподдержания горения.
Таким образом, ключевой момент в запуске этой реакции заключается в образовании радикалов. Они появляются, если поднести к кислород-водородной смеси горящую спичку, либо если нагреть эту смесь выше определенной температуры.
Видео:Галилео. Эксперимент. Взрыв водородаСкачать

Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 o C. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 o C.
Видео:Получение водорода и проверка его на чистотуСкачать

Процентное содержание газов в горючей смеси
Говоря о температуре горения водорода в воздухе, следует отметить, что не всякая смесь этих газов будет вступать в рассматриваемый процесс. Экспериментально установлено, что если количество кислорода меньше 6% по объему, либо если количество водорода меньше 4% по объему, то никакой реакции не будет. Тем не менее, пределы существования горючей смеси являются достаточно широкими. Для воздуха процентное содержание водорода может составлять от 4,1 % до 74,8 %. Отметим, что верхнее значение как раз соответствует необходимому минимуму по кислороду.
Если же рассматривается чистая кислород-водородная смесь, то здесь пределы еще шире: 4,1-94 %.
Уменьшение давления газов приводит к сокращению указанных пределов (нижняя граница поднимается, верхняя — опускается).
Также важно понимать, что в процессе горения водорода в воздухе (кислороде), возникающие продукты реакции (вода) приводят к уменьшению концентрации реагентов, что может привести к прекращению химического процесса.
Видео:Взаимодействие кислорода с водородомСкачать

Безопасность горения
Это важная характеристика воспламеняющейся смеси, поскольку она позволяет судить о том, происходит реакция спокойно, и можно ее контролировать, либо процесс имеет взрывной характер. От чего зависит скорость горения? Конечно же, от концентрации реагентов, от давления, а также от количества энергии «затравки».
К большому сожалению, водород в широком интервале концентраций способен к взрывному горению. В литературе приводятся следующие цифры: 18,5-59 % водорода в воздушной смеси. Причем на краях этого предела в результате детонации выделяется наибольшее количество энергии на единицу объема.
Отмеченный характер горения представляет большую проблему для использования этой реакции в качестве контролируемого источника энергии.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Температура реакции горения
Теперь мы подошли непосредственно к ответу на вопрос, какая низшая температура сгорания водорода. Она составляет 2321 К или 2048 o C для смеси с 19,6 % H2. То есть температура горения водорода в воздухе выше 2000 o C (для других концентраций она может достигать 2500 o C), и в сравнении с бензиновой смесью — это огромная цифра (для бензина около 800 o C). Если сжигать водород в чистом кислороде, то температура пламени будет еще выше (до 2800 o C).
Столь высокая температура пламени представляет еще одну проблему в использовании этой реакции в качестве источника энергии, поскольку не существует в настоящее время сплавов, которые могли бы работать длительное время в таких экстремальных условиях.
Конечно, эта проблема решается, если использовать хорошо продуманную систему охлаждения камеры, где происходит горение водорода.
Видео:Водород/химические свойства водорода/8 классСкачать

Количество выделяемой теплоты
В рамках вопроса температуры горения водорода любопытно также привести данные о количестве энергии, которая выделяется во время этой реакции. Для разных условий и составов горючей смеси получили значения от 119 МДж/кг до 141 МДж/кг. Чтобы понять, насколько это много, отметим, что аналогичное значение для бензиновой смеси составляет около 40 МДж/кг.
Энергетический выход водородной смеси намного выше, чем для бензина, что является огромным плюсом для ее применения в качестве топлива для двигателей внутреннего сгорания. Однако, и здесь не все так просто. Все дело в плотности водорода, она слишком низка при атмосферном давлении. Так, 1 м 3 этого газа весит всего 90 грамм. Если сжечь этот 1 м 3 H2, то выделится около 10-11 МДж теплоты, что уже в 4 раза меньше, чем при сжигании 1 кг бензина (чуть больше 1 литра).
Приведенные цифры говорят о том, что для использования реакции горения водорода необходимо научиться хранить этот газ в баллонах с высоким давлением, что создает уже дополнительные сложности, как в технологическом вопросе, так и с точки зрения безопасности.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Применение водородной горючей смеси в технике: проблемы
Сразу необходимо сказать, что в настоящее время водородная горючая смесь уже используется в некоторых сферах человеческой деятельности. Например, в качестве дополнительного топлива для космических ракет, в качестве источников для выработки электрической энергии, а также в экспериментальных моделях современных автомобилей. Однако масштабы этого применения являются мизерными, по сравнению с таковыми для органического топлива и, как правило, носят экспериментальных характер. Причиной этому являются не только трудности в контроле самой реакции горения, но также в хранении, транспортировке и добыче H2.
Водород на Земле практически не существует в чистом виде, поэтому его необходимо получать из различных соединений. Например, из воды. Это достаточно популярный способ в настоящее время, который осуществляется с помощью пропускания электрического тока через H2O. Вся проблема заключается в том, что при этом расходуется больше энергии, чем потом можно получить путем сжигания H2.
Еще одна важная проблема — транспортировка и хранение водорода. Дело в том, что этот газ, ввиду маленьких размеров его молекул, способен «вылетать» из любых контейнеров. Кроме того, попадая в металлическую решетку сплавов, он вызывает их охрупчивание. Поэтому наиболее эффективным способом хранения H2 является использование атомов углерода, способных прочно связывать «неуловимый» газ.
Таким образом, применение водорода в качестве топлива в более-менее широких масштабах возможно, только если его использовать в качестве «сохранения» электричества (например, переводить ветровую и солнечную энергию в водород с помощью электролиза воды), либо если научиться доставлять H2 из космоса (где его очень много) на Землю.
Видео:Уравнивание реакций горения углеводородовСкачать

Реакция взаимодействия водорода и кислорода
После написания статьи о получении кислорода в домашних условиях у одного из читателей возникли сомнения в том, что реакцию взаимодействия кислорода и водорода изучали в школе.
В комментариях я ответила ему, что это не так. Взаимодействие водорода с кислородом всегда изучали и продолжают изучать и по сей день, а также делают лабораторные и практические работы. Чтобы не быть голословной, привожу несколько отсканированных страниц школьных и университетских учебников разных лет издания.
В каждом скане вы можете увидеть реакцию, формулы, уравнения — то есть все, что положено для любого нормального учебника химии и любой химической реакции.
Учебник химии за 1966 год:
Вот страница из него по соответствующей теме:
Учебник химии за 8 класс под редакцией Наиля Сибгатовича Ахметова, по университетским учебникам которого выучилось не одно поколение студентов (и я в том числе):
Это — соответствующее уравнение:
Учебник авторов Г.Е. Рудзитиса и Ф.Г. Фельдмана, по которым школьники начали заниматься в конце 80-х (могу ошибаться, говорю приблизительно) и занимались, наверное, до начала двухтысячных (тоже приблизительно). Я сама в 1991—1995 годах занималась по учебникам их авторства. А позже, в 1999—2001 преподавала в школе по этим учебникам.
Соответствующая тема из этого учебника:
Вот страница моей школьной тетради за 1991 год:
А это — соответствующая лабораторная работа:
Для примера приведу и университетский учебник за 1978 год под редакцией Н.Л. Глинки. Тоже классическая книга для химиков:
А это — глава из него, посвященная водороду:
Думаю, теперь ни у кого не будет сомнений, что в школе всегда изучали и продолжают изучать эту интересную химическую реакцию?
Удачи всем в изучении химии!
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
📸 Видео
БАХ! Эпичный взрыв гремучего газа. Химия – ПростоСкачать

Взрыв смеси метана с кислородомСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Галилео. Эксперимент. Разложение перекиси водородаСкачать

Взрыв 10 литровой канистры с водородомСкачать

Опыты по химии. Каталитическое разложение пероксида водородаСкачать

🔥 4 ЭКСПЕРИМЕНТА С ВОДОРОДОМСкачать

Водород + кислород = сверхзвуковая реакция (научный эксперимент)Скачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать