- AlCl3 + NH3 + H2O = ? уравнение реакции
- Как протекают различные химические процессы
- Уравнения реакций хлорида алюминия с аммиаком и щелочью
- Расчет энергии Гиббса
- Определение массы электрода гальванического элемента
- Опыты по химии. Алюминий
- Алюминий. Химия алюминия и его соединений
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Как протекают различные химические процессы
- Уравнения реакций хлорида алюминия с аммиаком и щелочью
- Расчет энергии Гиббса
- Определение массы электрода гальванического элемента
- Гидроксид алюминия: получение и свойства
- Гидроксид алюминия
- Способы получения
- Химические свойства
- 📸 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

AlCl3 + NH3 + H2O = ? уравнение реакции
Подскажите, какое вещество образуется в результате взаимодействия хлорида алюминия с водным раствором аммиака (AlCl3 + NH3 + H2O= ?). Приведите основные физические параметры твердого продукта реакции, расскажите о химических свойствах и его способах получения.
В результате взаимодействия хлорида алюминия с водным раствором аммиака (AlCl3 + NH3 + H2O= ?) наблюдается выпадение студенистого осадка белого цвета – гидроксида алюминия, также происходит образование средней соли – хлорида аммония. Молекулярное уравнение реакции имеет вид:
Гидроксид алюминия представляет собой термически неустойчивый порошок белого цвета. Не растворяется в воде. Он существует в виде четырех полиморфных модификаций, каждую из которых можно выделить при конкретной температуре.
Гидроксид алюминия может быть получен обработкой солей алюминия щелочами.
В этом случае необходимо избегать избытка щелочи, в которой гидроксид алюминия растворяется:
При слабом подкислении тетрагидроксоалюмината разрушаются:
Гидроксид алюминия – типичный амфотерный гидроксид. С кислотами он образует соли, содержащие катион алюминия, со щелочами – алюминаты; при взаимодействии с водными растворами щелочей образуются гидроксоалюминаты:
При нагревании гидроксид алюминия разлагается.

Видео:ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

Как протекают различные химические процессы
Видео:Практическая работа №4 Получение аммиака и изучение его свойствСкачать

Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: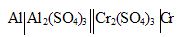
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Видео:Аммиак и соли аммония. 11 класс.Скачать

Опыты по химии. Алюминий
Амфотерные свойства гидроксида алюминия
Получим гидроксид алюминия Al(OH)3, чтобы исследовать его свойства. Для этого раствор хлорида алюминия соединяем с раствором аммиака. Выпадает осадок гидроксида алюминия.
Al 3+ + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4 +
Убедимся в том, что гидроксид алюминия ‑ амфотерное основание. В одну из пробирок добавим раствор щелочи. Осадок гидроксида растворяется.
Al(OH)3 + NaOH = Na[Al(OH)4]
Во вторую пробирку добавляем раствор соляной кислоты. Осадок гидроксида алюминия растворяется, как и в предыдущей пробирке.
Al(OH)3 +3HCl = AlCl3 + 3H2O
Гидроксиды, которые реагируют с растворами и кислот, и щелочей, называются амфотерными. Гидроксид алюминия – типичный амфотерный гидроксид»».
Оборудование: пробирки, штатив для пробирок, пипетка.
Техника безопасности.
Требуется соблюдение правил обращения со щелочами, кислотами и аммиаком. При попадании раствора щелочи на кожу, промыть водой и 2% раствором уксусной кислоты. При попадании раствора кислоты на кожу, промыть водой и 2% раствором питьевой соды.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия с водой
Алюминий — активный металл, но из-за прочной оксидной пленки на его поверхности не окисляется и не реагирует при обычных условиях с водой. Но если убрать с поверхности оксидную пленку, алюминий будет активно взаимодействовать с водой. Кусочки алюминия помещаем в раствор хлорида ртути (II) и выдерживаем 1-2 минуты.
3HgCI2 + 2Al = 2AICI3 + 3Hg
На поверхности алюминия образуется амальгама – сплав ртути с алюминием. Амальгама не удерживается на поверхности металла, обнажая его. Сливаем раствор соли ртути с амальгамированного алюминия и наливаем в стакан воду. Алюминий, лишившись защитной пленки, взаимодействует с водой, в процессе реакции образуются водород и гидроксид алюминия:
2Al + 6H2O = 2Al(OH)3 + 3H2
Оборудование: стаканы химические, палочка стеклянная.
Техника безопасности. Соблюдать особую осторожность при работе с раствором хлорида ртути (II). Не допускать попадания раствора на кожу. Все остатки соединений ртути обезвредить.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия с кислородом воздуха
Если нарушить оксидную пленку, то алюминий быстро окисляется, покрываясь рыхлым слоем оксида.
4Al + 3O2 = 2Al2O3
Оксид ртути разрушает оксидную пленку на алюминии. Алюминиевую пластинку натрем порошком оксида ртути. Оксид ртути ядовитый порошок. Поэтому используем резиновые перчатки. Через некоторые время наблюдаем, как поверхность алюминия покрывается белым рыхлым налетом оксида.
Оборудование: алюминиевая пластинка, вата, перчатки резиновые.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Работать только в резиновых перчатках.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие алюминия со щелочью и водой
Алюминий ‑ активный металл, однако из-за прочной оксидной пленки его активность мало заметна. Алюминий не реагирует с водой, на поверхности металла – плотная пленка оксида. Пленку оксида можно удалить щелочью. Когда пленка растворяется, металл начинает бурно реагировать со щелочью, выделяется водород.
2Al + 2KOH + 6H2O = 2 K[Al(OH)4] + 3H2↑
Проверим, будет ли действовать вода на освобожденный от оксидной пленки алюминий. Удалим щелочь и промоем поверхность металла. Свободный от оксидной пленки алюминий реагирует с водой. Выделяется водород и образуется нерастворимый гидроксид алюминия.
2Al + 6H2O = 2 Al(OH)3 ↓ + 3H2↑
Мы увидели, что если нарушить плотную естественную оксидную пленку алюминия, он легко разрушается даже в воде. Поэтому алюминиевую посуду не рекомендуется чистить средствами, содержащими щелочь, так как при этом алюминиевые изделия быстро теряют привлекательность, а в посуде из алюминия быстро образуются дырки.
Оборудование: химические стаканы.
Техника безопасности. Требуется соблюдение правил обращения со щелочами и горючими газами. При попадании раствора щелочи на кожу, промыть водой и 2% раствором уксусной кислоты.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Горение алюминия на воздухе.
Алюминий — активный металл, но из-за очень прочной оксидной пленки на его поверхности не реагирует при обычных условиях с водой и не окисляется. Однако если алюминий перевести в раздробленное состояние — алюминиевую пыль, то он легко сгорает на воздухе. Поместим в пробирку немного алюминиевой пыли и закроем ее пробкой с двумя трубками, одна из которых доходит почти до дна, а другая заканчивается недалеко от пробки. По длинной трубке подадим в пробирку ток воздуха. Струю воздуха, выходящую из короткой трубки и содержащую частички алюминия, направим в пламя горелки. Попадая в пламя, алюминий сгорает яркими вспышками.
4Al + 3O2 = 2Al2O3
Оборудование: штатив, пробирка с боковым отростком, газоотводная трубка, горелка, штапель.
Техника безопасности. Соблюдать правила пожарной безопасности и правила работы с нагревательными приборами. Не направлять пламя в сторону находящихся рядом людей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Демонстрация оксидной пленки алюминия
На поверхности алюминий покрыт тонкой и прочной пленкой оксида. Оксидная пленка предотвращает дальнейшее окисление алюминия. Для демонстрации оксидной пленки закрепим алюминиевую проволоку в лапке штатива. Нагреем алюминий. При температуре 660 °С алюминий плавится и кончик проволоки провисает. Но расплавленный металл не капает. «Мешочек» оксида удерживает расплавленный алюминий. Температура плавления оксида алюминия 2055 °С.
Оборудование: штатив, горелка, пинцет или тигельные щипцы.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Во избежание попадания расплавленного алюминия на поверхность стола, на рабочую поверхность помещают теплоизолирующую прокладку.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Обнаружение ионов алюминия
Ионы алюминия можно обнаружить при помощи раствора аммиака. К раствору хлорида алюминия добавляем раствор аммиака. Выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4Cl
Al 3+ + 3 NH3 · H2O = Al(OH)3 ↓ + 3 NH4 +
Реакция с аммиаком ‑ качественная реакция на ион алюминия.
Оборудование: пробирка, штатив для пробирок, пипетка.
Техника безопасности.
Требуется соблюдение правил обращения с раствором аммиака. Не вдыхать газообразный аммиак.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Видео:Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Видео:Реакции ионного обмена. 9 класс.Скачать

Как протекают различные химические процессы
Видео:Аммиак. Соли аммонияСкачать

Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: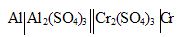
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Видео:Гидролизуем ХЛОРИД АЛЮМИНИЯСкачать

Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
📸 Видео
Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Реакции ионного обмена. 9 класс.Скачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Взаимодействие растворов аммиака с кислотамиСкачать

Аммиак и соли аммония. Видеоурок 29-30. Химия 9 классСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Реакции ионного обмена за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

75. Ионные реакции в растворах электролитовСкачать

Лабораторная работа №5. КомплексообразованиеСкачать

Аммиак, химические свойства аммиака. NH3 + HCl → NH4Cl и FeCl3 + 3NH3 + 3H2O → Fe(OH)3 + 3NH4ClСкачать




















