Цезий Cs — это щелочной металл. Белый, мягкий, весьма легкоплавкий. Чрезвычайно реакционноспособный, сильнейший восстановитель.
Относительная молекулярная масса Mr = 132,905; относительная плотность для твердого состояния d = 1,873; относительная плотность для жидкого состояния d = 1,841; tпл = 28,7º C; tкип = 667,6º C
- Способ получения
- Качественная реакция
- Химические свойства
- Взаимодействие цезия с водой уравнение реакции
- Цезий
- Содержание
- История
- Нахождение в природе. Добыча
- Геохимия и минералогия
- Получение
- Изотопы
- Физические свойства
- Химические свойства
- Применение
- Фотоэлементы, фотоумножители
- Детекторы ионизирующего излучения
- Оптика
- Источники света
- Катализаторы
- Химические источники тока
- Радиационная техника
- Медицина
- Применение цезия в энергетике
- Прочие области применения цезия
- Биологическая роль
- Цезий в живых организмах
- 🔥 Видео
Видео:Реакция цезия с водойСкачать

Способ получения
1. В результате электролиза жидкого гидроксида цезия образуются цезий, кислород и вода :
4CsOH → 4Cs + O2↑ + 2H2O
2. В результате разложения оксида цезия при 300 — 500º С получается пероксид цезия и цезий:
3. Хлорид цезия подвергают электролизу в воде , в результате чего на выходе образуется гидроксид цезия, хлор и водород:
2CsCl + 2H2O = H2↑ + Cl2↑ + 2CsOH
Видео:Цезий - самый активный металл на Земле!Скачать

Качественная реакция
Качественная реакция на цезий — окрашивание пламени горелки в синий цвет.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Химические свойства
1. Цезий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Цезий легко реагирует с водородом при 300–350º C и повышенным давлением с образованием гидрида цезия:
2Cs + H2 = 2CsH
1.2. Цезий сгорает в кислороде (воздухе) с образованием надпероксида цезия:
а если сгоранием происходит в холодной среде, то образуется оксид цезия:
1.3. Цезий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид цезия, хлорид цезия, бромид цезия, йодид цезия :
2Cs + F2 = 2CsF
2Cs + Cl2 = 2CsCl
2Cs + Br2 = 2CsBr
2Cs + I2 = 2CsI
1.4. С серой цезий реагирует при температуре 100–130º C с образованием сульфида цезия:
2Cs + S = Cs2S
2. Цезий активно взаимодействует со сложными веществами:
2.1. Цезий реагирует с водой . Взаимодействие цезия с водой приводит к образованию гидроксида цезия и газа водорода:
2Cs 0 + 2 H2 O = 2 Cs + OH + H2 0
2.2. Цезий взаимодействует с кислотами:
2.2.1. Цезий реагирует с разбавленной соляной кислотой, при этом образуются хлорид цезия и водород :
2Cs + 2HCl = 2CsCl + H2 ↑
2.2.2. При взаимодействии с разбавленной и холодной с ерной кислотой образуется сульфат цезия, и смесь продуктов восстановления серной кислоты — оксид серы (IV), осадок сера и вода.
2.2.3. Реагируя с разбавленной и холодной азотной кислотой Цезий образует нитрат цезия, и смесь продуктов восстановления азота — газ оксид азота (II), газ оксид азота (I) или азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и цезия в бензоле образуется осадок гидросульфид цезия и газ водород:
2Cs + 2H2S = 2CsHS↓ + H2↑
2.3. Цезий может взаимодействовать с основаниями:
2.3.1. Цезий взаимодействует с гидроксидом цезия при температуре 300-350º С, при этом образуется оксид цезия и водород:
2Cs + 2CsOH = 2Cs2O + H2
2.4. Цезий вступает в реакцию с газом аммиаком при 30-45º С. В результате данной реакции образуется амид цезия и водород:
2.5. Цезий может вступать в реакцию с оксидами :
2.5.1. В результате взаимодействия цезия и оксида кремния при температуре выше 300º С образуется силикат цезия и кремний:
Видео:Взаимодействие щелочных металлов с водойСкачать

Взаимодействие цезия с водой уравнение реакции
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
РЕАКЦИИ ЗАМЕЩЕНИЯ
1. Напишите уравнения реакций взаимодействия цезия и кальция с водой, если при этом образуются водород и соответствующий гидроксид.
Ответ: 2Cs + 2H2O = 2CsOH + H2; Ca + 2H2O = Ca(OH)2 + H2.
2. На лабораторном столе стояли 3 пробирки с разбавленной серной кислотой и 3 пробирки с раствором нитрата кобальта (II). В первые три пробирки поместили металлы Ca, Hg и Al. В оставшиеся три пробирки поместили металлы Pb, Al и Cr. Что наблюдается в каждой из пробирок? Напишите уравнения возможных реакций.
Ответ:
В пробирках с серной кислотой:
Ca + H2SO4 = CaSO4 + H2, кальций растворяется, выделяется бесцветный газ;
в пробирке с Hg изменений нет;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2, алюминий растворяется, выделяется бесцветный газ.
В пробирке с раствором нитрата кобальта (II):
в пробирке с Pb изменений нет;
2Al + 3Co(NO3)2 = 2Al(NO3)3 + 3Co, алюминий растворяется, на поверхности алюминия появляется налет кобальта, раствор обесцвечивается;
2Cr + 3Co(NO3)2 = 2Cr(NO3)3 + 3Co, хром растворяется, на поверхности хрома появляется налет кобальта, раствор изменяет окраску.
3. Определите объем водорода (н.у.), который выделится в результате взаимодействия алюминия с 365 г 15%-ного раствора соляной кислоты.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Цезий
| Цезий | |
|---|---|
| Очень мягкий, вязкий серебристо-жёлтый металл | |
 |
(молярная масса)
(первый электрон)
28,44 °C
Цезий (химический символ — Cs; лат. Caesium ) — элемент главной подгруппы первой группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер — 55. Простое вещество цезий — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой).
Видео:Химия | Молекулярные и ионные уравненияСкачать

Содержание
- 1 История
- 2 Нахождение в природе. Добыча
- 3 Геохимия и минералогия
- 4 Получение
- 5 Изотопы
- 6 Физические свойства
- 7 Химические свойства
- 8 Применение
- 8.1 Фотоэлементы, фотоумножители
- 8.2 Детекторы ионизирующего излучения
- 8.3 Оптика
- 8.4 Источники света
- 8.5 Катализаторы
- 8.6 Химические источники тока
- 8.7 Радиационная техника
- 8.8 Медицина
- 8.9 Применение цезия в энергетике
- 8.10 Прочие области применения цезия
- 9 Биологическая роль
- 9.1 Цезий в живых организмах
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

История
Цезий открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Нахождение в природе. Добыча
Основным цезиевым минералом является поллуцит. В виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. Также содержится в редком минерале авогадрите. В качестве промышленного сырья используются поллуцит и лепидолит.
Подтверждённые мировые запасы цезия на начало 2012 года оцениваются в 70 000 тонн .
По добыче цезиевой руды (поллуцита) лидирует Канада — в месторождении Танко (юго-восточная Манитоба, северо-западный берег озера Берник-Лейк) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России месторождения поллуцита есть на Кольском полуострове, в Восточном Саяне и Забайкалье. Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о. Эльба), но они обладают малыми запасами и не имеют важного экономического значения.
Мировая добыча обогащённой руды цезия составляет около 20 тонн в год. Мировой объём производства металлического (чистого) цезия — около 9 тонн в год.
Некоторые источники утверждают, что потребности в цезии более чем в 8,5 раза превышают его добычу, что положение в металлургии цезия ещё более тревожное, чем, например, в металлургии тантала или рения, и производители не могут обеспечить постоянно растущий спрос на металлический цезий.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Геохимия и минералогия
Среднее содержание цезия в земной коре — 3,7 г/т . Наблюдается некоторое увеличение содержания цезия от ультраосновных пород ( 0,1 г/т ) к кислым ( 5 г/т ). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах цезия (поллуците и др.). Постоянно повышенные количества цезия наблюдаются в морганите (1—4 %), родиците (около 5 %), авогадрите и лепидолите (0,85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0,01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0,4 %, что примерно в 40 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещённых микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связаны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Максимальное содержание цезия составляет лишь 15 г/т . Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощённого основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует «пассивно», в глинистых частичках речных вод. В морской воде концентрация цезия составляет около 0,5 мкг/л . Из числа собственно цезиевых минералов наиболее распространены поллуцит (Cs, Na)[AlSi2O6]· n H2O (22—36 % Cs2O), цезиевый берилл (пеццоттаит) Be2CsAl2(Si6O18) и авогадрит (KCs)BF4. Последние два минерала содержат до 7,5 % окиси цезия. Из других цезиевых минералов известны также галхаит (Cs,Tl)(Hg,Cu,Zn)6(As,Sb)4S12 и маргаритасит (Cs,K,H3O)2(UO2)2V2O8·H2O.
Видео:Задание 21 – решаем на максимум | Химия ОГЭ 2023Скачать

Получение
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2·12H2O.
Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода, азота, кислорода и многократная ступенчатая кристаллизация.
Сложности получения цезия обусловливают постоянный поиск его минералов: извлечение этого металла из руд неполное, в процессе эксплуатации материала он рассеивается и потому безвозвратно теряется, Промышленность нуждается именно в очень чистом материале (на уровне 99,9—99,999 %), и это является одной из труднейших задач в металлургии редких элементов.
В России переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов».
Существует несколько лабораторных методов получения цезия. Он может быть получен:
- нагревом в вакууме смеси хромата или дихромата цезия с цирконием;
- разложением азида цезия в вакууме;
- нагревом смеси хлорида цезия и специально подготовленного кальция.
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Видео:20 г цезия в воде В этой реакции образуется водород и гидроксид цезияСкачать

Изотопы
Известны изотопы цезия с массовыми числами от 112 до 151 (количество протонов 55, нейтронов от 57 до 96), и 22 ядерных изомеров. Природный цезий — моноизотопный элемент, состоящий из единственного стабильного изотопа 133 Cs.
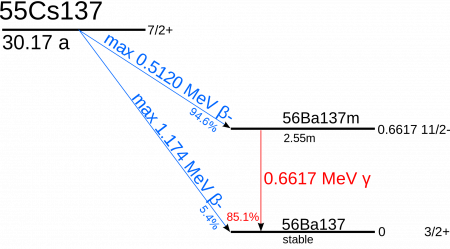
Самым долгоживущим искусственным радиоактивным нуклидом цезия является 135 Cs с периодом полураспада T 1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137 Cs ( T 1/2 = 30,17 года ).
Цезий-137 является одним из виновников радиоактивного загрязнения биосферы, так как образуется при делении ядер в ядерных реакторах и при испытаниях ядерного оружия. Цезий-137 претерпевает бета-распад, дочерний изотоп стабильный барий-137.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Физические свойства
Цезий — мягкий металл, из-за низкой температуры плавления ( T пл = 28,6 °C ) при комнатной температуре находится в полужидком состоянии. Твёрдость цезия по шкале Мооса составляет 0,2.
Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее. Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо отражает свет. Пары цезия окрашены в зеленовато-синий цвет.
Цезий образует кристаллы кубической сингонии (объёмно-центрированная решётка), пространственная группа Im3m, параметры ячейки a = 0,6141 нм , Z = 2 . При высоком давлении может переходить в другие полиморфные модификации. Цезий — парамагнетик.
Цезий растворяется в жидком аммиаке (тёмно-синие растворы) и расплавленном CsOH.
Цезий образует легкоплавкие сплавы с другими щелочными металлами. Его сплав с калием и натрием имеет температуру плавления −78 °С.
Видео:Полный разбор варианта ОГЭ | Химия 2023 | УмскулСкачать

Химические свойства
Цезий является наиболее химически активным металлом, за исключением радиоактивного франция, практически отсутствующего в природе. Является сильнейшим восстановителем. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O. Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Реагирует с бензолом. Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции).
Многие образуемые цезием соли — нитраты, хлориды, бромиды, фториды, йодиды, хроматы, манганаты, азиды, цианиды, карбонаты и т. д. — чрезвычайно легко растворимы в воде и ряде органических растворителей; наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и некоторые его сплавы.
Цезий весьма активен и агрессивен по отношению к контейнерным материалам и требует хранения, например, в сосудах из специального стекла в атмосфере аргона или водорода (обычные марки лабораторного стекла цезий разрушает).
Цезий способен присоединяться к этилену с образованием дицезиоэтилена CsCH2CH2Cs.
Видео:Щелочные металлы - САМЫЕ ОПАСНЫЕ и Активные Элементы!Скачать

Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной, до коротковолновой ультрафиолетовой области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых.
Детекторы ионизирующего излучения
Иодид цезия в виде монокристаллов (обычно активированный небольшой примесью таллия) является одним из наиболее распространённых сцинтилляторов — веществ, конвертирующих энергию ионизирующего излучения в свет. Это связано с высокой эффективностью поглощения гамма-квантов из-за большого атомного номера обоих основных составляющих йодида цезия, а также с высоким световыходом этого сцинтиллятора. Детекторы заряженных частиц и гамма-излучения на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так, например, измерения элементного состава поверхности Марса выполнялись с помощью гамма-спектрометра на основе CsI(Tl), установленного на космическом орбитальном аппарате «Марс-5». Недостатком этого сцинтиллятора является некоторая гигроскопичность, из-за которой он может длительно использоваться без герметичной оболочки лишь в достаточно сухом воздухе. Впрочем, его гигроскопичность на порядки ниже, чем у другого распространённого сцинтиллятора — йодида натрия.
Оптика
Иодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применение цезия как промотора при каталитическом получении аммиака, синтезе бутадиена. В ряде катализаторов оказалось эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга), в частности, используется рутений-цезий-углеродный катализатор. Цезий промотирует действие серебряного катализатора и повышает его селективность при эпоксидировании этилена.
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём (алюминат цезия).
Радиационная техника
Гамма-излучение цезия-137 используется в гамма-дефектоскопии, измерительной технике и при стерилизации пищевых продуктов (консервы, туши птиц и животных, мяса), а также для стерилизации медицинских препаратов и лекарств, в радиотерапии для лечения злокачественных опухолей. Также цезий-137 используется в производстве радиоизотопных источников тока, где он применяется в виде хлорида цезия (плотность 3,9 г/см³ , энерговыделение около 1,27 Вт/см³ ). Цезий-137 используется в датчиках предельных уровней сыпучих веществ в непрозрачных бункерах.
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении. Его соли, подобно препаратам лития, способны проявлять нормотимический эффект.
Применение цезия в энергетике
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %.
Ввиду того, что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 % и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C среди сплавов.
Прочие области применения цезия
Фторид цезия применяют для пьезоэлектрической керамики, специальных стёкол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена. Атомные переходы в пара́х цезия используются как эталон частоты в атомных часах.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Биологическая роль
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.
Цезий в живых организмах
Цезий в живых организмах — постоянный химический микроэлемент организма растений и животных. Морские водоросли, например, содержат от 0,01-0,1 мкг цезия в 1 г сухого вещества, наземные растения — 0,05—0,2 мкг/г . Животные получают цезий с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г цезия, пресмыкающихся — 0,04 мкг/г , млекопитающих — 0,05 мкг/г . Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л . Цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Цезий-137 — радиоактивный изотоп цезия, испускающий бета-излучение и гамма-кванты, и один из главных компонентов техногенного радиоактивного загрязнения биосферы. Продукт деления урана-235, урана-238, плутония-239 и других делящихся изотопов. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы атомных электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых (маслята, моховики, свинушка, горькушка, польский гриб) считается «аккумуляторами» радиоцезия.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
Литий
Li
Атомный номер: 3
Атомная масса: 6,941
Темп. плавления: 453,85 К
Темп. кипения: 1615 К
Плотность: 0,534 г/см³
Электроотрицательность: 0,98
Натрий
Na
Атомный номер: 11
Атомная масса: 22,98976928
Темп. плавления: 371,15 К
Темп. кипения: 1156 К
Плотность: 0,97 г/см³
Электроотрицательность: 0,96
Калий
K
Атомный номер: 19
Атомная масса: 39,0983
Темп. плавления: 336,58 К
Темп. кипения: 1032 К
Плотность: 0,86 г/см³
Электроотрицательность: 0,82
Рубидий
Rb
Атомный номер: 37
Атомная масса: 85,4678
Темп. плавления: 312,79 К
Темп. кипения: 961 К
Плотность: 1,53 г/см³
Электроотрицательность: 0,82
Цезий
Cs
Атомный номер: 55
Атомная масса: 132,9054519
Темп. плавления: 301,59 К
Темп. кипения: 944 К
Плотность: 1,93 г/см³
Электроотрицательность: 0,79
Франций
Fr
Атомный номер: 87
Атомная масса: (223)
Темп. плавления:
300 К
Темп. кипения:
950 К
Плотность: 1,87 г/см³
Электроотрицательность: 0,7
🔥 Видео
Основания. 8 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Физические и химические свойства водыСкачать