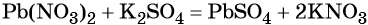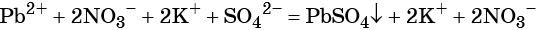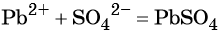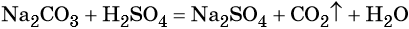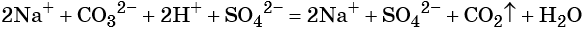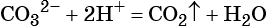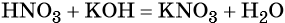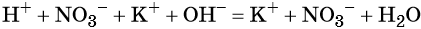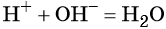Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
- Правила составления уравнений реакций ионного обмена
- Реакции ионного обмена и условия их осуществления
- Тренировочные задания
- Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
- Зачем нужны ионные уравнения
- Алгоритм написания ионных уравнений
- Как составить молекулярное уравнение реакции
- Как превратить молекулярное уравнение в полное ионное уравнение
- В виде ионов записывают:
- В виде молекул записывают:
- 📹 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Видео:Химия | Молекулярные и ионные уравненияСкачать

Реакции ионного обмена и условия их осуществления
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращённой ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой). При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
- Записывают в левой части уравнения все формулы веществ, вступивших в реакцию, в молекулярной или ионной форме.
- Руководствуясь знаниями физико-химических свойств реагентов и таблицами растворимости веществ, составляют формулы продуктов реакции.
- Проверяют число атомов каждого элемента в обеих частях уравнения и определяют необходимые стехиометрические коэффициенты перед формулами.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциированные соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращённой ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Пример 3. Реакция между азотной кислотой и едким калием. В результате данной реакции образуется малодиссоциированное соединение — вода и в растворе остаются катионы калия и нитрат-ионы:
(полная ионно-молекулярная форма),
(сокращённая ионно-молекулярная форма).
Видео:Реакции ионного обмена. 9 класс.Скачать

Тренировочные задания
1. Осадок образуется при взаимодействии водных растворов
2. Газ выделяется при взаимодействии водных растворов
3. Краткое ионное уравнение H + + OH – = H2O описывает взаимодействие
1) гидроксида кальция и фосфорной кислоты
2) гидроксида лития и фосфорной кислоты
3) гидроксида натрия и бромоводородной кислоты
4) гидроксида алюминия и бромоводородной кислоты
4. Краткое ионное уравнение 3Ba 2+ + 2PO4 3– = Ba3(PO4)2↓ описывает взаимодействие
1) карбоната бария и фосфорной кислоты
2) карбоната бария и фосфата натрия
3) хлорида бария и фосфорной кислоты
4) хлорида бария и фосфата натрия
5. Краткое ионное уравнение Ba 2+ + SO4 2– = BaSO4↓ описывает взаимодействие
1) хлорида бария и сульфата натрия
2) хлорида бария и сернистой кислоты
3) гидроксида бария и сульфата натрия
4) гидроксида бария и серной кислоты
6. Краткое ионное уравнение Ag + + Cl – = AgCl↓ описывает взаимодействие
1) хлорида кальция и бромида серебра
2) фосфата серебра и соляной кислоты
3) карбоната серебра и хлорида натрия
4) нитрата серебра и хлорида калия
7. Краткое ионное уравнение H + + OH – = H2O отвечает взаимодействию
1) азотной кислоты и гидроксида железа (III)
2) бромоводородной кислоты и гидроксида натрия
3) азотной кислоты и гидроксида меди
4) сернистой кислоты и гидроксида кальция
8. Краткое ионное уравнение 2Н + + S 2– = Н2S↑ отвечает взаимодействию
1) соляной кислоты и сульфида железа (II)
2) сернистой кислоты и сульфида калия
3) азотной кислоты и сульфида меди
4) азотной кислоты и сульфида натрия
9. Краткое ионное уравнение 2Н + + CO3 2– = CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната бария
3) азотной кислоты и карбоната калия
4) серной кислоты и карбоната бария
10. Краткое ионное уравнение 2Н + + CaCO3 = Ca 2+ + CO2↑ + H2O отвечает взаимодействию
1) соляной кислоты и карбоната кальция
2) сернистой кислоты и карбоната кальция
3) фосфорной кислоты и карбоната кальция
4) серной кислоты и карбоната кальция
11. Краткое ионное уравнение Al 3+ + 3OH – = Al(OH)3↓ отвечает взаимодействию
1) сульфата алюминия и гидроксида кальция
2) сульфата алюминия и гидроксида бария
3) сульфата алюминия и гидроксида меди
4) сульфата алюминия и гидроксида натрия
12. Краткое и полное ионное уравнения совпадают для реакции
1) соляной кислоты и карбоната калия
2) уксусной кислоты и карбоната бария
3) уксусной кислоты и гидроксида калия
4) серной кислоты и гидроксида калия
13. Одновременно в растворе не могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , CO3 2–
2) Ba 2+ , NO3 – , Cl – , K +
3) CH3COO – , Li + , Br – , Al3 +
4) Mg 2+ , Br – , K + , Cl –
14. Одновременно в растворе могут существовать ионы
1) Ba 2+ , Fe 2+ , PO4 3– , SO4 2–
2) Ba 2+ , SO4 2– , Ca 2+ , PO4 3–
3) Na + , Ba 2+ , NO3 – , Cl –
4) Mg 2+ , Ca 2+ , SO3 2– , CO3 2–
15. Образование осадка происходит при взаимодействии водных растворов
16. Образование газа происходит при взаимодействии водных растворов
1) сульфата калия и хлорида бария
2) гидроксида алюминия и серной кислоты
3) хлорида кальция и карбоната натрия
4) соляной кислоты и карбоната натрия
17. С выпадением осадка протекает реакция ионного обмена между растворами
1) нитрата натрия и фторида калия
2) хлорида алюминия и избытка гидроксида калия
3) нитрата серебра и фторида натрия
4) нитрата магния и гидроксида калия
18. С выделением газа протекает реакция ионного обмена между растворами
1) карбоната калия и бромоводородной кислоты
2) сульфата натрия и гидроксидом калия
3) нитрата серебра и бромида цинка
4) нитрата алюминия и гидроксида бария
19. С выделением газа протекает реакция ионного обмена между растворами
1) гидроксида бария и азотной кислоты
2) сульфата алюминия и нитрата бария
3) нитрата серебра и йодида лития
4) азотной кислотой и карбоната аммония
20. С выделением воды протекает реакция ионного обмена между растворами
1) нитрата меди и хлорида железа
2) гидрокарбоната натрия и гидроксида натрия
3) нитрата ртути и бромида лития
4) нитрата аммония и нитрита натрия
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Видео:Реакции ионного обмена. 9 класс.Скачать

Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Видео:Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
📹 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обменаСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Реакции между растворами электролитов / Реакции ионного обменаСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Все о задании 21 на ОГЭ | Химия ОГЭ 2022 | УмскулСкачать

75. Ионные реакции в растворах электролитовСкачать

Тесты по химии. Сокращённые ионные уравнения. А23 демо тест 15 16Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать