- Положение в периодической системе химических элементов
- Электронное строение атома хрома
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид хрома (III)
- Способы получения
- Химические свойства
- Оксид хрома (II)
- Химические свойства
- Оксид хрома (VI)
- Способы получения
- Химические свойства
- Гидроксид хрома (III)
- Способы получения
- Химические свойства
- Гидроксид хрома (II)
- Способы получения
- Химические свойства
- Соли хрома
- Соли хрома (II)
- Соли хрома (III)
- Гидролиз солей хрома (III)
- Хромиты
- Соли хрома (VI)
- Некоторые важнейшие соединения хрома
- Способы получения
- Химические свойства
- 1. Взаимодействие с O2
- 2. Взаимодействие с другими неметаллами
- 3. Взаимодействие с разбавленными растворами HCl и H2SO4
- 4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром.
- 5. Вытеснение малоактивных Me из водных р-ров солей.
- 6. Взаимодействие с солями, разлагающимися с образованием кислорода.
- Соединения Cr (II)
- Способы получения
- Химические свойства
- Химические свойства
- Соли Сr 2+
- Способы получения:
- Химические свойства
- Соединения Сr(III)
- Способы получения
- Химические свойства
- Сr(ОН)3 — гидроксид хрома (III).
- Химические свойства
- Соли Cr 3+ .
- Химические свойства
- Соединения Cr(VI)
- CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид.
- Химические свойства
- Хромовые кислоты — Н2СrO4, Н2Сr2O7.
- Химические свойства
- Способы получения
- Химические свойства
- Химические свойства
- Примеры ОВР с участием дихроматов в качестве окислителей
- Хром (Cr)
- Химические свойства хрома
- Соединения хрома
- Получение хрома
- Применение хрома
Положение в периодической системе химических элементов
Хром расположен в 6 группе (или в побочной подгруппе VI группы в короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома хрома
Электронная конфигурация хрома в основном состоянии :
+24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 

3s 


Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Хром – твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов.
Изображение с портала top10a.ru
Температура плавления 1890 о С, температура кипения 2680 о С, плотность хрома 7,19 г/см 3 .
Нахождение в природе
Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2).
Способы получения
Хром получают из хромита железа. Для восстановления используют кокс:
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия):
Качественные реакции
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами . При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Например , хлорид хрома (II) взаимодействует с гидроксидом натрия:
CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами . При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Например , хлорид хрома (III) взаимодействует с гидроксидом калия:
CrCl3 + 3KOH → Cr(OH)3 + 3KCl
При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли:
Обратите внимание , если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс:
Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II).
CrCl2 + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4Cl
Cr 2+ + 2NH3 + 2H2O → Cr(OH)2↓ + 2NH4 +
При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется серо-зеленый осадок гидроксида хрома (III).
CrCl3 + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4Cl
Cr 3+ + 3NH3 + 3H2O → Cr(OH)3 ↓ + 3NH4 +
Химические свойства
В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6.
1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором.
1.1. При взаимодействии хрома с галогенами образуются галогениды:
2Cr + 3Cl2 → 2CrCl3
1.2. Хром реагирует с серой с образованием сульфида хрома:
1.3. Хром взаимодействует с фосфором . При этом образуется бинарное соединение – фосфид хрома:
Cr + P → CrP
1.4. С азотом хром реагирует при нагревании до 1000 о С с образованием нитрида:
2Cr + N2 → 2CrN
1.5. Хром не взаимодействует с водородом.
1.6. Хром взаимодействует с кислородом с образованием оксида:
2. Хром взаимодействует и со сложными веществами:
2.1. Хром реагирует с парами воды в раскаленном состоянии:
2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II).
Например , хром бурно реагирует с соляной кислотой :
Cr + 2HCl → CrCl2 + H2↑
В присутствии кислорода образуются соли хрома (III):
4Cr + 12HCl + 3O2 → 4CrCl3 + 6H2O
2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат хрома (III) и вода:
2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации.
Только при сильном нагревании концентрированная азотная кислота растворяет хром:
2.5. Растворы щелочей на хром практически не действуют.
2.6. Однако хром способен вытеснять многие металлы , например медь, олово, серебро и др. из растворов их солей.
Например , хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди:
2Cr + 3CuCl2 → 2CrCl3 + 3Cu
Восстановительные свойства хрома также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде.
Например , при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия:
Хлорат калия и нитрат калия также окисляют хром:
Оксид хрома (III)
Способы получения
Оксид хрома (III) можно получить различными методами :
1. Термическим разложением гидроксида хрома (III):
2. Разложением дихромата аммония:
3. Восстановлением дихромата калия углеродом (коксом) или серой:
Химические свойства
Оксид хрома (III) – типичный амфотерный оксид . При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами.
1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты.
Например , оксид хрома (III) взаимодействует с оксидом натрия:
2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—хромиты, а в растворе реакция практически не идет . При этом оксид хрома (III) проявляет кислотные свойства.
Например , оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды:
3. Оксид хрома (III) не взаимодействует с водой.
4. Оксид хрома (III) проявляет слабые восстановительные свойства . В щелочных расплавах окислителей окисляется до соединений хрома (VI).
Например , оксид хрома (III) взаимодействует с нитратом калия в щелочной среде:
Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия:
Озоном или кислородом:
Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III):
5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами .
Например , оксид хрома (III) реагирует с серной кислотой:
6. Оксид хрома (III) проявляет слабые окислительные свойства при взаимодействии с более активными металлами.
Например , оксид хрома (III) реагирует с алюминием (термит):
Реакция очень экзотермическая, сопровождается выделением большого количества света:

Если сжечь большой объем термита в тигле, то можно получить металлический хром:

7. Оксид хрома (III) – твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната калия:
Оксид хрома (II)
Химические свойства
Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами.
1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом . Все соединения хрома (II) – сильные восстановители.
2. При высоких температурах оксид хрома (II) диспропорционирует :
3CrO → Cr + Cr2O3
3. Оксид хрома (II) не взаимодействует с водой.
4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами .
Например , оксид хрома (II) взаимодействует с соляной кислотой:
CrO + 2HCl → CrCl2 + H2O
И с серной кислотой:
Оксид хрома (VI)
Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях.
Способы получения
Оксид хром (VI) можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы:
Химические свойства
Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты.

1. При взаимодействии оксида хрома (VI) с водой образуется хромовые кислоты:
2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниями и основными оксидами .
Например , оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия:
Или с оксидом лития с образованием хромата лития:
3. Оксид хрома (VI) – очень сильный окислитель : окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III).
Например , сера окисляется до оксида серы (IV):
Оксид хрома (VI) также окисляет сложные вещества, например , сульфиты:
И некоторые органические веществ, например , этанол:
Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например , хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например , хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами . При этом образуются средние соли.
Например , гидроксид хрома (III) взаимодействует с соляной кислотой с образованием хлорида хрома (III):
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли . При этом гидроксид хрома (III) проявляет кислотные свойства.
Например , гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Например , при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
Гидроксид хрома (II)
Способы получения
1. Гидроксид хрома (II) можно получить действием раствора аммиака на соли хрома (II).
Например , хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II) и хлорида аммония:
2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II).
Например , хлорид хрома (II) реагирует с гидроксидом калия с образованием гидроксида хрома (II) и хлорида калия:
CrCl2 + 2KOH → Cr(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид хрома (II) проявляет основные свойства . В частности, реагирует с растворимыми кислотами .
Например , гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II). Соли хрома (II) окрашивают раствор в синий цвет.
2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II):
3. Гидроксид хрома (II) – сильный восстановитель.
Например , под действием кислорода воздуха гидроксид хрома (II) окисляется до гидроксида хрома (III):
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Видео:Оксид Хрома(6) - CrO3. Реакция Дихромата Калия и Серной Кислоты. Реакция K2Cr2O7 и H2SO4.Скачать

Некоторые важнейшие соединения хрома
Cr(OH)2 слабое основание
Cr(OH)3 ↔ HCrO2 + H2O амфотерный гидроксид
Окислители и восстановители
Видео:Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

Способы получения
2. Силикотермический: 2Сr2O3 + 3Si = 3SiO2 + 4Cr
3. Электролитический: 2CrCl3 = 2Сr + 3Cl2
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Химические свойства
Поверхностная оксидная пленка является причиной инертности хрома при обычной температуре, благодаря чему этот металл не подвергается атмосферной коррозии (в отличие от железа).
При нагревании хром проявляет свойства довольно активного металла, что соответствует его положению в электрохимическом ряду напряжений.
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

1. Взаимодействие с O2
Тонкоизмельченный хром интенсивно горит в токе кислорода. На воздухе реакция с O2 происходит лишь на поверхности металла.
При осторожном окислении амальгамированного хрома образуется низший оксид CrO.
Видео:Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

2. Взаимодействие с другими неметаллами
(Сr не взаимодействует с Н2, но поглощает его в больших количествах)
CrCl3 и CrS — ионные соединения.
CrN и rxCy — ковалентные тугоплавкие инертные вещества, по твердости сравнимы с алмазом.
Видео:Серная кислота. Химические свойства. Взаимодействие с НЕметаллами.Скачать

3. Взаимодействие с разбавленными растворами HCl и H2SO4
Видео:Изучаем химические свойства концентрированной серной кислоты!Скачать

4. Действие концентрированных HNO3, H2SO4 и «царской водки» на хром.
Эти кислоты не растворяют хром при обычной температуре, они переводят его в «пассивное» состояние.
Пассивацию можно частично снять сильным нагреванием, после чего хром начинает очень медленно растворяться в кипящих конц. HNO3, H2SO4, «царской водке».
— смесь концентрированных HNO33 и НСl (1:3), растворяет золото и платиновые металлы (Pd,Os,Ru).
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

5. Вытеснение малоактивных Me из водных р-ров солей.
Видео:Все реакции по теме «Хром» для ЕГЭ по химии | Екатерина СтрогановаСкачать

6. Взаимодействие с солями, разлагающимися с образованием кислорода.
Соединения Cr (II)
СrO — оксид хрома (II).
Твердое черное вещество, н. р. в Н2O.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Способы получения
1) медленное окисление хрома, растворенного в ртути
2) обезвоживание Сr(ОН)2 в восстановительной атмосфере:
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Химические свойства
СrO — неустойчивое вещество, легко окисляется при небольшом нагревании до Сr2O3; при более высоких Т диспропорционирует:
СrO — типичный основный оксид, проявляет характерные для этого класса свойства. Реакции необходимо проводить в восстановительной среде.
Сr(OН)2 — гидроксид хрома (II)
твердое желтое вещество, н. р. в Н2O.
обменными реакциями из солей Сr 2+ :
Видео:Серная кислота и ее соли. 9 класс.Скачать

Химические свойства
Неустойчивое вещество, разлагается при нагревании; на воздухе быстро окисляется с образованием зеленого гидроксида хрома (III);
Видео:Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Соли Сr 2+
Наиболее важные: CrCl2, CrSO4, (СН3СОО)2Сr. Гидратированный ион Сr 2+ имеет бледно-голубую окраску.
Видео:Растворение ХРОМА в КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЕ. Опыты по химии. Получение СУЛЬФАТА ХРОМА.Скачать

Способы получения:
1. Сr + неметалл (S, Hal2)
2. Восстановление солей Сr 3+ :
Видео:Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать

Химические свойства
1. Соли Сr 2+ — сильные восстановители, так как очень легко окисляются до солей Сr 3+
2. Раствор CrSO4 в разбавленной H2SO4 — превосходный поглотитель кислорода:
3. С аммиаком соли Сr 2+ образуют комплексные соли — аммиакаты:
Для Сr 2+ характерно образование двойных сульфатов, например: K2Cr(SO4)2• 6Н2O
Соединения Сr(III)
, важнейшее природное соединение хрома. Сr2О3, полученный химическими методами, представляет собой темно-зеленый порошок.
Видео:Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать

Способы получения
1. Синтез из простых веществ:
2. Термическое разложение гидроксида хрома (III) или дихромата аммония:
3. Восстановление дихроматов углеродом или серой:
Сr2O3 используется для изготовления краски «хромовая зеленая», обладающей термо- и влагоустойчивостью.
Видео:Реакция ХЛОРИДА ХРОМА и ФОСФОРНОЙ КИСЛОТЫ. Reaction of CHROMIUM CHLORIDE and PHOSPHORIC ACID.ОпытыСкачать

Химические свойства
Сr2O3 — типичный амфотерный оксид
В порошкообразном виде реагирует с сильными кислотами и сильными щелочами, в кристаллическом виде — химически инертное вещество.
К наиболее практически важным реакциям относятся следующие:
1. Восстановление с целью получения металлического хрома:
2. Сплавление с оксидами и карбонатами активных металлов:
Образующиеся метахромиты являются производными метахромистой кислоты НСrO2.
3. Получение хлорида хрома (III):
Видео:Разбавление серной кислотыСкачать
Сr(ОН)3 — гидроксид хрома (III).
Образуется в виде синевато-серого осадка при действии щелочей на соли Сr 3+ :
Практически нерастворимый в воде гидроксид может существовать в виде коллоидных растворов.
В твердом состоянии гидроксид хрома (III) имеет переменный состав Сr2O3• nН2O. Теряя молекулу воды, Сr(ОН)3 превращается в метагидроксид СrО(ОН).
Видео:Получение водорода действием разбавленной серной кислоты на цинкСкачать

Химические свойства
Сr(ОН)3 — амфотерный гидроксид, способный растворяться как в кислотах, так и в щелочах:
Сr(ОН)3 + ЗОН — = [Cr(OH)6] 3- гексагидроксохромитанион
При сплавлении с твердыми щелочами образуются метахромиты:
Видео:Фтористый Хромил - CrO2F2. Реакция Дихромата Калия, Фторида Натрия и Серной кислоты.Скачать

Соли Cr 3+ .
Растворением осадка Сr(ОН)3 в кислотах получают нитрат Cr(NO3)3, хлорид СrСl3, сульфат Cr2(SO4)3 и другие соли. В твердом состоянии чаще всего содержат в составе молекул кристаллизационную воду, от количества которой зависит окраска соли.
Самой распространенной является двойная соль КСr(SO4)2• 12H2O — хромокалиевые квасцы (сине-фиолетовые кристаллы).
Хромиты, или хроматы (III) — соли, содержащие Сr 3+ в составе аниона. Безводные хромиты получают сплавлением Сr2O3 с оксидами двухвалентных металлов:
В водных растворах хромиты существуют в виде гидроксокомплексов.
Химические свойства
К наиболее характерным свойствам солей Cr(III) относятся следующие:
1. Осаждение катиона Сг 3+ под действием щелочей:
Характерный цвет осадка и его способность растворяться в избытке щелочи используется для отличия ионов Сг 3+ от других катионов.
2. Легкая гидролизуемость в водных растворах, обусловливающая сильнокислый характер среды:
Сr 3+ + Н2O = СrОН 2+ + Н +
Соли Сr (III) с анионами слабых и летучих кислот в водных растворах не существуют; так как подвергаются необратимому гидролизу, например:
3. Окислительно-восстановительная активность:
а) окислитель: соли Cr(III) → соли(VI)
см. «Получение солей Cr(VI)»
б) восстановительь: соли Cr(III) → соли(II)
см. «Получение солей Cr(II)»
4. Способность к образованию комплексных соединений — аммиакатов и аквакомплексов, например:
Соединения Cr(VI)
CrO3 — оксид хрома (VII) триоксид хрома, хромовый ангидрид.
Кристаллическое вещество темно-красного цвета, очень гигроскопичное, легко растворимое в воде. Основной способ получения:
Химические свойства
СrО3 — кислотный оксид, активно взаимодействует с водой и щелочами, образуя хромовые кислоты и хроматы.
Хромовый ангидрид — чрезвычайно энергичный окислитель. Например, этанол воспламеняется при соприкосновении с СrO3:
Продуктом восстановления хромового ангидрида, как правило, является Сr2O3.
Хромовые кислоты — Н2СrO4, Н2Сr2O7.
Химические свойства
При растворении CrO3 в воде образуются 2 кислоты:
Обе кислоты существуют только в водных растворах. Между ними устанавливается равновесие:
Обе кислоты очень сильные, по первой ступени диссоциированы практически полностью:
— соли, содержащие анионы хромовой кислоты CrO4 2- . Почти все имеют желтую окраску (реже — красную). В воде хорошо растворяются только хроматы щелочных металлов и аммония. Хроматы тяжелых металлов н. р. в Н2O. Наиболее распространены: Na2CrO4, К2CrO4, РЬCrO4 (желтый крон).
Способы получения
1. Сплавление CrO3 с основными оксидами, основаниями:
2. Окисление соединений Cr(III) в присутствии щелочей:
3. Сплавление Сr2O3 со щелочами в присутствии окислителя:
Химические свойства
Хроматы существуют только в разбавленных щелочных растворах, которые имеют желтую окраску, характерную для анионов СrO4 2- . При подкислении раствора эти анионы превращаются в оранжевые дихромат-анионы:
2СrO4 2- + 2Н + = Сr2O7 2- + Н2O Это равновесие мгновенно сдвигается в ту или иную сторону при изменении рН растворов.
Хроматы — сильные окислители.
При нагревании хроматы тяжелых металлов разлагаются; например:
— соли, содержащие анионы дихромовой кислоты Сr2O7 2-
В отличие от монохроматов имеют оранжево-красную окраску и обладают значительно лучшей растворимостью в воде. Наиболее важные дихроматы — К2Сr2O7, Na2Cr2O7, (NH4)2Cr2O7.
Их получают из соответствующих хроматов под действием кислот, даже очень слабых, например:
Химические свойства
Водные растворы дихроматов имеют кислую среду вследствие устанавливаемого равновесия с хроматанионами (см. выше). Окислительные свойства дихроматов наиболее сильно проявляются в подкисленных растворах:
При добавлении восстановителей к кислым растворам дихроматов окраска резко изменяется от оранжевой до зеленой, характерной для соединений Сг 3+ .
Примеры ОВР с участием дихроматов в качестве окислителей
Эта реакция используется для получения хромокалиееых квасцов KCr(SO4)2 • 12H2O
Хром (Cr)
Хром (цвет, краска) впервые был найден на Березовском золоторудном месторождении (Средний Урал), первые упоминания относятся к 1763 году, в своем труде «Первые основания металлургии» М. В. Ломоносов называет его «красной свинцовой рудой».
Массовое содержание хрома в земной коре составляет 0,02% (распространенный элемент). Чаще всего хром в природе присутствует в соединениях хромита FeCrO4 и крокоита PbCrO4.
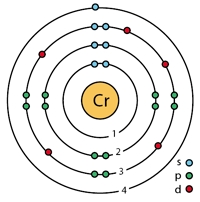
Рис. Строение атома хрома.
Электронная конфигурация атома хрома — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 1 электрон, находящийся на внешнем 4s-уровне + 5 электронов 3d-подуровня (всего 6 электронов), поэтому в соединениях хром может принимать степени окисления от +6 до +1 (наиболее часто встречаются +6, +3, +2). Хром является химически малоактивным металлом, с простыми веществами вступает в реакцию только при высоких температурах.
Физические свойства хрома:
- металл голубовато-белого цвета;
- очень твердый металл (в присутствии примесей);
- хрупкий при н. у.;
- пластичный (в чистом виде).
Химические свойства хрома
- при t=300°C реагирует с кислородом:
4Cr + 3O2 = 2Cr2O3; - при t>300°C реагирует с галогенами, образуя смеси галогенидов;
- при t>400°C реагирует с серой, с образованием сульфидов:
Cr + S = CrS; - при t=1000°C тонкоизмельченный хром реагирует с азотом, образуя нитрид хрома (полупроводник, обладающий высокой химической устойчивостью):
2Cr + N2 = 2CrN; - реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Cr + 2HCl = CrCl2 + H2;
Cr + H2SO4 = CrSO4 + H2; - теплые концентрированные азотная и серная кислоты растворяют хром.
С концентрированными серной и азотной кислотой при н.у. хром не взаимодействует, также не растворяется хром и в царской водке, примечательно, что чистый хром не вступает в реакцию даже с разбавленной серной кислотой, причина этого феномена до сих пор не установлена. При длительном хранении в концентрированной азотной кислоте хром покрывается очень плотной оксидной пленкой (пассивируется), и перестает реагировать с разбавленными кислотами.
Соединения хрома
Выше уже было сказано, что «любимыми» степенями окисления хрома являются +2 (CrO, Cr(OH)2), +3 (Cr2O3, Cr(OH)3), +6 (CrO3, H2CrO4).
Хром является хромофором, т.е., элементом, придающим окраску веществу, в котором он содержится. Например, в степени окисления +3, хром придает лилово-красную или зеленую окраску (рубин, шпинель, изумруд, гранат); в степени окисления +6 — желто-оранжевую окраску (крокоит).
Хромофорами, кроме хрома, являются также железо, никель, титан, ванадий, марганец, кобальт, медь — всё это d-элементы.
Цвет распространенных соединений, в состав которых входит хром:
- хром в степени окисления +2:
- оксид хрома CrO — красный;
- фторид хрома CrF2 — сине-зеленый;
- хлорид хрома CrCl2 — не имеет цвета;
- бромид хрома CrBr2 — не имеет цвета;
- йодид хрома CrI2 — красно-коричневый.
- хром в степени окисления +3:
- Cr2O3 — зеленый;
- CrF3 — светло-зеленый;
- CrCl3 — фиолетово-красный;
- CrBr3 — темно-зеленый;
- CrI3 — черный.
- хром в степени окисления +6:
- CrO3 — красный;
- хромат калия K2CrO4 — лимонно-желтый;
- хромат аммония (NH4)2CrO4 — золотисто-желтый;
- хромат кальция CaCrO4 — желтый;
- хромат свинца PbCrO4 — светло-коричнево-желтый.
С увеличением степени окисления хрома в оксидах и гидроксидах происходит ослабление основных и усиление кислотных их свойств.
Получение хрома
Как было указано выше, основным источником хрома являются хромсодержащие руды: хромит и крокоит.
Оксид хрома (III) Cr2O3, который необходим для получения металлического хрома, получают в несколько этапов:
- на первом этапе обжигом руды с карбонатом натрия нерастворимый хромат железа переводят в растворимый хромат натрия:
Na2Cr2O7 + 3C = Na2O + Cr2O3 + 3CO; - металлический хром получаеют восстанавливая оксид хрома (III) алюминием (кремнием):
Cr2O3 + 2Al = 2Cr + Al2O3.
Более подробно технология получения хрома описана на странице «Получение и применение Cr, Mo, W».
Применение хрома
- как лигирующая добавка при выплавке жаростойких и коррозионностойких слпавов;
- для хромирования металлических изделий с целью придания им высокой коррозионной стойкости, устойчивости к истиранию и красивого внешнего вида;
- сплавы хром-30 и хром-90 используются в соплах плазмотронов и в авиационной промышленности.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе



