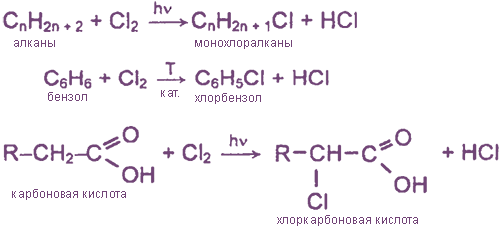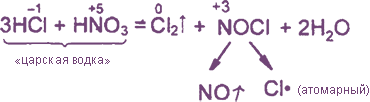Многие органические красители под действием хлора обесцвечиваются. Это свойство хлора используется для отбеливания тканей. Нальем в стакан органического красителя синего цвета. Опустим в раствор полоску хлопчатобумажной ткани. Извлечем ткань из раствора красителя. Избыток раствора удалим, поместив ткань на лист фильтровальной бумаги. Поместим окрашенную ткань в сосуд с хлором. Через некоторое время ткань обесцвечивается. Обесцвечивает красители не сам хлор, а кислород, выделяющийся при распаде хлорноватистой кислоты. Хлорноватистая кислота образуется в результате взаимодействия хлора с водой:
Cl2 + H2O 
HCIO 
Окрашенное сухое полотно в хлоре не обесцвечивается.
Оборудование: цилиндр стеклянный, стакан химический, стеклянная палочка, керамическая или стеклянная пластинка.
Техника безопасности. Соблюдать правила работы с ядовитыми газами. Опыт проводить только под тягой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
- Физические свойства
- Способы получения
- Промышленный
- Лабораторные
- Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
- Диспропорционирование хлора в воде и водных растворах щелочей
- Взаимодействие хлора с органическими веществами
- Хлороводород и соляная кислота
- Газообразный хлороводород
- Физические и химические свойства
- Способы получения
- Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
- Химические свойства соляной кислоты
- Реакции с органическими соединениями
- Оксиды и оксокислоты хлора
- Взаимодействие хлора с органическими красителями уравнения
- 📸 Видео
Видео:Взаимодействие хлора с органическими красителямиСкачать

Физические свойства
Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Видео:Взаимодействие хлора с органическими красителямиСкачать

Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Видео:Взаимодействие хлора с органическими красителямиСкачать

Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Лабораторные
Окисление конц. HCI различными окислителями:
Видео:Взаимодействие хлора с медьюСкачать

Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Видео:Взаимодействие хлора с калиемСкачать

Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Видео:Взаимодействие хлора со скипидаромСкачать

Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Видео:Взаимодействие хлора с железомСкачать

Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Видео:Взаимодействие хлора с фосфоромСкачать

Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Видео:Хлор и его соединенияСкачать

Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Видео:Опыты по химии. Действие хлора на красителиСкачать

Газообразный хлороводород
Видео:Взаимодействие хлора с водородомСкачать

Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Видео:Хлор. 9 класс.Скачать

Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Видео:Взаимодействие хлора с калиемСкачать

Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Взаимодействие хлора с органическими красителями уравнения
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Взаимодействие хлора с органическими красителями
Описание.
С помощью хлора можно отбеливать ткани. Приготовим органический краситель и окрасим хлопчатобумажный лоскуток. Что произойдет если окрашенную влажную ткань опустить в сосуд с хлором. Хлор – ядовитый газ желто-зеленого цвета. Обратите внимание, он не улетучивается из сосуда – он тяжелее воздуха. Влажный лоскуток обесцвечивается в атмосфере хлора. Молекулы красителя разрушают не сам хлор, а атомарный кислород, который образуется при распаде хлорноватистой кислоты. Хлорноватистая кислота – это продукт взаимодействия хлора с водой. Так с помощью хлора можно отбеливать ткани.
📸 Видео
131 Взаимодействие хлора с медьюСкачать

Взаимодействие хлора с железомСкачать

Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать