1. Налейте в пробирку 1 мл глицерина. Отметьте высокую вязкость жидкости. Прилейте к глицерину воду и перемешайте. Сделайте вывод о растворимости глицерина в воде.
2. Получите из сульфата меди гидроксид меди (II), отметьте цвет вещества и его растворимость в воде. К полученному осадку добавьте раствор глицерина, приготовленный в задании 1. Что наблюдаете? Для чего используют эту реакцию?
Глицерин имеет высокую вязкость жидкости. При добавлении воды к глицерину наблюдается полное растворение воды в глицерине (или глицерина в воде).
Вывод: глицерин смешивается с водой в любых соотношениях.
Для получения гидроксида меди (II) прильём к сульфату меди (II) раствор щелочи.
CuSO4 + 2NaOH ⟶ Na2SO4 + Cu(OH)2↓
Образовавшийся осадок гидроксида меди (II) имеет синий цвет.
При добавлении глицерина к гидроксиду меди (II) наблюдается растворение осадка и окрашивание раствора в ярко-синий цвет. Эту реакцию используют как качественную реакцию на многоатомные спирты.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Глицерин
| Глицерин | |||
|---|---|---|---|
| |||
 | |||
| Традиционные названия | глицерин | ||
| Хим. формула | C3H8O3 | ||
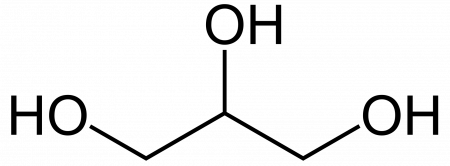
| Рац. формула | HOCH2-CH(OH)-CH2OH | ||
| Молярная масса | 92,09 г/моль | ||
| Плотность | 1,261 г/см³ | ||
| Температура | |||
| • плавления | 17,9 °C | ||
| • кипения | 290 °C | ||
| • разложения | 554 ± 1 °F | ||
| • вспышки | 320 ± 1 °F и 160 °C | ||
| Давление пара | 0,003 ± 0,001 мм рт.ст. | ||
| Показатель преломления | 1,4740 | ||
| ГОСТ | ГОСТ 6824-96 ГОСТ 6823-2017 ГОСТ 6259-75 | ||
| Рег. номер CAS | 56-81-5 | ||
| PubChem | 753 | ||
| Рег. номер EINECS | 200-289-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E422 | ||
| RTECS | MA8050000 | ||
| ChEBI | 17754 | ||
| ChemSpider | 733 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Глицерин (от греч. γλυκερός — сладкий) — органическое соединение, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3 . Представляет собой вязкую прозрачную жидкость со сладким вкусом.
Синонимы: глицерóл, пропантриол-1,2,3.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Производные глицерина и их место в обмене веществ живых организмов
- 4.1 Глицериды
- 5 Применение
Видео:Опыты по химии. Растворение глицерина в водеСкачать

Физические свойства
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d4 20 = 1,260, коэффициент преломления nD 20 = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом.
При растворении глицерина в воде происходит выделение тепла и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C.
Образует азеотропы с нафталином, его производными и рядом других веществ.
Видео:8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
и окисляется до глицеринового альдегида CH2OHCHOHCHO , дигидроксиацетона CH2OHCOCH2OH или глицериновой кислоты CH2OHCHOHCOOH .
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Получение
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта. Хлорированием пропилена при 450—500 °С получают аллилхлорид, при присоединении к последнему хлорноватистой кислоты образуются хлоргидрины, например, CH2ClCHOHCH2Cl , которые при омылении щёлочью превращаются в глицерин.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Производные глицерина и их место в обмене веществ живых организмов
Глицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов, обладающих свойствами сохранять и увеличивать степень вязкости и консистенции пищевых продуктов. Зарегистрирован как пищевая добавка E422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита.
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.
Видео:ХИМИЧЕСКИЙ ОПЫТ - Глицерин и МарганцовкаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔥 Видео8.2. Многоатомные спирты (этиленгликоль, глицерин): Способы получения. ЕГЭ по химииСкачать  Взаим-вие многоатомных спиртов с гидроксидом медиСкачать  Взаимодействие щелочных металлов с водойСкачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Взаимодействие металлов с кислотами. 8 класс.Скачать  Химический эксперимент марганцовка и глицеринСкачать  Взаимодействие фенола с бромной водойСкачать  МАРГАНЦОВКА И ГЛИЦЕРИН - химические опытыСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Химический видео Опыт Сода+ Уксус. Уравнение реакций. Простой опыт по ХИМИИ.Скачать  25. Схема реакции и химическое уравнениеСкачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  |