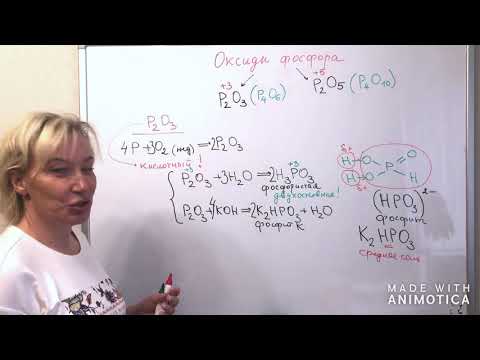Фосфор (греч. phos — свет + phoros — несущий) — химический элемент, принадлежащий к Vа группе и 3 периоду. Простое желтоватое вещество, легко воспламеняющееся и светящееся.
- Соединения фосфора
- Фосфин (PH3)
- Фосфиды
- Оксид фосфора (III), триоксид фосфора (P2O3)
- Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
- Фосфорные кислоты
- Фосфористая кислота ( H3PO3)
- Соли фосфористой кислоты (Фосфиты)
- Ортофосфорная кислота, фосфорная кислота (Н3РO4)
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Фосфорные удобрения
- Фосфор. Химия фосфора и его соединений
- Фосфор
- Положение в периодической системе химических элементов
- Электронное строение фосфора
- Физические свойства и нахождение в природе
- Соединения фосфора
- Способы получения фосфора
- Химические свойства фосфора
- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- Фосфиды
- Способы получения фосфидов
- Химические свойства фосфидов
- Оксиды фосфора
- Оксид фосфора (III)
- Оксид фосфора (V)
- Фосфорная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Фосфористая кислота
- Соли фосфорной кислоты — фосфаты
- 📽️ Видео
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
- Реакции с неметаллами
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
Реакции с водородом крайне затруднена. Тем не менее, в ходе разложения фосфидов металлов можно получить ядовитый газ — фосфин — боевое отравляющее вещество.
2P + 3Ca → Ca3P2 (фосфид кальция)
Реакция с водой
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
Реакция с щелочами
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
Оксид фосфора V — P2O5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Реагирует с основными оксидами и основаниями, образуя соли фосфорной кислоты. Какая именно получится соль — определяет соотношение основного оксида/основания и кислотного оксида.
6KOH + P2O5 = 2K3PO4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4KOH + P2O5 = 2K2HPO4 + H2O (гидрофосфат калия, незначительный избыток кислотного оксида — соотношение 4:1)
2KOH + P2O5 = 2KH2PO4 + H2O (дигидрофосфат калия, избыток кислотного оксида — соотношение 2:1)
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
- Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO4 3- )
- Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3 — )
- Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO3 2- )
- Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2 — )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
Реакции с солями
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Реакции с металлами
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
- Фосфоритная мука — Ca3(PO4)2
- Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4
- Двойной суперфосфат — Ca(H2PO4)2*H2O
- Преципитат — CaHPO4*2H2O
- Костная мука — продукт переработки костей домашних животных Ca3(PO4)2
- Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Соединения фосфора
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
- Реакция диспропорционирования фосфора в щелочах:
- Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами – окислителями:
- С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойства фосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Оксид фосфора (III), триоксид фосфора (P2O3)
Способы получения оксида фосфора (III)
- Р2О3 образуется при горении фосфора в недостатке кислорода или его медленном окислении:
Физические свойства оксида фосфора (III)
При комнатной температуре Р2О3 — белая воскообразная масса с неприятным запахом. Легко испаряется, его Тпл = 23,5°С
Пары существует в виде димеров Р4О6.
!Очень ядовит
Химические свойства оксида фосфора (III)
- Р2О3 как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
- Реакция диспропорционирования происходит очень бурно при растворении Р2О3в горячей воде:
- При взаимодействии Р2О3с щелочами образуются соли фосфористой кислоты:
- При взаимодействии с окислителями P2O3 проявляет восстановительные свойства:
Окисление кислородом воздуха:
Окисление галогенами:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Оксид фосфора (V), пентаоксид фосфора, фосфорный ангидрид (Р2О5)
Способы получения фосфорного ангидрида
Сжигание фосфора в избытке воздуха:
Физические свойства фосфорного ангидрида
При комнатной температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде димеров Р4О10.
Очень гигроскопична, при соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойства фосфорного ангидрида
Р2О5 проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
- с основными оксидами, с образованием фосфатов
- с щелочами, с образованием средних и кислых солей
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Видео:Оксид фосфора и щелочьСкачать

Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, в которых он находится в степенях окисления +5 и +3. Однако существует большое число кислот, в которых фосфор имеет валентность равную V (пять ковалентных связей) и степени окисления +5, +4, +3, +1.
Строение наиболее известных кислот выражается следующими формулами:
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
- Гидролиз галогенидов фосфора (III):
- Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
- Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
- Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
- Реагируют с сильными окислителями:
- Реагируют с более слабыми окислителями:
- В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
- При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Соли фосфористой кислоты (Фосфиты)
Способы получения фосфитов
- Взаимодействие фосфористой кислоты с щелочами:
- взаимодействие фосфористой кислоты с металлами с выделением Н2
- взаимодействие фосфористой кислоты с оксидами металлов
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
Физические свойства фосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты плохо растворимы.
Химические свойства фосфитов
Имеют химические свойства, характерные для солей
Видео:Реакция оксида фосфора с водой. Химический опытСкачать

Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
- Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
- с основными оксидами:
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
- с аммиаком образует соли аммония:
- Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы получения фосфатов
Получают кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства ортофосфорной кислоты)
Физические свойства фосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO4 3- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO4 2- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4 — | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойства фосфатов
- Имеют свойства, характерные для солей.
- Соли щелочных металлов подвержены гидролизу:
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Категории V группа (азот, фосфор), НЕОРГАНИЧЕСКАЯ ХИМИЯ
Видео:Химические свойства фосфора | ХимияСкачать

Фосфор. Химия фосфора и его соединений
Фосфор
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение фосфора
Электронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние.
Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V.
Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| +5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 Галогенангидриды: PОCl3, PCl5 |
| +3 | Оксид фосфора (III) P2O3 Галогенангидриды: PCl3 |
| +1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов , прокаливая их с коксом и песком в электрической печи:
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например , метафосфорную кислоту.
4HPO3 + 10C → P4 + 2H2O + 10 CO
3. Красный и черный фосфор получают из белого фосфора.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами .
1.1. При взаимодействии с кислородом воздуха образу
ются оксиды – ангидриды соответствующих кислот :
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора с серой образуются сульфиды:
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например , кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
Еще пример : натрий взаимодействует с фосфором с образованием фосфида натрия:
P + 3Na → Na3P
1.5. С водородом фосфор непосредственно не взаимодействует.
2. Со сложными веществами фосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями фосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например , азотная кислота окисляет фосфор до фосфорной кислоты:
Серная кислота также окисляет фосфор:
Соединения хлора, например , бертолетова соль , также окисляют фосфор:
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор. Например , оксид серебра (I) :
2.2. При растворении в щелочах фосфор диспропорционирует до гипофосфита и фосфина.
Например , фосфор реагирует с гидроксидом калия:
Или с гидроксидом кальция:
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфиды
Фосфиды – это бинарные соединения фосфора и металлов или некоторых неметаллов .
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами . При этом фосфор проявляет свойства окислителя.
Например , фосфор взаимодействует с магнием и кальцием:
Фосфор взаимодействует с натрием:
P + 3Na → Na3P
Химические свойства фосфидов
1. Фосфиды легко разлагаются водой или кислотами с образованием фосфина.
Например , фосфид кальция разлагается водой:
Фосфид магния разлагается соляной кислотой:
2. Фосфиды металлов проявляют сильные восстановительные свойства за счет фосфора в степени окисления -3 .
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (III)
Оксид фосфора (III) – это кислотный оксид . Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6.
Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода :
Химические свойства оксида фосфора (III):
Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций.
1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования.
Например , оксид фосфора (III) диспропорционирует в горячей воде:
2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя.
Например , N2O окисляется кислородом:
3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты:
а со щелочами – с образованием солей (фосфитов):
Оксид фосфора (V)
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства.
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфористая кислота
Фосфористая кислота H3PO3 — это двухосновная кислородсодержащая кислота. При нормальных условиях бесцветное кристаллическое вещество, хорошо растворимое в воде.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Получение фосфористой кислоты.
Фосфористую кислоту можно получить гидролизом галогенидов фосфора (III).
Например , гидролизом хлорида фосфора (III):
Фосфористую кислоту можно получить также взаимодействием оксида фосфора (III) с водой:
Химические свойства.
1. Фосфористая кислота H3PO3 в водном растворе — двухосновная кислота средней силы. Взаимодействует с основаниями с образованием солей-фосфитов.
Например , при взаимодействии с гидроксидом натрия фосфористая кислота образует фосфит натрия:
2. При нагревании фосфористая кислота разлагается на фосфин (Р -3 ) и фосфорную кислоту (Р +5 ):
3. За счет фосфора в степени окисления +3 фосфористая кислота проявляет восстановительные свойства .
Например , H3PO3 окисляется перманганатом калия в кислой среде:
Еще пример : фосфористая кислота окисляется соединениями ртути (II):
Соли фосфорной кислоты — фосфаты
Фосфорная кислота образует разные типы солей: средние – фосфаты, кислые – гидрофосфаты, дигидрофосфаты.
1. Качественная реакция на фосфаты — взаимодействие с нитратом серебра. При этом образуется желтый осадок фосфата серебра.
2. Нерастворимые фосфаты растворяются под действием сильных кислот, либо под действием фосфорной кислоты.
Например , фосфат кальция реагирует с фосфорной кислотой с образованием дигидрофосфата кальция:
Фосфат кальция растворяется под действием серной кислоты:
3. За счет фосфора со степенью окисления +5 фосфаты проявляют слабые окислительные свойства и могут взаимодействовать с восстановителями.
Например , фосфат кальция при сплавлении реагирует с углеродом с образованием фосфида кальция и угарного газа:
Фосфат кальция также восстанавливается алюминием при сплавлении:
4. Гидрофосфаты могут взаимодействовать и с более сильными кислотами, и с щелочами . Под действием фосфорной кислоты гидрофосфаты переходят в дигидрофосфаты.
Например , гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
Под действием едкого кали гидрофосфат калия образует более среднюю соль — фосфат калия:
5. Дигидрофосфаты могут взаимодействовать с более сильными кислотами и щелочами , но не реагируют с фосфорной кислотой.
Например , дигидрофосфат натрия взаимодействует с избытком гидроксида натрия с образованием фосфата:
📽️ Видео
Фосфор и его соединения: химические свойства #фосфор #химшкола #неметаллы #егэхимияСкачать

Фосфор и его соединения. Видеоурок 32. Химия 9 классСкачать

взаимодействие белого фосфора со щелочью (В.В.Загорский)Скачать

Взаимодействие безводной азотной кислоты с фосфоромСкачать

Взаимодействие хлора с фосфоромСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Фосфор. 9 класс.Скачать

9 класс. Урок 6. Оксиды фосфора.Скачать