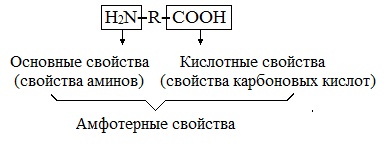
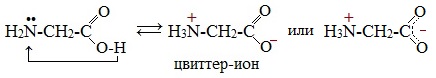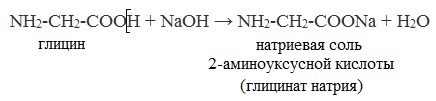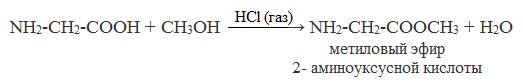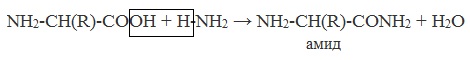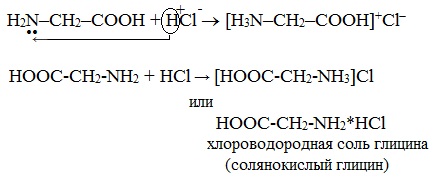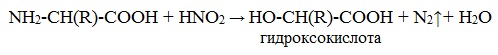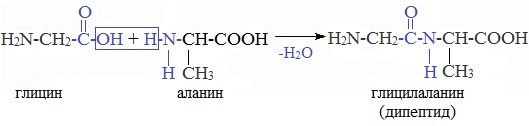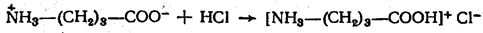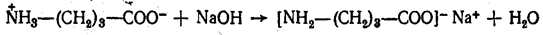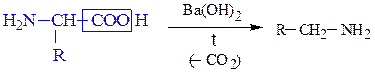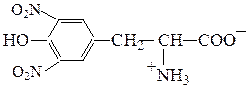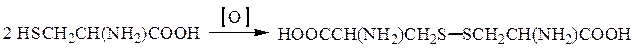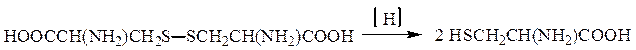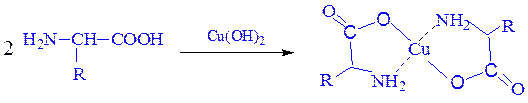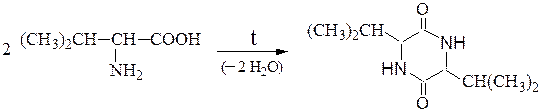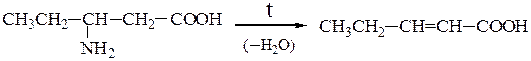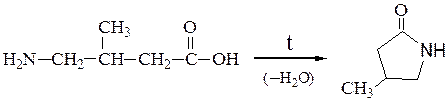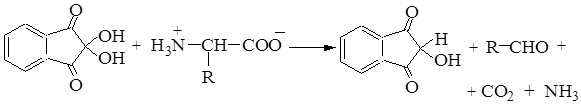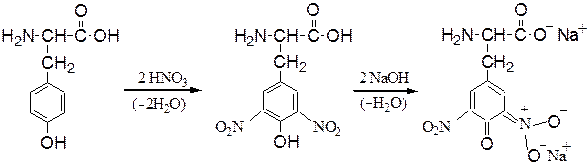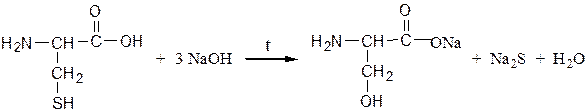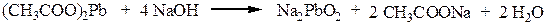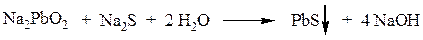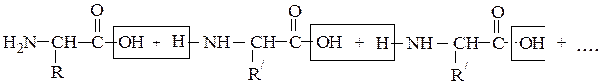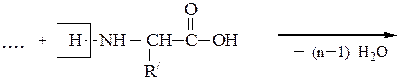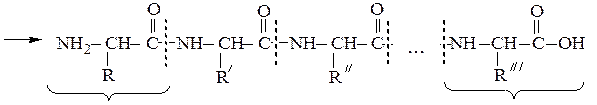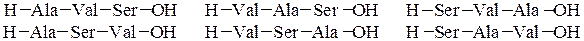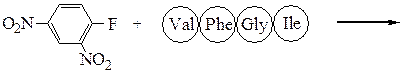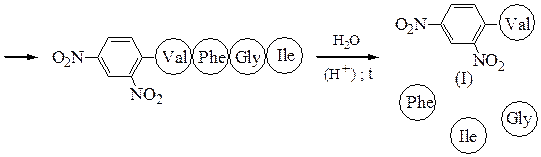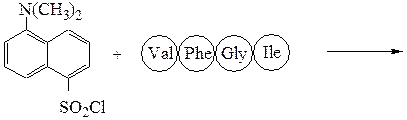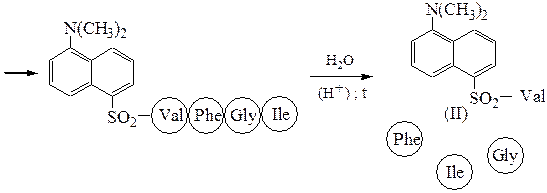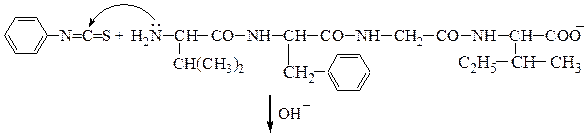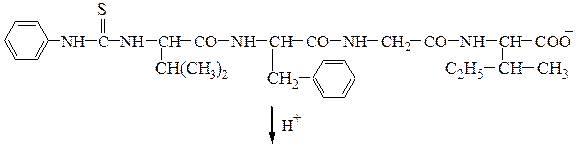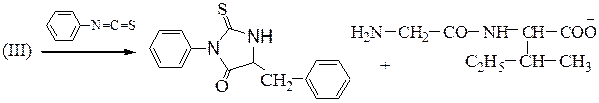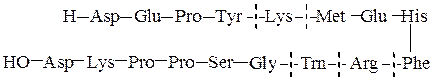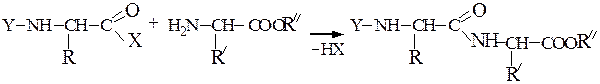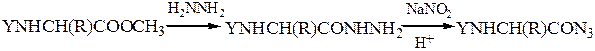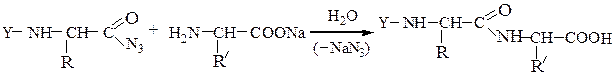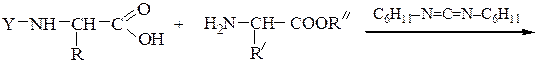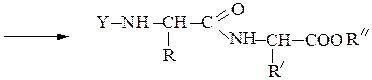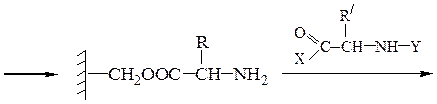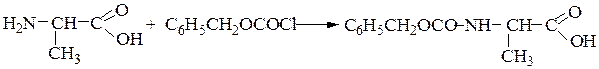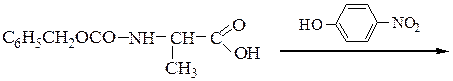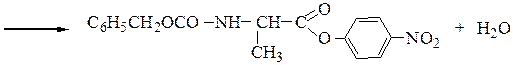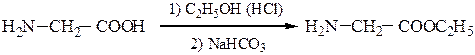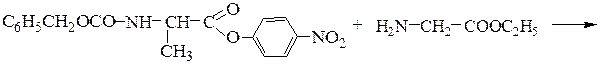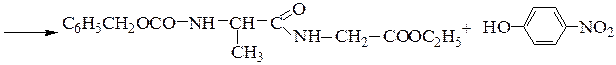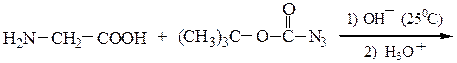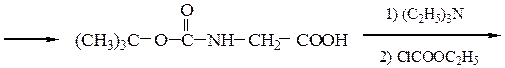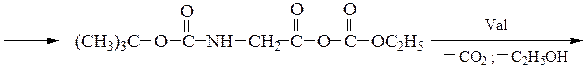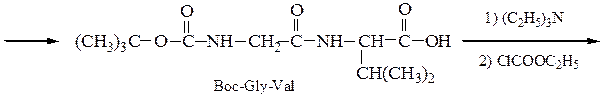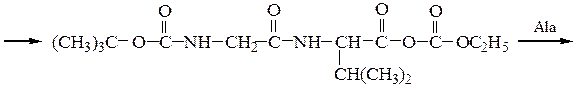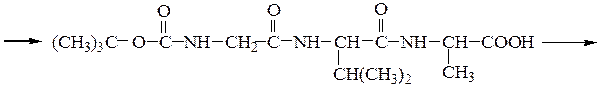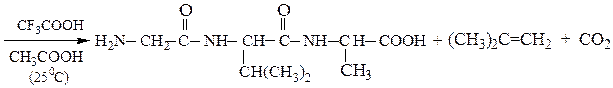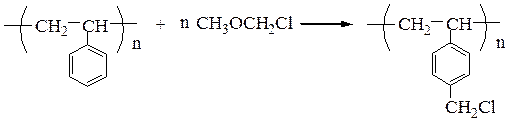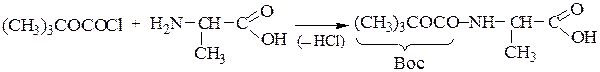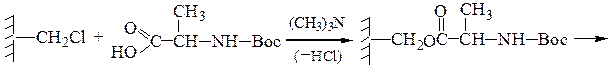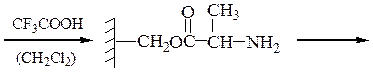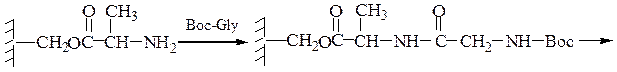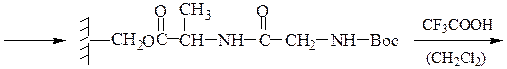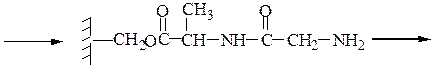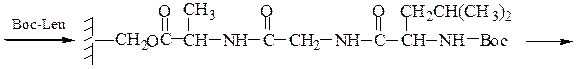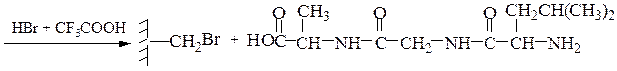Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Химические свойства аминокислот
- 3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
- Амины
- Общие особенности строения аминов
- Химические свойства предельных аминов
- Взаимодействие с кислотами
- Взаимодействие с галогеналканами
- Химические свойства анилина
- Взаимодействие анилина с кислотами
- Взаимодействие анилина с галогенами
- Взаимодействие анилина с азотистой кислотой
- Реакции алкилирования анилина
- Получение анилина
- Химические свойства аминокислот
- Кислотные свойства аминокислот
- Образование солей с щелочами и карбонатами щелочных металлов
- Этерификация аминокислот
- Основные свойства аминокислот
- Образование внутренних солей аминокислот в водном растворе
- Получение аминокислот
- 📽️ Видео
Кислотно-основное равновесие в водных растворах
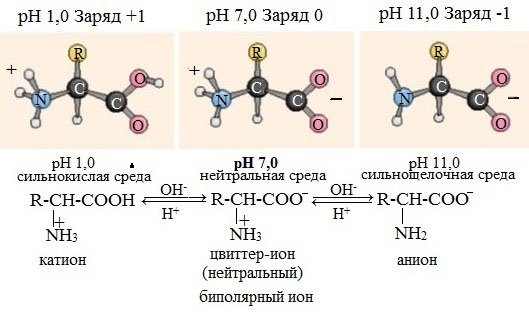
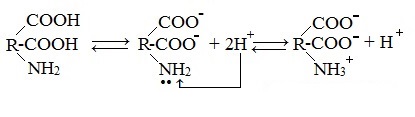
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
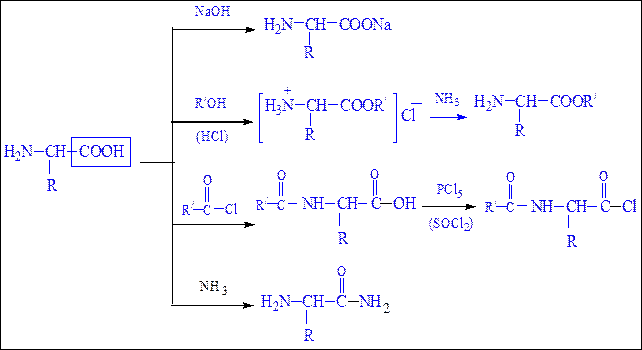
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
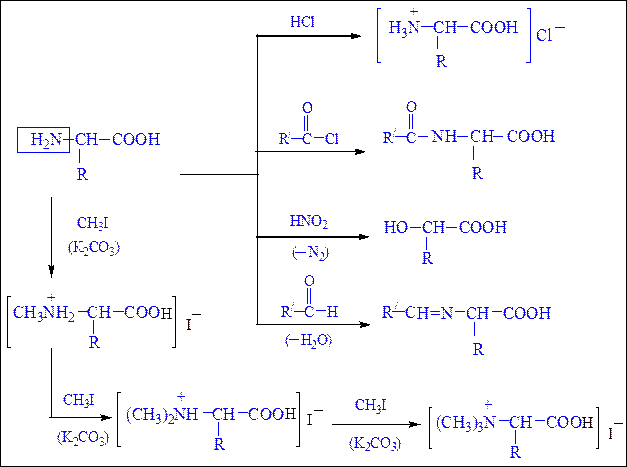
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
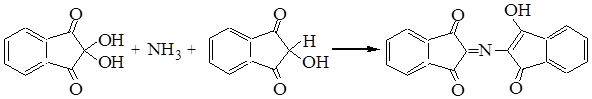
5. Качественные реакции!
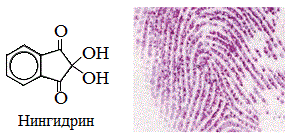
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
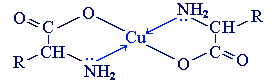
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Химические свойства аминокислот
Химическое поведение аминокислот определяется двумя функциональными группами -NН2 и –СООН. Аминокислотам характерны реакции по аминогруппе, карбоксильной группе и по радикальной части, при этом в зависимости от реагента взаимодействие веществ может идти по одному или нескольким реакционным центрам.
Амфотерный характер аминокислот.Имея в молекуле одновременно кислотную и основную группу, аминокислоты в водных растворах ведут себя как типичные амфотерные соединения. В кислых растворах они проявляют основные свойства, реагируя как основания, в щелочных – как кислоты, образуя соответственно две группы солей:
Реакции, обусловленные карбоксильной группой.При участиикарбоксильной группы аминокислоты образуют cоли, сложные эфиры, амиды, хлорангидриды в соответствии со схемой 24, представленной ниже:
Схема 24. Реакции аминокислот по карбоксильной группе.
Реакции, обусловленные аминогруппой.С участием аминогруппы аминокислоты образуют аммониевые соли с кислотами, ацилируются, алкилируются, реагируют с азотистой кислотой и альдегидами в соответствии со схемой 25 (с. 296).
Если при a-углеродном атоме в радикале имеется электроноакцепторный заместитель (-NO2, -СС13, -СООН, -COR и т.д.), поляризующий связь С-СООН, то у карбоновых кислот легко протекают реакции декарбоксилирования. Декарбоксилирование a-аминокислот, содержащих в качестве заместителя + NH3-группу, приводит к образованию биогенных аминов. В живом организме данный процесс протекает под действием фермента декарбоксилазы и витамина пиридоксальфосфата. В лабораторных условиях реакцию осуществляется при нагревании a-аминокислоты в присутствии поглотителей СО2, например, Ва(ОН)2.
Схема 25. Реакции аминокислот по аминогруппе.
При декарбоксилировании b-фенил-a-аланина, лизина, серина и гистидина образуются, соответственно, фенамин, 1,5-диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и триптамин.
Реакции аминокислот с участием боковой группы. При нитровании аминокислоты тирозин азотной кислотой происходитобразованиединитропроизводного соединения, окрашенного в оранжевый цвет (ксантопротеиновая проба):
Окислительно-восстановительные переходы имеют место в системе цистеин – цистин:
В некоторых реакциях аминокислоты реагируют по обеим функциональным группам одновременно.
Образование комплексов с металлами.Почти все a-аминокислоты образуют комплексы с ионами двухвалентных металлов. Наиболее устойчивыми являются комплексные внутренние соли меди (хелатные соединения), образующиеся в результате взаимодействия с гидроксидом меди (II) и окрашенные в синий цвет:
Отношение аминокислот к нагреванию.При нагревании аминокислоты разлагаются с образованием различных продуктов в зависимости от их типа.
При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды — дикетопиперазины:
При нагревании b-аминокислот от них отщепляется аммиак с образованием α,β-непредельных кислот с сопряженной системой двойных связей:
Нагревание g- и d-аминокислот сопровождается внутримолекулярной дегидратацией и образованием внутренних циклических амидов – лактамов:
Аналитически реакции.Для идентификации отдельных a-аминокислот, входящих в состав белков, применяются универсальные и специфические цветные реакции. К универсальным цветным реакциям относится нингидриновая реакция; к специфическим, которые обусловлены присутствием отдельных аминокислот, – ксантопротеиновая, Миллона, Фолина и т.д. Некоторые из цветных реакций положены в основу количественного определения аминокислот и белков.
Нингидриновая реакция.При нагревании белка с водным раствором нингидрина выделяется СО2 и NH3. Нингидрин при этом восстанавливается, a-аминокислота окисляется с образованием альдегида. Восстановленный нингидрин взаимодействует с аммиаком и гидратом трикетогидриндена с образованием соединения сине-фиолетового цвета (краситель Руэмана):
Цветная реакция предназначена для обнаружения a-аминокислот, используется для идентификации аминокислот при разделении на хроматограммах (бумага, тонкий слой) и при спектрофотометрическом определении на аминокислотных анализаторах (продукт поглощает свет в области 550 – 570 нм).
Ксантопротеиновая реакция – цветная качественная реакция на белки, содержащие остатки a-аминокислот с ароматическими или гетероцикличес-кими радикалами (Phe, Tyr, Trp). Реакция заключается в появлении желтой окраски при обработке белка (или пептида) концентрированной азотной кислотой, что обусловлено образованием окрашенных нитросоединений, которые в щелочной среде превращаются в оранжевые соли хиноидной структуры:
Реакция Эрлиха.Метод обнаружения триптофана или его остатков в белках или пептидах взаимодействием с 4-(N,N-диметиламино)бензальдегидом и концентрированной HCl, приводящим к образованию фиолетовой окраски:
Реакция Фоля.Реакция показывает присутствие в белках аминокислот – цистеина и цистина, содержащих слабосвязанную серу (сульфгидрильная проба). Метионин, практически не вступает в реакцию, так как сера в нем прочно связана. При кипячении раствора серосодержащего белка или аминокислоты с реактивом Фоля под действием щелочи образуется черный осадок. При кипячении в водном растворе щелочи вначале образуется Na2S:
Ацетат свинца реагирует со щелочью с образованием плюмбита натрия:
Затем сульфид натрия с плюмбитом дает черный или темно-коричневый осадок сульфида свинца:
Аргининможет быть обнаружен по образованию труднорастворимых солей с пикриновой, фосфорномолибденовой кислотой или по появлению розовой окраски с a-нафтолом или гипобромитом натрия NaOBr (реакция Сакагучи).
Например, пентапептид Н-Gly-Phe-Val-Туг-Met-ОН вступает в биуретовую, ксантопротеиновую и сульфгидрильную реакции.
ПЕПТИДЫ
Они представляют собой соединения, построенные из остатков α-амино-кислот, соединенных пептидной связью –СО–NH– Формально образование пептидной цепи из n молекул a-аминокислот можно представить так:
N-концевая аминокислота С-концевая аминокислота
При полном гидролизе разрываются все пептидные связи и образуются смеси a-аминокислот. Из п предметов можно составить п ! сочетаний при условии, что каждый из них встречается в любом сочетании только один раз. Из трех различных аминокислот (например, Ala, Val и Ser) можно составить 6 трипептидов, в которых каждая аминокислота встречается лишь один раз:
Пептидная цепь состоит из чередующихся пептидных и метиновых групп, которые связаны с боковыми радикалами аминокислот. Аминокислотный остаток со свободной аминогруппой на одном конце цепи называют N- концевым, а аминокислотный остаток со свободной карбоксильной группой – С – концевым. Для обнаружения пептидной природы органических соединений используется биуретовая реакция, которая проводится в щелочной среде с водным раствором солей меди (ІІ), при этом образуется хелатный комплекс сине-фиолетового цвета. Максимум поглощения продуктов лежит в области от 540 до 560 нм, что используется для количественного и качественного определения белков в биологических объектах, например, в сыворотке крови.
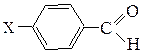
Аминокислотная последовательностьПервичную структуру определяют постадийным гидролизом пептидных связей и отщеплением остатков аминокислот одной от другой с одного и того же конца. Для гидролиза одной пептидной связи проводят ее активацию введением в N-концевой амино-кислотный остаток электроноакцепторного заместителя. Отщепленную аминокислоту идентифицируют, для чего вводят заместители-«метки», поглощающие в УФ-области спектра (при 265-270 нм), например 2.4-динитро-фторобензол (метод Сенгера), 5-диметиламинонафталин-1-сульфонилхлорид (метод Хартли и Грея) или фенилизотиоцианат (метод Эдмана). Производные N-концевого аминокислотного остатка (I)-(IV) идентифицируют также методами хроматографии.
Метод Сенгера:
Метод Хартли и Грея:
производное валина (III)
производное фенилаланина (IV)
С-концевую аминокислоту можно определить методом Акабори: при нагревании пептида с гидразином при температуре 110 0 С пептидные связи гидролизуются с образованием гидразидов аминокислот. С-концевая аминокислота освобождается в свободном виде и может быть выделена из реакционной смеси и идентифицирована.
С-концевую аминокислоту можно также индентифицировать, подвергая полипептид гидролизу с помощью фермента карбоксипептидазы, специфически разрывающий С-концевую амидную связь.
Полезную информацию о порядке соединения аминокислотных остатков в пептиде можно получить из того, что разрушение пептидных связей под действием ферментов, называемых протеазами, протекает избирательно. Так, химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматических α-аминокислот (Туr, Phe, Trp), трипсин гидролизует связи, образованные карбоксильными группами основных α-аминокислот (Lys, Arg); термолизин расщепляет пептидные связи, включающие аминокислотные остатки с гидрофобной боковой цепью (Ile, Leu, Val, Phe, Tyr, Trp). Обрабатывая полипептид, таким образом можно расщепить его на небольшие фрагменты, в которых концевые группы могут быть определены, например, по методу Эдмана. Ниже приводится пример гидролиза:
химотрипсин трипсин химотрипсин
На основании имеющейся информации о фрагментах пептидных цепей можно установить полную аминокислотную последовательность в пептиде:
Синтез пептидов заключается в образовании пептидной связи между СООН-группой одной аминокислоты и a-NН2-группой другой аминокислоты. В соответствии с этим различают карбоксильный и аминный компоненты пептидного синтеза. Удлинение пептидной цепи проводят последовательно, присоединяя поочередно по одной аминокислоте. При проведении направленного синтеза пептидов необходима временная защита функциональных групп, не участвующих в образовании пептидной связи, и активация одного из компонентов пептидного синтеза. После окончания синтеза защитные группы удаляют.
Образование пептидных связей происходит в реакции между N-защищенной аминокислотой (защищена аминогруппа) или ее производным и аминокислотой в виде соли или сложного эфира (О-защищенная аминокислота):
N-защищенная группа обычно представлена алкоксикарбонильной группой [Y= C6H5CH2OCO-, (СНз)зСОСО-]. Такие соединения получаются при взаимодействии аминокислоты с хлоругольными эфирами R-OCOC1. Для этой цели используют также ацильные группы: формильную (НСО-), трифторацетильную (СFзСО-), п-толуолсульфонильную (тозильную), фталильную и др., а также тритильную (СбН5)3С- . Для реакции образования пептидной связи N-защищенную a-аминокислоту часто активируют, превращая в хлорангидрид (X = С1), активированный эфир (например, п-нитрофениловый, X = -О-С6Н4-NO2-n) или азид (X = N3). Исходный азид получают по схеме:
Данный метод удобен тем, что реакцию можно проводить в воде с солью аминокислоты:
Реакцию N-защищенных аминокислот с О-защищенными можно осуществлять непосредственно в присутствии, например, карбодиимидов:
Снятие третбутилокси- или бензилоксикарбонильной группы осуществляют в мягких условиях — гидролизом в присутствии CF3COOH. Тритильную защиту снимают гидрированием.
Твердофазный синтез пептидов (метод Мерифильда). Наращивание пептидной цепочки осуществляют на поверхности полимера, содержащего активные группы: СН2С1, СН2ОН. N-Защищенная аминокислота «привязывается» к нему сложноэфирной связью. Следуют отщепление защитной группы, образование пептидной связи с другой молекулой N-защищенной аминокислоты, отщепление защитной группы и т. д. После наращивания цепи достаточной длины полипептид отщепляют от носителя действием смеси НВг + CF3COOH.
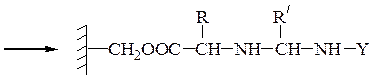
Пример 1:синтез дипептида Н-Ala-Gly-ОН
1-й этап — защита аминогруппы a-аланина ацилированием карбобенз-оксихлоридом:
2-й этап — активирование карбоксильной группы N-защищенного a-
аланина переводом его в п-нитрофениловый эфир:
3-й этап — блокирование карбоксильной группы глицина переводом ее в метиловый эфир:
4-й этап — синтез защищенного по обоим концам дипептида взаимодействием n-нитрофенилового эфира N-карбобензокси-a-аланина с этиловым эфиром глицина:
5-й этап — снятие защит (например, гидролизом в относительно мягких условиях, не допускающих разрушения пептидной связи).
Пример 3: Н-Leu-Gly-Ala-ОН (твердофазный синтез Меррифильда)
Для этого используют полимерный носитель, получаемый обработкой полистирола метил(хлорметиловым) эфиром:
1-й этап — получение ВОС- защищенного аланина:
2-й этап — «привязывание» ВОС-аланина к хлорметилированному полистиролу:
3-й этап — промывание водой и удаление защитной группы:
4-й этап — промывание водой и добавление ВОС-глицина (см. 1-й этап):
5-й этап — промывание водой и снятие защитной группы:
6-й этап — промывание водой и добавление ВОС-лейцина (см. 1-й этап:)
7-й этап — удаление ВОС-группы, промывание водой и снятие пептида с полимера:
Уровни структурной организации белков.По предложению К.У.Линдерстрема-Ланга, различают четыре уровня организации белковых молекул – первичную, вторичную, третичную и четвертичную структуры. Последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой. Ее мы рассмотрели в курсе классической органической химии. Термин «вторичная структура» относится к типу укладки полипептидных цепей. Наиболее часто встречающиеся типы – правая α-спираль и β-складчатая структура за счет образования водородных связей и прочих взаимодействий (см. рис.10, с. 309). Под третичной структурой белка понимается расположение белковой полипептидной цепи в пространстве. Термин «четвертичная структура» относится к белкам, в состав которых входит несколько полипептидных цепей (субъединиц), не связанных между собой ковалентно; эта структура отражает характер взаимного расположения субъединиц в пространстве. Структуры, свойства и функции белков будут подробно рассмотрены в курсе биохимии.
Контрольные вопросы к главе 18 «Аминокислоты и белки»
№ 1Составьте схемы синтеза валина и b-фенил-α-аланина при помощи следующих методов: (а) из кетокислот восстановительным аминированием; (б)
Рис. 10. Вторичная структура белка: α-спираль (а), b-складчатая структура (б)
методом Штреккера; (в) используя реакцию фталимида калия с бром-алкилмалоновым эфиром; (г) алкилированием аминомалонового эфира;
№ 2.Какую надо выбрать стратегию, чтобы превратить глутаминовую кислоту в глутамин?
№ 3.Какой рН имеют водные растворы следующих соединений: (а) хлоргидрата этилового эфира валина; (б) глицина; (в) хлоргидрата аланина; (г) лизина; (д) аспарагиновой кислоты; (е) аспарагина. Что такое изоэлектрическая точка аминокислоты? Что такое электрофорез?
№ 4. Напишите уравнения реакций глицина со следующими реагентами: (а) хлористым бензоилом; (б) азотистой кислотой; (в) ангидридом трифторуксусной кислоты; (г) хлороводородом; (д) формальдегидом; (е) гидроксидом меди (II); (ж) метанолом (в присутствии HCI).
№ 5.Три изомерных аминокислоты А, Б и В с молекулярной формулой С5Н11O2N при нагревании превращаются в соединения А’, Б’ и В’. Вещество А’ – диизопропильное производное дикетопиперазина; образование продукта Б’ сопровождается выделением газа; озонолиз Б’ дает глиоксалевую кислоту и пропаналь. Вещество В’ представляет собой γ-лактам (γ-метилпирролидон).
Каково строение аминокислот А, Б и В?:
№ 6.Как различить валин и N-метилвалин?
№ 7.Напишите структурную формулу антибиотика грамицидина С, имеющего макроциклическое полипептидное строение:
Val — Orn — Leu — Phe — Pro
Pro — Phe — Leu — Orn — Val Какие вещества и в каком соотношении
образуются в результате полного гидролиза (24 ч., 2 н НСl, 100 0 C)?
№ 8.Какие Вы знаете уровни организации белков?
№ 9.Какие методы защиты амино- и карбоксильных групп Вы знаете? Используя их, синтезируйтедипептид: H-Val-Glу-OH
№ 10. Какие качественные реакции (биуретовую, ксантопротеиновую, Фоля, Милона, Эрлиха) дает пентапептид: H–Ala–Pro–Val–Tyr–Gly–OH ? Напишите структурную формулу пентапептида.
ЛИТЕРАТУРА
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб.:
Иван Федоров, 2002.
2. Ким А.М. Органическая химия. – Новосибирск: Сибирское
университетское изд-во, 2001.
3. Травень В.Ф. Органическая химия: в 2 т. – М.: Академкнига, 2005.
4. Шабаров Ю.С. Органическая химия. – М.: Химия, 1999.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии: в 2 т. – М.:
6. Моррисон Р., Бойд Р. Органическая химия. – М.: Мир, 1974.
7. Робертс Д., Касерио М. Основы органической химии: в 2 т. – М.: Мир, 1968.
8. Сайкс П. Механизмы органических реакций. – М.: Химия, 1991
9. Овчинников Ю.А. Биоорганическая химия. – М.: Просвещение, 1987.
10. Янковский С.А., Данилова Н.С. Задачи по органической химии. – М.:
СОДЕРЖАНИЕ
1. Предельные углеводороды. Алканы и циклоалканы ………………… ..5
3. Диеновые углеводороды………………………………………………… 38
5. Арены (ароматические углеводороды)…………………………………. 55
6. Галогенопроизводные углеводородов…………………………………..77
7. Магнийорганический синтез………………………………………… ..101
12. Карбоновые кислоты и их производные………………………………162
15. Органические соединения азота………………………………………..216
16. Органические соединения серы………………………………………. 233
18. Аминокислоты и пептиды………………………………………………286
ОТВЕТЫ НА КОНТРОЛЬНЫЕ ЗАДАНИЯ
1
№ 3. (а) При сгорании 14,4 г алкана образовалось 22,4 л СО2. Какой объем кислорода (л, н.у.) потребуется? (б)Для сжигания 5 л нормального алкана потребовалось 40 л кислорода (н.у.). Установите, какой углеводород сожгли. (в)При сгорании 11,2 л смеси метана и этана получено 13,44 л. (н.у.) СО2. Рассчитайте объемную долю (%) метана в исходной смеси. (г) Газ, образовавшийся при полном сгорании 0,02 моль алкана, пропустили через избыток известковой воды; при этом выпало 12 г осадка. Определите молекулярную формулу алкана.
№ 4.(а)Выведитемолекулярную формулу алкана, если при хлорировании 1,28 г его на свету было получено 6,84 г дихлорпроизводного. (в) Определите молекулярную формулу бромпроизводного пропана, в 4,04 г которого содержится 3,2 г брома.
№ 6. Углеводороды н-гексан и гексен-3 имеют близкие температуры кипения. Как очистить химическим путем: а) н-гексан от примеси гексена-3; б) гексен-3 от примеси н-гексана?
№ 10. Предложите схемы синтеза: (в)гексадиена-2,4 из аллилового спирта.
№ 1. Почему в случае присоединения хлороводорода к бутадиену-1,3 образуется смесь 3-хлорбутена-1 и 1-хлорбутена-2, в которой преобладает второе из названных соединений.
№ 2. При 1,4-присоединении хлороводорода к 2-метилбутадиену-1,3 (изопрену) в качестве основного продукта образуется 1-хлор-3-метилбутен-2, а не 1-хлор-2-метилбутен-2. Почему ?
№ 3. Какой из диенов – бутадиен-1,3 , изопрен (2-метилбутадиен-1,3) или пиперилен (пентадиен-1,3) при взаимодействии с 1 моль бромоводорода при 25 0 С дает только один продукт?
№ 5. При термической полимеризации бутадиена-1,3 в качестве побочного продукта образуется циклический димер, не склонный к дальнейшей полимеризации. Это вещество при гидрировании дает этилциклогексан; способно присоединять 2 моль брома; в результате деструктивного окисления образует 3-карбоксигександиовую кислоту. Какое строение имеет молекула димера бутадиена-1,3?
№ 7. Из каких реагентов можно получить следующие соединения по реакции Дильса—Альдера: 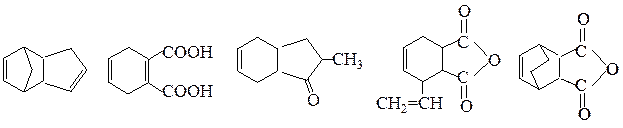
№ 3. Напишите схемы синтеза следующих соединений, используя неорганические реагенты: (а) бутанона-2 из 1-бромбутана; (б) акрилонитрила из 1,2-дибромэтана; (в) мезитилена (1,3,5-триметилбензола) из пропанола-1; (г) 1,1,2,2,3,4-гексабромбутана из ацетилена; (д) поливинилацетата из ацетилена.
№ 6. Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях SE и укажите продукты реакций:
(а) нитрования бензойной кислоты, о-сульфобензойной кислоты, фенола, резорцина; (б) ацилирования хлористым пропионилом бензола, п-крезола, толуола, нитробензола; (в) сульфирования фенола, гидрохинона, нитробензола, п-нитротолуола; (г) бромирования бензола, м-ксилола, м-динитробензола, п-нитроизопропилбензола, м-толуидина.
№ 7. Для каждого из соединений укажите, какое кольцо будет затрагиваться при нитровании и приведите структурные формулы основных продуктов реакции:
6.
№ 7.Из ацетилена получите: (а) 2,3-дибромбутан; (б) 1,2-дибромбутен-2;
№ 3.Предложите схемы синтеза спиртов, используя химические свойства реактивов Гриньяра: (а) метилдиэтилкарбинола из этанола; (б) метилдиэтил-карбинола из этанола; (в) 3,3-диметилбутанола-1 из изобутилена и этилена; (г) диметилизопропилкарбинола из пропилена.
№ 4.Предложите схему синтеза кислот, используя химические свойства реактивов Гриньяра: (а) циклопентанкарбоновой кислоты из циклопентана; (б) 2-метилбутановой кислоты из бутена-1; (в) п-толуиловой кислоты из толуола; (г) 1-нафтилуксусной кислоты из нафталина.
№ 5.Предложите схемы синтеза соединений, меченых радиоактивными изотопами: (а) изомасляной (1- 14 С) кислоты (СН3)2СН 14 СООН из пропилена и Са 14 СО3; (б) дейтеротолуола С6H5CH2D из толуола и тяжелой воды; (в); 3-дейтеропропилена-1 CH2=CH-CH2D из хлористого аллила и D2O; (г) гексадейтеробензола из ацетилена и тяжелой воды.
№ 4. Какие продукты образуются при раскрытии эпоксидного цикла окиси изобутилена при действии метилатом натрия и метанола в кислой среде?
Глава 1. № 1.17; № 2. этан; № 4 (б) С3H7Br; № 7. 10; № 8.бромирование, затем р. Вюрца;№ 9. 2,2-диметилпропан (А), пентан (Б), 2-метилбутан (В); № 10. (а)2,2,3,3-тетраметилбутан; (б) 2,5-диметилгексан; (в) 3,4-диметилгексан.
Глава 2. № 1.84 %;№ 5.ClCH2-CH2Cl (A), CH2=CHCl (Б), СlCH2-CHCl2 (B), СlCH=CHCl (Г); Cl2CH-CHCl2 (Д); ClCH=CCl2 (Е); Cl2CH-СCl3 (Ж); Cl2C=CCl2 (З);№ 9. (а)2-метилбутан; (б)пентен-2;(в)пентадиен-1,4;(г)2-метилбутен-2; (г) циклогексадиен-1,3; № 10. (а)присоединяют, а затем отщепляют хлороводород; (б)дегидратация гексанола-1 в гексена-1, затем бромирование с последующим дегидробромированием действием водно-спиртовым раствором KOH;(г)аллильное хлорирование пропилена, затем р. Вюрца;(д)внутримолекулярная дегидратация спирта, затем бромирование алкена по Волю-Циглеру.
Глава 4. № 4. (а)4-метилгексин-1; (б)5-метилгексин-1;(в)гексин-3;(г)4-метилпентин-1;(д)винилацетилен;№ 5. (а)бромной водой; (б), (г) и (д)аммиакатом серебра;(в)малеиновым ангидридом.
Глава 5. № 1.(I), (II), (IV), (V), (VI);№ 5.толуол, этилбензол, изопропилбензол, третбутилбензол;№ 9. (а)алкилированием бензола изобутиленом получают третбутилбензол и обрабатывают нитрующей смесью; (б)бензол алкилируют пропиленом до изопропил-бензола и нитруют по Коновалову; (в)толуол окисляют в бензойную кислоту, которую нитруют;(г)изопропилбензол хлорируют в прис. AlCl3 продукт окисляют;(д)хлорируют на свету, затем р. Вюрца;(е)циклотримеризация ацетилена, нитрование, бромирование;(ж)нафталин нитруют, затем окисляют; № 10. (а)1-метил-3-этилбензол;(б)п-нитроэтилбензол;(в)винилбензол (г) фенилацетилен; (д) 1,3,5-триметилбензол; (е) 4-нитро-1-бромнафталин.
Глава 6. № 3.подвижность брома уменьшается в ряду: 4-бром-2-метилбутен-2, 5-бром-2-метилпентан, 3-бром-2-метилпентен-2; № 4.(а) 1,1-гексаналь; (б) октанон-2; (в) пентан-диол-2,3; (г) п-хлорбензойная кислота; (д) бутен-2-ол-1 и бутен-3-ол-2; (е) 3-метилцикло-пентанол-1; № 7. (в) гидратация ацетилена дает ацетальдегид, а его восстановление — этанол; cпирт превращают в бутадиен по Лебедеву и бромируют; (г) продукт димеризации ацетилена — винилацетилен обрабатывают избытком хлора.
Глава 7. № 1.йодистый метил,бромистый этил, хлористый бутил, бромистый винил, йодбензол, хлорбензол; № 6. изопропилмагнийгалогенид; № 7. CH3(CH2)2CH(C2H5)-MgBr; № 8. этилмагнийгалогенид
Глава 8. № 1.
Глава 9. № 1. примесь алкена удаляют из простого эфира промыванием серной кислотой; уменьшить выход продукта межмолекулярной реакции (простого эфира) можно разбавлением реакционной массы растворителем; при этом увеличивается выход продукта внутримолекулярной реакции (алкена); № 3. взаимодействие изопропилата натрия с йодистым метилом дает выше выход простого эфира, т.к. не будет примеси алкена jn дегидрогалогенирования галогеналкана под действием основания (алкоголята); № 4. получают этилен и далее окись этилена, которую гипохлорируют и полученный 2-хлорэтанол подвергают дегидратации; № 6. (а)этилизопентиловый эфир;(б)п-СH3O-С6Н4-СН=СН-СН3 и п-СH3O-С6Н4-СН2-СН=СН2.
Глава 10. № 2. (а) гипохлорируют, обрабатывают сульфидом натрия;(б)этанол реагирует с окисью этилена (2:1); (в)фенол реагирует с окисью этилена (1:2);(г)реакцией окиси этилена с этанолом;(д)с NH3 (1:1) получают этаноламин, в котором ОН замещают на хлор (PСl5), а затем на меркаптогруппу (NaHS).
Глава 11. № 2.(а) метилглиоксаля; (б) трихлоруксусного альдегида; № 3. кеталь из диэтилкетона и метанола; ацеталь из изомасляного альдегида и этиленгликоля; кеталь из пентаэритрита С(СН2ОН)4 и циклопентанона; все вещества гидролизуются до исходных в присутствии кислот, но устойчивы в нейтральной и щелочной средах; № 4.альдегиды, но не кетоны вступают в реакции окисления (с аммиакатом серебра, жидкостью Фелинга), Канниццаро, Тищенко, с фуксинсернистой кислотой; со слабыми нуклеофилами (водой, спиртами) и димедоном обычно реагируют только альдегиды и лишь самые активные кетоны; № 5. валериановый альдегид отличают от кетонов реакциями с аммиакатом серебра и жидкостью Фелинга, а метилпропилкетон от диэтилкетона — йодоформной реакцией; № 7. реакция Канниццаро; № 9. (а)этанол окисляют в уксусную кислоту, получают кальциевую соль и подвергают ее пиролизу; (б)действием PCl5 получают 2,2-дихлорпентан и дегидрохлорируют и спиртовым раствором КОН; (в), (г)бутен-2 окисляют по Вагнеру в бутандиол-2,3 и далее в бутандион-2,3, затем действуют избытком гидроксиламина; (д) восстанавливают продукт альдольной конденсации бутаналя; № 10. (а) 3-метилбутаналь; (б)м-этилбензальдегид;(в)коричный альдегид;(г)метилфенилкетон;(д)п-толуиловый альдегид.
№ 1. Напишите уравнения реакций нуклеофильного присоединения по карбонильной группе. Какое из соединений будет более активно в реакциях AN и почему: (а) формальдегид, уксусный альдегид, ацетон; (б) пропионовый альдегид, a-хлорпропионовый альдегид, ацетон, хлораль С13С-СНО; (в) альдегиды ароматического ряда общей формулы
(где Х=Н, NO2, CH3)? В чем суть кислотного катализа в этих реакциях?
№ 9.пентина-2 из пентанона-2; (в) 1,6-дихлоргексана из циклогексена;
Видео:Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Видео:Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
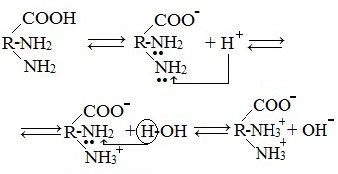
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Видео:Медь и азотная кислота 🧑🔬Скачать

Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Видео:Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Видео:Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Основные свойства аминокислот
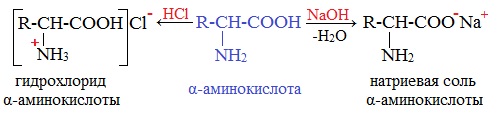
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
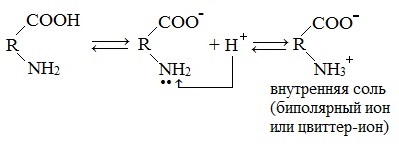
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
📽️ Видео
Азотная кислота. Физические и химические свойства. 9 класс.Скачать

реакция меди с азотной кислотойСкачать

ХИМИЯ 11 класс: Взаимодействие серной и азотной кислоты с металламиСкачать

Взаимодействие меди с концентрированной азотной кислотой - 9 - 11 классСкачать

Реакции металлов с азотной кислотой. Химический опытСкачать

Азотная кислота. 11 класс.Скачать

ОГЭ/ЕГЭ/Соли азотной кислоты/общие свойства с другими солями/Скачать

Химия 9 класс: Азотная кислотаСкачать

Взаимодействие H2SO4 и HNO3 с металлами. Характерные свойства кислот. ЕГЭ по ХимииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакция меди с азотной кислотой. Химический опытСкачать

Лабораторная работа №13. Свойства азотной кислоты. 9 класс.Скачать

Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать