Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
- Реакция взаимодействия карбида кремния и алюминия
- Реакция взаимодействия карбида кремния и алюминия
- Реакции алюминия
- Реакция взаимодействия оксида железа (II,III) и азотной кислоты
- Реакция термического разложения селенита серебра (I)
- Реакция взаимодействия гидроксида кальция и гипохлорита натрия
- Выбрать язык
- Популярные записи
- Предупреждение.
- Вопрос 29. Алюминий, кремний и их соединения как важнейшие составляющие неорганических вяжущих материалов
- 📺 Видео
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
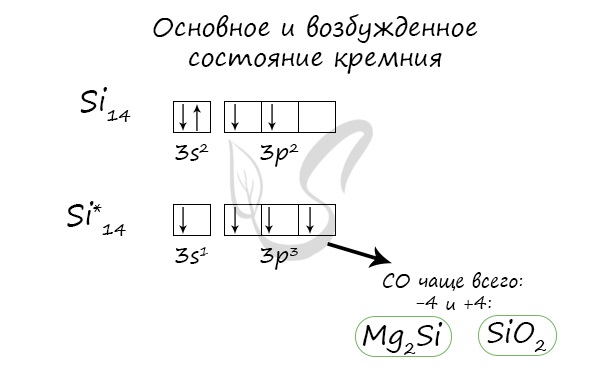
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
Реакция с щелочами
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
- Реакции с кислотами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
Реакции с основными оксидами и щелочами
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Взаимодействие алюминия с водойСкачать

Реакция взаимодействия карбида кремния и алюминия
Видео:Химическая реакция йода и алюминия.Скачать

Реакция взаимодействия карбида кремния и алюминия
Уравнение реакции взаимодействия карбида кремния и алюминия:
Реакция взаимодействия карбида кремния и алюминия.
В результате реакции образуются карбид алюминия и кремний.
Реакция протекает при условии: при высокой температуре.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции алюминия
Реакции алюминия с веществами:
Формула поиска по сайту: 4Al + 3SiC → Al4C3 + 3Si.
Реакция взаимодействия оксида железа (II,III) и азотной кислоты
Реакция термического разложения селенита серебра (I)
Реакция взаимодействия гидроксида кальция и гипохлорита натрия
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вопрос 29. Алюминий, кремний и их соединения как важнейшие составляющие неорганических вяжущих материалов
Вопрос 29. Алюминий, кремний и их соединения как важнейшие составляющие неорганических вяжущих материалов.
Алюминий, его соединения и свойства
Алюминий – самый распространенный металл на Земле. Его массовая доля в земной коре составляет 8%. Алюминий имеет плотность с=2,7 г/см3, температуру плавления Тпл. = 659оС, высокую пластичность и высокую электропроводность. На воздухе покрывается плотной и прочной окисдной пленкой Al2O3.
Основная масса его сосредоточена в виде природных соединений, в которых он связан с кислородом и кремнием, так называемых алюмосиликатов. Алюмосиликаты входят в состав многих горных пород и глин. Другими важными минералами алюминия являются боксит Al2O3∙nH2O, криолит Na3[AlF6], корунд Al2O3.
Получают алюминий из Al2O3 электролитическим способом. Для этого необходим достаточно чистый Al2O3, так как из выплавленного алюминия примеси удалить очень трудно. Оксид Al2O3 не проводит электрического тока и имеет высокую температуру плавления (≈ 2050оС). Поэтому электролизу подвергают расплав оксида алюминия в криолите AlF3∙3NaF, содержащий 10% по массе Al2O3, плавящийся при 950оС и обладающий электропроводимостью.
В расплавленном криолите оксид алюминия диссоциирует на ионы:
Al2O3 ↔ Al3+ + AlO33−
Условия электролиза подбираются такими, чтобы на катоде разряжались катионы Al3+. При этом на аноде будут окисляться ионы AlO33−.
Уравнения электродных процессов:
Al3+ + 3

4AlO33− − 12

4Al3+ + 4AlO33− 4Al + 2Al2O3 + 3O2
2Al2O3 4Al + 3O2
Образующийся кислород сжигает графитовые аноды:
С + O2 = CO2 или 2С + О2 = 2СО
Электронное строение атома алюминия …3s23p1 определяет характерную для него, постоянную степень окисления +3. Химические связи в соединениях алюминия с другими элементами имеют в основном ковалентный характер. Кроме того, в атоме алюминия на внешнем энергетическом уровне имеются свободные d-орбитали, благодаря чему он может образовывать сложные комплексные ионы с координационным числом равным 6, такие как [AlF6]3− или [Al(OH)6]3−.
Алюминий – металл высокой химической активности. На воздухе он пассивируется, то есть покрывается тончайшей, но очень прочной пленкой оксида Al2O3, предохраняющей его от дальнейшего окисления:
4Al + 3O2 = 2Al2O3
вследствие чего поверхность металла имеет матовый вид. Свойствами защитной пленки обладает только одна из полиморфных кристаллических модификаций Al2O3 со структурой корунда, которая не взаимодействует с водой. Эта пленка может быть удалена растворением в кислотах или щелочах, так как Al2O3 проявляет амфотерные свойства:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Образующийся в расплаве щелочи алюминат натрия NaAlO2 в водных растворах образует комплексную соль – тетрагидроксоалюминат натрия Na[Al(OH)4].
Химические свойства алюминия:
1. Взаимодействие с неметаллами
При обычных условиях алюминий реагирует с хлором и бромом; при нагревании реагирует с кислородом, йодом, углеродом, азотом.
2Al + 3Cl2 = 2AlCl3
4Al + 3O2 = 2Al2O3
2. Взаимодействие с водой
Из-за защитной оксидной пленки на поверхности алюминий устойчив в воде. Однако при удалении этой пленки происходит энергичное взаимодействие:
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Взаимодействие с кислотами
Алюминий взаимодействует с хлороводородной и разбавленной серной кислотами:
2Al + 6HCl = 2AlCl3 + 3H2
2Al +H2SO4 = Al2(SO4)3 + 3H2
Азотная и концентрированная серная кислоты пассивируют алюминий: при действии этих кислот увеличивается толщина защитной пленки на металле, и он не растворяется.
4. Взаимодействие со щелочами
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
Реакция со щелочами протекает благодаря легкости растворения в них оксидной пленки.
5. Восстановление оксидов металлов
Алюминий является хорошим восстановителем многих оксидов металлов, например:
2Al + Cr2O3 = Al2O3 + 2Cr
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Применение алюминия и его сплавов
Алюминий применяется как в чистом виде (для изготовления электрических проводов и фольги для конденсаторов), так и в виде сплавов с медью, марганцем, магнием, кремнием, титаном. Легирующие добавки вводят, как правило, для повышения его прочности. Основная масса алюминия идет на изготовление алюминиевых сплавов.
В технике широко распространены дуралюмин (содержит магний и медь), силумин и магналий с кремнием и магнием, соответственно.
Дуралюмины – легкие прочные и коррозионностойкие сплавы. Используются как конструкционный материал в авиа — и машиностроении.
Силумин – сплав алюминия, содержащий кремний. Силумин хорошо подвергается литью, из него можно изготавливать тонкостенные и сложные по форме изделия. Этот сплав используется в автомобиле-, авиа — и машиностроении, производстве точных приборов.
Магналин – сплавалюминия с магнием. Используется в авиа — и машиностроении, в строительстве. Магналин стоек к коррозии в морской воде, поэтому его применяют в судостроении.
Антифрикационные сплавы алюминия с оловом и медью применяются в автомобилестроении для изготовления подшипников коленчатого вала. Основное достоинство конструкционных алюминиевых сплавов – малая их плотность, высокая прочность а расчете на единицу массы, высокая стойкость против атмосферной коррозии, дешевизна и простота обработки. Важной областью применения алюминия является алитирование – насыщение поверхности стальных или чугунных изделий металлическим алюминием для придания им жаростойкости и предохранения от коррозии. Алитированные изделия не окисляются при нагревании до 1000оС.
Смесь порошков алюминия и оксида железа (Fe2O3 или Fe3O4), имеющая название термит, используется для сварки стальных изделий (трубопроводов, рельсов). При горении термитной смеси протекает реакция с большим выделением теплоты:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe, ∆Нo = −1352 кДж
За счет выделяющейся теплоты температура может достигать 3500оС.
Оксид алюминия Al2O3 применяют для получения алюминия, как огнеупорный материал, в производстве керамики. Кристаллический Al2O3 – корунд служит абразивным материалом. Некоторые природные разновидности корунда (рубин, сапфир) являются драгоценными камнями, используются в ювелирном деле.
Криолит Na3[AlF6] применяют для получения алюминия и при изготовлении керамики и эмалей.
Глинозем (оксид алюминия Al2O3) – белый порошок, Тпл. = 2042оС, в воде не растворяется.
Природный минерал корунд (тоже Al2O3) очень твердый, поэтому используется как абразивный и огнеупорный материал.
Глинозем Al2O3 получают термическим разложением гидроксида алюминия:
2Al(OH)3 

В промышленности глинозем получают из бокситов, а также из каолинов. Большая часть глинозема используется для получения алюминия.
Алюминаты – соли слабых кислот. Они подвергаются гидролизу и существуют в растворе в избытке щелочи. При этом возможно образование ортоалюминатов типа K3AlO3.
Водные растворы алюминатов содержат комплексные анионы [Al(OH)4]−, [Al(OH)5]2− и гидроалюминаты [Al(OH)6]3−.
Алюминий встречается в виде соединений, называемых шпинелями.
MgAl2O4 – обыкновенная шпинель;
ZnAl2O4 – цинковая шпинель.
Квасцы являются комплексными соединениями типа MeAl(SO4)2 ∙ 12H2O,
где Ме – К, Na, NH4+.
Алюминаты растворяются в воде по-разному. Алюминаты щелочных металлов хорошо растворимы в воде, у алюминатов щелочноземельных металлов растворимость в воде значительно ниже. Алюминаты содержатся в неорганических вяжущих материалах. Например, трехкальциевый алюминат 3CaO ∙ Al2O3 входит в минералогический состав клинкера портландцемента. Однокальциевый алюминат CaO ∙ Al2O3 является главной составной частью клинкера глиноземистого цемента.
Кремний, его соединения и свойства
Кремний является вторым по распространенности элементов в земной коре (27% по массе).
Кремний образует две аллотропические формы: кристаллическую и аморфную. Кристаллический кремний имеет серо-стальной цвет и металлический блеск. Аморфный кремний представляет собой бурый гигроскопичный порошок, является более реакционноспособным, по сравнению с кристаллическим.
Кремний применяется, главным образом, в металлургии и полупроводниковой технике. В металлургии он используется для удаления кислорода из расплавленных металлов и служит составной частью многих сплавов. Важнейшие из них – сплавы на основе железа, меди и алюминия. В полупроводниковой технике кремний используется для изготовления фотоэлементов, усилителей и выпрямителей.
Электронная формула имеет вид: Si 1s22s22p63s23p2
Обладает полупроводниковыми свойствами.
Кремний может быть выделен восстановлением оксида кремния при высокой температуре такими металлами, как магний или алюминий, а также углеродом.
SiO2 + 2C 

SiO2 + 2Mg → Si + 2MgO
SiCl4 + 2Zn 

Кремний встречается в природе в виде диоксида кремния SiO2 (кремнезема). В природе он встречается как в кристаллическом, так и в аморфном виде.
Кристаллический диоксид кремния (кремнезем) находится в природе в виде песка и кварца. Он очень тверд, нерастворим в воде и плавится при температуре 1610оС, превращаясь в бесцветную жидкость.
Аморфный диоксид кремния распространен в природе гораздо меньше, чем кристаллический. На дне морей имеются отложения тонкого пористого аморфного кремнезема, называемого трепелом.
При сплавлении диоксида кремния с едкими щелочами или карбонатом калия и натрия получаются соли кремниевых кислот:
SiO2 + 2NaOH = Na2SiO3 + H2O
Аморфный кремнезем взаимодействует со щелочами и гашенной известью на холоде. На этом основано применение этих материалов в качестве гидравлических добавок к цементам.
Ca(OH)2 + SiO2 = CaSiO3 + H2O
Na2CO3 + SiO2 = Na2SiO3 + CO2
NaOH + SiO2 = Na2SiO3 + H2O
Кремнезем, находящийся в природе в виде песка, широко применяют в строительстве для производства стекла, керамики и цемента.
Кремнезем (SiO2) и его производные относятся к неорганическим полимерам.
Силикаты чрезвычайно распространены в природе. К природным силикатам относятся полевые шпаты, слюда, глины, асбест, тальк и многие другие минералы. Силикаты входят в состав горных пород: гранита, гнейса, базальта и т. д.
Общую формулу силикатов можно представить как xSiO2∙yR2O3∙zH2O,
где R – преимущественно алюминий.
Действие кислот на силикаты неодинаково. Чем активнее металл, тем легче протекает реакция:
CaSiO3 + HCl = CaCl2 + H2SiO3
При нагревании смесей многих силикатов с другими силикатами или диоксидом кремния получаются прозрачные аморфные сплавы, называемые стеклами.
Растворимое стекло получают путем сплавления диоксида кремния и карбоната натрия:
Na2CO3 + SiO2 = Na2SiO3 + CO2
SiO2 + NaOH = Na2SiO3 + H2O
Растворимое стекло, представленное в виде водных растворов называется жидким стеклом. Жидкое стекло очень быстро твердеет на воздухе, образуя поликремниевые кислоты. При этом выделяются высокодисперсные гели, обладающие вяжущими свойствами. Поэтому жидкое стекло применяют в строительстве, для пропитки тканей и других материалов с целью придания им огнестойкости.
Обычное оконное стекло состоит из силикатов натрия и кальция, сплавленных с диоксидом кремния. Состав такого стекла приблизительно может быть выражен формулой Na2O ∙ CaO ∙ 6SiO2. Исходными материалами для получения стекла служат белый песок, сода, известняк или мел. При сплавлении этих веществ происходит реакция:
Na2CO3 + CaCO3 + 6SiO2 → Na2SiO3 ∙ 6SiO2 + 2CO2
Для получения специальных стекол, натрий и калий заменяют на другие элементы. Частичная замена SiO2 на В2О3 приводит к получению боросиликатного стекла. Прибавление борного ангидрида увеличивает твердость стекла, а также стойкость к химическим воздействиям. Из такого стекла изготавливают высококачественную химическую посуду.
Кварцевое стекло содержит в своем составе 99% диоксида кремния и отличается высокой тугоплавкостью. Кварцевое стекло выдерживает резкую смену температур и поэтому его применяют для изготовления лабораторной посуды в химической промышленности.
Все виды стекол устойчивы к действию воды и кислот, но при очень длительном их воздействии может произойти вымывание ионов натрия со стеклянной поверхности (выщелачивание стекла).
Разрушить стекло может только плавиковая (фтористоводородная( кислота HF.
Силан SiH4 – бесцветный газ. Он может быть получен путем воздействия соляной кислоты на силицид магния Mg2Si
Mg2Si + 4HCl = 2MgCl2 + SiH4
Силан может самовоспламеняться на воздухе и сгорать с образованием диоксида кремния и воды.
SiH4 + 2O2 = SiO2 + 2H2O
Фторид кремния SiF4 образуется при взаимодействии фтороводорода с диоксидом кремния:
SiO2 + 4HF = SiF4 + 2H2O
Фторид кремния представляет собой бесцветный газ с резким запахом. В водных растворах фторид кремния подвергается гидролизу:
SiF4 + 3H2O = H2SiO3 + 4HF
Гексафторокремниевая кислота H2SiF6 может быть получена путем взаимодействия фтороводорода с фторидом кремния:
SiF4 + 2HF = H2SiF6
По силе гексафторокремниевая кислота близка к серной.
Фторосиликат натрия Na2SiF6 применяется в производстве стекол, эмалей, а также используется в качестве ускорителя твердения в производстве кислотоупорных замазок на основе растворимого стекла.
📺 Видео
Реакции с алюминиемСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Уравнивание реакций горения углеводородовСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Взаимодействие алюминия со щёлочью и водойСкачать

Взаимодействие кремния со щелочьюСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

8 класс. Составление уравнений химических реакций.Скачать

реакция алюминия с хлоромСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие кремния со щёлочьюСкачать

Химия 9 класс (Урок№20 - Кремний и его соединения. Стекло. Цемент.)Скачать

Опыты по химии. Взаимодействие алюминия с кислотой и щелочьюСкачать

Галилео. Эксперимент. Растворяем алюминийСкачать

Взаимодействие алюминия с концентрированной азотной кислотой | ЕГЭ по химииСкачать