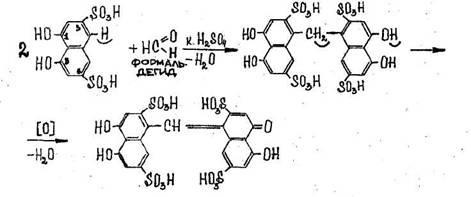
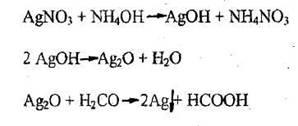В две пробирки прибавляют по 10 капель свежеприготовленного бесцветного раствора фуксинсернистой кислоты (реактив Шиффа). В одну пробирку добавляют 3-4 капли 40%-ного раствора формалина, в другую – несколько капель ацетона. Как изменяется окраска раствора? В обе пробирки добавляют по несколько капель концентрированной соляной кислоты. Отмечают наблюдаемые явления.
Все альдегиды и кетоны, содержащие метильную группу, дают цветную реакцию с фуксинсернистой кислотой. Однако, характерная окраска в сильнокислой среде характерна только для формальдегида.
Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
В пробирку помещают 10 капель дистиллированной воды, 2 капли ацетона и 5 капель 1%-ного раствора нитропруссида натрия. Добавляют несколько капель 10%-ного раствора едкого натра. В какой цвет окрасился раствор?
Разливают раствор в две пробирки и в одну из них прибавляют 5-6 капель 30%-ной уксусной кислоты. Сравнивают окраску в обеих пробирках.
Нитропруссид натрия Na2[Fe(CN)5NO] (пентацианоферроат натрия) дает характерную окраску в присутствии кетонов, не исчезающую в среде уксусной кислоты.
Эта цветная реакция используется для открытия ацетона (качественная реакция на группу СН3СО-)
Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
В пробирку помещают маленький кипятильный камешек. Наливают 3 мл 10%-ного раствора едкого натра и нагревают до кипения. Затем щелочь выливают в специальную посуду, а пробирку охлаждают на воздухе (водой не ополаскивать).
В охлажденную пробирку прибавляют 10 капель (0,5мл) свежеприготовленного 1%-ного аммиачного раствора оксида серебра и 5 капель 1%-ного раствора формалина. Пробирку помещают в водяную баню (или стакан с горячей водой). Через некоторое время на стенках пробирки образуется налет металлического серебра (“cеребряное зеркало”).
Альдегиды очень легко окисляются гидроксидами металлов в щелочной среде. При взаимодействии альдегидов с аммиачным раствором оксида серебра протекает реакция в соответствии со следующей схемой (написать уравнение реакции окисления формальдегида).
После окончания опыта раствор из пробирки сливают в специальную посуду для слива отходов серебра.
Окисление формальдегида гидроксидом меди (II) в щелочной среде
В пробирку помещают 10 капель 10%-ного раствора едкого натра и добавляют 4-5 капель 3%-ного раствора сульфата меди (II). К образовавшемуся голубому осадку гидроксида меди (II) прибавляют 8-10 капель 40%-ного раствора формальдегида. Затем смесь взбалтывают и нагревают до кипения. При нагревании цвет осадка меняется на желтый, а затем происходит образование на стенках пробирки красного налета оксида меди (I).
Написать уравнение происходящей реакции.
Эта реакция является качественной реакцией на альдегиды. Кетоны не окисляются этими реактивами.
Реакция дисмутации водных растворов формальдегида
В пробирку помещают 2-3 капли 40%-ного раствора формальдегида. Добавляют 1 каплю индикатора метилового красного. Раствор окрашивается в красный цвет. Это указывает на кислую реакцию. При стоянии растворов формальдегида в них постепенно протекают процессы окисления-восстановления, называемые реакцией дисмутации. Реакция дисмутации заключается в том, что при участии воды из каждых двух молекул формальдегида одна окисляется до кислоты, а другая восстанавливается в спирт. Написать уравнение данной реакции.
Реакции такого типа характерны для альдегидов, не вступающих в реакцию альдольной конденсации, и катализируются сильными основаниями.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Окислением каких спиртов можно получить следующие соединения: а) 2-метилбутаналь; б) изомасляный альдегид; в) 5,5-диметилгексанон-3; г) метилизобутилкетон?
2. Из каких альдегидов и кетонов при восстановлении могут быть получены следующие спирты: а) 1-пентанол; б) этилпропилкарбинол; в) метилизопропилкарбинол; г) метилтретбутилкарбинол?
3. Какие соединения получатся при действии гидросульфита натрия на: а) пропаналь; б) 2-метилбутаналь; в) метилэтилкетон?
4. Написать уравнение реакции взаимодействия пропионового альдегида с пропанолом-2.
5. Предложить способ распознавания метилпропилкетона и диэтилкетона.
6. Получить реакцией оксосинтеза изомасляный альдегид и написать для него уравнение реакции “серебряного зеркала”.
7. Получите 3-метилпентаналь окислением соответствующего спирта. Напишите для альдегида уравнение реакции с хлоридом фосфора (V).
8. Напишите уравнение альдольной конденсации: а) уксусного альдегида с формальдегидом; б) формальдегида с ацетоном; в) диметилуксусного альдегида.
9. Напишите схемы окисления кетонов: а) бутанона; б) 2-метилпентанона; в) 2,2-диметил-3-гексанона.
10. Предложите химический метод, с помощью которого можно разделить: а)гексаналь и гексан; б) пентаналь и диэтилкетон.
11. Используя в качестве исходного вещества ацетилен, получите 2-бутеналь и напишите для него уравнение реакции с синильной кислотой.
12. Получите метилвинилкетон из следующих веществ: а) ацетона и формальдегида; б) ацетилена и неорганических реагентов.
13. Напишите уравнения реакций в соответствии со следующей схемой: спирт® альдегид ®дигалоидпроизводное® альдегид и укажите условия проведения.
14. Написать уравнение реакции Канниццаро для триметилуксусного альдегида.
15. Написать уравнение реакции сложноэфирной конденсации пропаналя.
ЛАБОРАТОРНАЯ РАБОТА №9
Тема: КАРБОНОВЫЕ КИСЛОТЫ
Цель работы: Практическое ознакомление с некоторыми общими и специфическими свойствами карбоновых кислот на примере отдельных представителей.
Оборудование и реактивы:муравьиная, уксусная, бензойная, сорбиновая, стеариновая (или пальмитиновая) кислоты; растворители: вода, диэтиловый спирт, бензол или другие растворители; хлороформ; 10%-ный раствор гидроксида натрия, 1%-ный раствор нитрата серебра; 5%-ный раствор аммиака, концентрированная серная кислота; известковая (или баритовая) вода; ацетат натрия; 10%-ный раствор серной кислоты; 10%-ный раствор уксусной кислоты или столовый уксус; 2%-ный раствор перманганата калия; 10%-ный раствор карбоната натрия; олеиновая кислота; бромная вода; концентрированная азотная кислота; медь (стружки или проволока); синяя лакмусовая бумага (или универсальная), бани водяные; изогнутые газоотводные трубки; пипетки; прямые газоотводные трубки с оттянутым концом; пробирки.
Теоретическая часть
Карбоновыми кислотаминазывают производные углеводородов, содержащие одну или несколько карбоксильных групп — СООН.
Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
| Предельные одноосновные кислоты | Непредельные одноосновные кислоты | ||
| НСООН | муравьиная | СН2=СН-СООН | Акриловая |
| СН3СООН | уксусная | СН2=СН-СН2-СООН | Винилуксусная |
| СН3СН2СООН | пропионовая | СН3СН=СНСООН | кротоновая |
| СН3(СН2)2-СООН | масляная | СН2=С(СН3)-СООН | метакриловая |
| СН3(СН2)3-СООН | валериановая | СН3-(СН=СН)2-СООН | сорбиновая |
| СН3(СН2)4-СООН | капроновая | СН3(СН2)7СН=СН(СН2)7-СООН | Олеиновая (цис-), элаидиновая (транс-) |
| СН3(СН2)5-СООН | энантовая | С17Н31СООН | линолевая |
| СН3(СН2)10-СООН | лауриновая | С17Н29СООН | Линоленовая |
| СН3(СН2)14-СООН | пальмитиновая | СН=С-СООН | Пропиоловая |
| СН3(СН2)16-СООН | стеариновая | СН3С=С-СООН | тетроловая |
| С20Н31СООН | арахидоновая |
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7— СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая.
Непредельные двухосновные кислоты:НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер).
Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:
фталевая изофталевая терефталевая
Предельные жирно-ароматические кислоты:С6Н5-СН2-СООН – фенилуксусная.
Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная
Оксикарбоновые кислоты:одноосновные: НО-СООН – оксимуравьиная, угольная; НО-СН2-СООН – гликолевая; СН3СН(ОН)-СООН – молочная; двухосновные: НООС-СНОН-СООН – тартроновая, НООС-СН2-СНОН-СООН – яблочная, НООС-СНОН-СНОН-СООН – винная;
НООС-СН2-С(ОН)(СООН)-СН2-СООН – лимонная; ароматические оксикислоты (фенолокислоты):
Методы получения
Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез.
1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений).
2. Оксосинтез:
|
Процесс проводят при высокой температуре и давлении в присутствии карбонилов никеля или кобальта (Ni(CO)4, Co(CO)8).
3. Гидролиз нитрилов (R-C=N) в кислой или щелочной среде при нагревании:
4. Гидролиз тригалогенпроизводных:
5. Магнийорганический синтез(лабораторные методы):
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Взаимодействие альдегидов с фуксинсернистой кислотой уравнение
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться на экспресс-курс! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Качественная реакция на альдегиды с фунсинсернистой кислотой
Формалин – это раствор формальдегида с концентрацией 40%. Качественные реакции на формалин – это цветные реакции на определение альдегидной группы в составе формальдегида. Одной из них является реакция с фуксинсернистой кислотой.
Качественная реакция на формалин проводится следующим образом: бесцветный раствор фуксинсернистой кислоты смешивается с бесцветным раствором формалина. Постепенно раствор окрашивается в фиолетовый цвет — качественная реакция на формалин. Значит в растворе есть альдегид.
Видео:Опыты по химии. Взаимодействие формальдегида с фуксинсернистой кислотойСкачать

Формальдегид. Химико-токсикологический анализ.
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Формальдегид
Формальдегид (от лат. formica «муравей») — бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях. Ирритант, токсичен.
Формальдегид НСНО (муравьиный альдегид, метаналь) представляет собой бесцветный газ с резким раздражающим запахом. Хорошо растворим в воде, спиртах и других полярных растворителях. Чистый газообразный формальдегид относительно стабилен при 80-100 °С, при температурах ниже 80 °С полимеризуется; процесс ускоряется в присутствии полярных растворителей, в том числе воды.
Формалин – водный раствор формальдегида (обычно 37 – 40 %), содержащий 6-15 % метанола (ингибитор полимеризации формальдегида). Представляет собой бесцветную жидкость с характерным острым запахом.
Формальдегид используют в органическом синтезе, в производстве синтетических смол и пластмасс, для синтеза многих лекарственных средств и красителей, для дубления кож, как дезинфицирующее, антисептическое и дезодорирующее средство.
При вдыхании воздуха, содержащего большое количество формальдегида, развиваются явления острого отравления со слезотечением, резким кашлем, чувством стеснения в груди.
При приёме внутрь (в большинстве случаев ошибочном) в результате всасывания формальдегида наблюдается потеря сознания, судороги, угнетение нервных центров, раздражение почек.
Качественное обнаружение
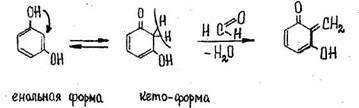
- Реакция с резорцином в щелочной среде
Появляется розовая или малиновая окраска.
Реакция не специфична (дают алкилгалогениды и др.).
Чувствительность 0,03 мкг.
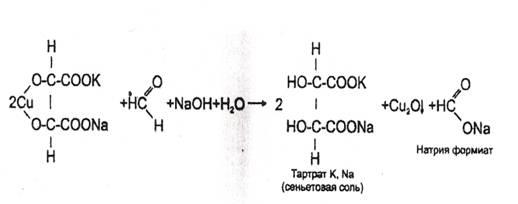
- Реакция с реактивом Фелинга
В пробирку вносят 1 мл исследуемого раствора, прибавляют 1–2 кап. 10% раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем добавляют 2-3 кап. реактива Фелинга (готовится перед употреблением путем смешивания равных количеств растворов Фелинга №1 и №2).
Жидкость сильно взбалтывают и нагревают. При охлаждении на дне пробирки виден желтый или красный осадок оксида меди (I).
Реакция не специфична (дают алкилгалогениды и другие). Имеет отрицательное судебно-химическое значение.
3. Реакция с фуксинсернистой кислотой (реактив Шиффа)
Появляется сине- или красно-фиолетовая окраска, иногда не сразу, а через 10-15 мин.
Чувствительность реакции 0,03 мкг.
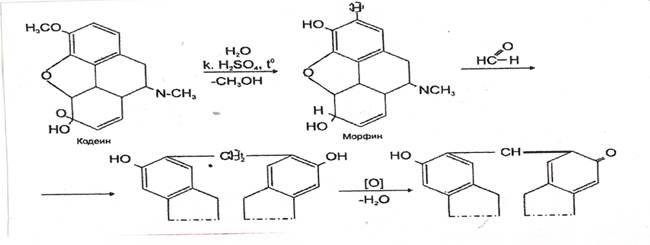
4. Реакция с кодеином и концентрированной серной кислотой
Через 5-10 мин. появляется сине – или красно-фиолетовое окрашивание.
Реакция специфична, имеет положительное судебнохимическое значение.
Чувствительность реакции 0,02 мкг.
- Реакция с хромотроповой кислотой (1,8-диоксинафталтн-3,6-дисульфокислота) в присутствии концентрированной серной кислоты
В фарфоровую чашку вносят 1 мл исследуемого раствора, а затем прибавляют 5 мл концентрированной кислоты серной и несколько кристаллов кислоты хромотроповой. Наблюдается фиолетовая или красно-фиолетовая окраска.
Реакция специфична, имеет положительное судебно-химическое значение. Чувствительность 1 мкг.
- Реакция восстановления ионов серебра (реакция «серебряного зеркала»)
Реакция не специфична, имеет отрицательное судебно-химическое значение.
Чувствительность реакции – сотые доли микрограмма.
🎥 Видео
Качественная реакция на альдегиды с фуксинсернистой кислотойСкачать

Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать

Качественная реакция на альдегиды с фуксинсернистой кислотой (Введение)Скачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать

Химические свойства альдегидов и кетонов. 11 класс.Скачать

Кач. реакция на альдегиды с фунсинсернистой кислотойСкачать

10.1. Альдегиды и кетоны: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

АльдегидыСкачать

Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Качественная Реакция На Альдегиды С Гидроксидом Меди.Скачать

Альдегиды и кетоны: свойства, про которые не пишут в учебниках... | Химия ЕГЭ | УмскулСкачать

Альдегиды свойства (таблица)Скачать

10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химииСкачать

Качественные реакции на альдегидыСкачать

Получение и применение альдегидов | Химия 10 класс #29 | ИнфоурокСкачать

Окисление Кетонов Перманганатом Калия В Сернокислой СредеСкачать

Опыты по химии. Отношение олеиновой кислоты к бромной водеСкачать

Альдегиды строение, свойства | Химия 10 класс #28 | ИнфоурокСкачать