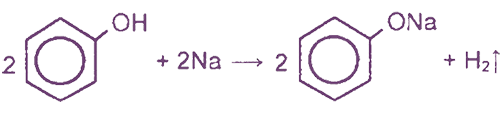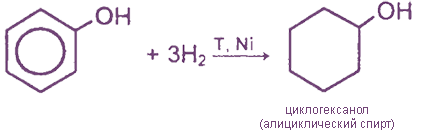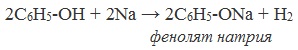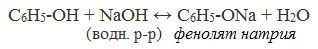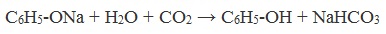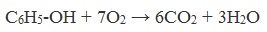Существуют фенолы и большей атомности.
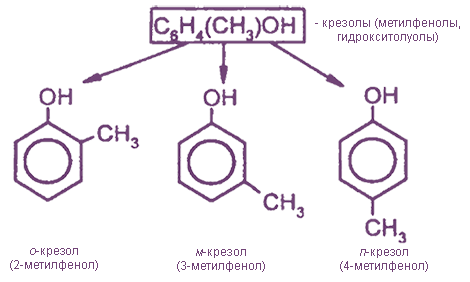
- Простейшие одноатомные фенолы
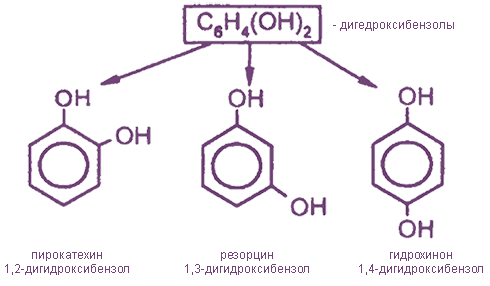
- Простейшие двухатомные фенолы
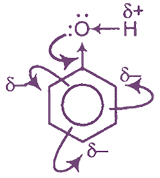
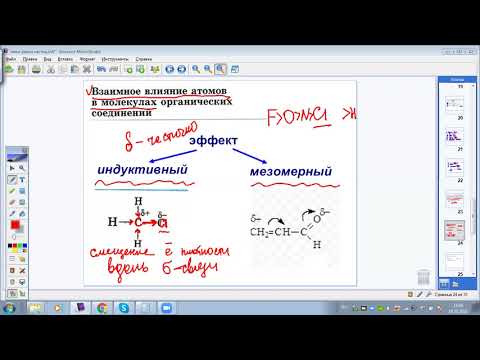
- Электронное строение молекулы фенола. Взаимное влияние атомов в молекуле
- Физические свойства
- Химические свойства
- I. Реакции с участием гидроксильной группы (кислотные свойства)
- II. Реакции с участием гидроксильной группы (образование сложных и простых эфиров)
- III. Реакции замещения с участием бензольного ядра
- IV. Реакции присоединения (гидрирование)
- V. Качественная реакция с хлоридом железа (III)
- VI. Реакции окисления
- Способы получения фенолов
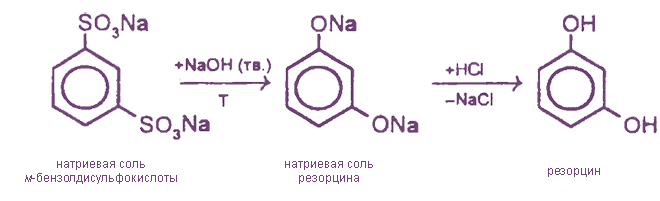
- 1. Сплавление солей ароматических сульфокислот со щелочами
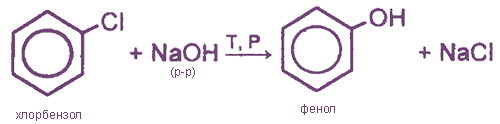
- 2. Взаимодействие арилгалогенидов со щелочами
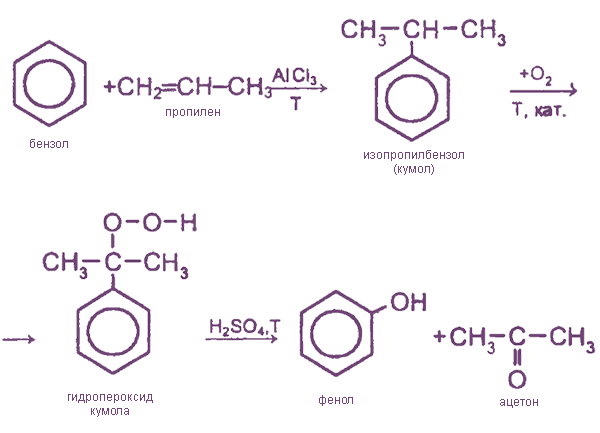
- 3. Кумольный способ
- №4. В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга? Напишите уравнения реакций.
- Взаимное влияние атомов в молекуле фенола уравнение реакции
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- 📸 Видео
Видео:ЛЕКЦИЯ 1.2. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ. КИСЛОТНОСТЬ-ОСНОВНОСТЬСкачать
Простейшие одноатомные фенолы
С6Н5ОН — фенол (гидроксибензол), тривиальное название — карболовая кислота.
Видео:Химия. Взаимное влияние атомов в молекулах. Центр онлайн-обучения «Фоксфорд»Скачать

Простейшие двухатомные фенолы
Электронное строение молекулы фенола. Взаимное влияние атомов в молекуле
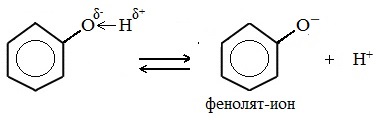
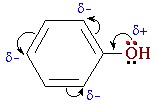
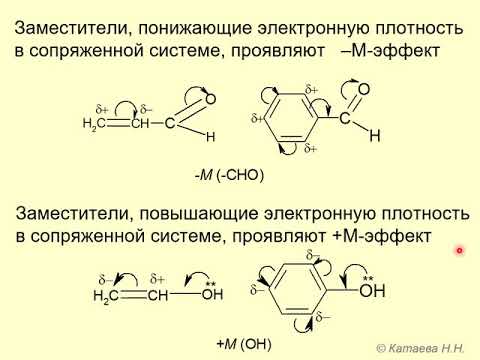
Гидроксильная группа -ОН (как и алкильные радикалы) является заместителем 1 рода, т. е. электронодонором. Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р, π-сопряжение с π-системой бензольного ядра.
Результатом этого является:
— повышение электронной плотности на атомах углерода в орто- и пара- положениях бензольного ядра, что облегчает замещение атомов водорода в этих положениях;
— увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами.
В отличие от спиртов, фенолы частично диссоциируют в водных растворах на ионы:
т. е. проявляют слабокислотные свойства.
Физические свойства
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом. Фенолы малорастворимы в воде, но хорошо растворяются в органических растворителях. Являются токсичными веществами, вызывают ожоги кожи.
Химические свойства
Видео:Взаимное влияние атомов и функциональных групп. Индуктивный и мезомерный эффекты.Скачать

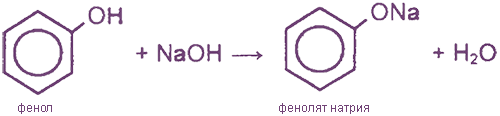
I. Реакции с участием гидроксильной группы (кислотные свойства)
(реакция нейтрализации, отличие от спиртов)
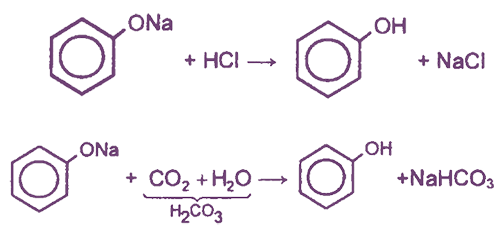
Фенол — очень слабая кислота, поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная:
Видео:ФенолыСкачать

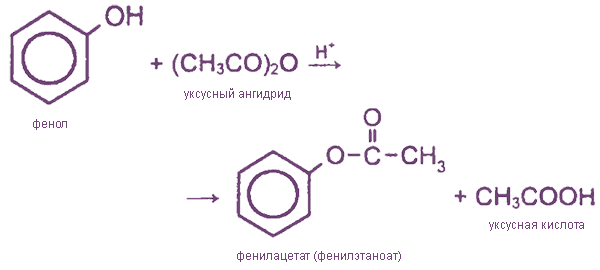
II. Реакции с участием гидроксильной группы (образование сложных и простых эфиров)
Как и спирты, фенолы могут образовывать простые и сложные эфиры.
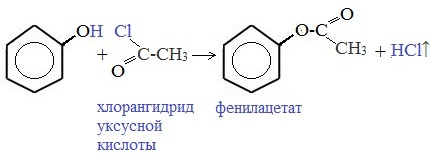
Сложные эфиры образуются при взаимодействии фенола с ангидридами или хпорангидридами карбоновых кислот (прямая этерификация карбоновыми кислотами протекает труднее):
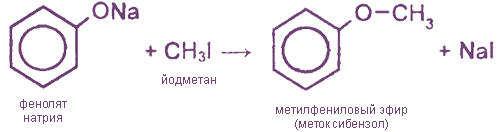
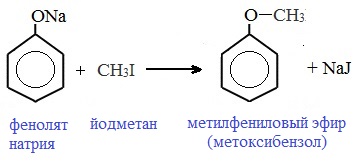
Простые эфиры (алкилариловые) образуются при взаимодействии фенолятов с алкилгалогенидами:
Видео:Химическая связь и взаимное влияние атомов в молекулах. Часть 1.Скачать

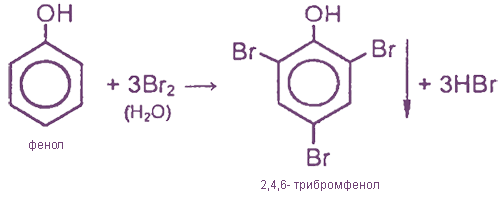
III. Реакции замещения с участием бензольного ядра
Образование белого осадка трибромфенола иногда рассматривается как качественная реакция на фенол.
Видео:10 класс § 19 "Электронные эффекты в молекулах органических соединений"Скачать

IV. Реакции присоединения (гидрирование)
Видео:Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать

V. Качественная реакция с хлоридом железа (III)
Одноатомные фенолы + FeCl3 (р-р) → Сине-фиолетовая окраска, исчезающая при подкислении.
Многоатомные фенолы + FeCl3 (р-р) → Окраска различных оттенков.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

VI. Реакции окисления
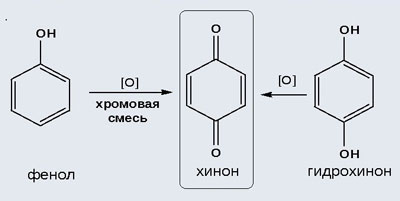
При окислении фенола кислородом воздуха образуется гидрохинон
Способы получения фенолов
Видео:Резонансные (граничные) структуры молекулы фенолаСкачать

1. Сплавление солей ароматических сульфокислот со щелочами
Видео:Индуктивный и мезомерный эффектыСкачать
2. Взаимодействие арилгалогенидов со щелочами
Видео:9.3. Фенол: Химические свойстваСкачать

3. Кумольный способ
Наряду с фенолом образуется имеющий важное практическое значение кетон — ацетон.
Фенол и ацетон разделяют путем ректификации (фракционной перегонки).
Видео:9.1. Фенол: Строение, номенклатураСкачать

№4. В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга? Напишите уравнения реакций.
1) Ароматическое кольцо оказывает влияние на гидроксильную группу, в результате чего атом водорода становится более подвижным, чем в спиртах (объяснение см. в ответе на вопрос 2). Если спирты реагируют с выделением водорода с металлическим натрием, а с гидроксидом натрия не реагируют, то фенолы реагируют и с натрием, и с гидроксидом натрия:
Реакция с гидроксидом натрия — реакция нейтрализации, типичная для кислот. В результате образуется соль — фенолят натрия — и вода.
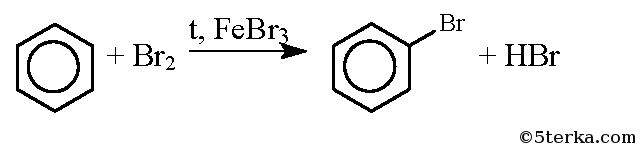
2) Гидроксильная группа также оказывает влияние на бензольное кольцо, в результате чего реакции замещения в фенолах протекают гораздо легче, чем в ароматических углеводородах. Например, при действии на бензол брома реакция замещения протекает только в присутствии катализатора -бромида железа — и замещается только один атом водорода, образуется бромбензол:
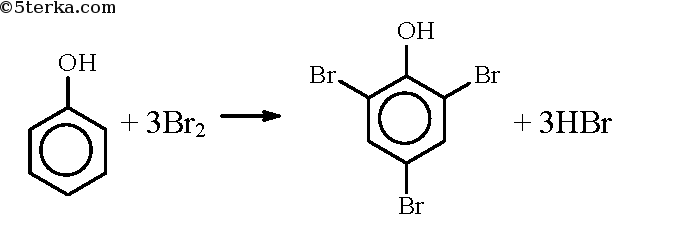
В феноле замещение водорода на бром протекает и без катализатора, и замещаются сразу три атома водорода, образуется 2,4,6-трибромфенол:

задача №4
к главе «Глава VII. Спирты и фенолы. §3 Фенолы(стр. 94) Вопросы».
Видео:Лекторий ЗФТШ. Х-10. Взаимное влияние атомов в молекулах органических соединенийСкачать

Взаимное влияние атомов в молекуле фенола уравнение реакции
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
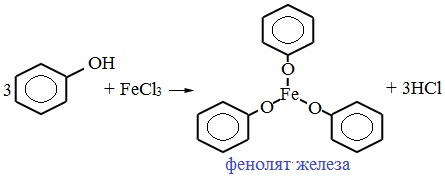
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
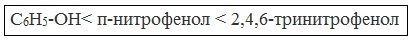
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
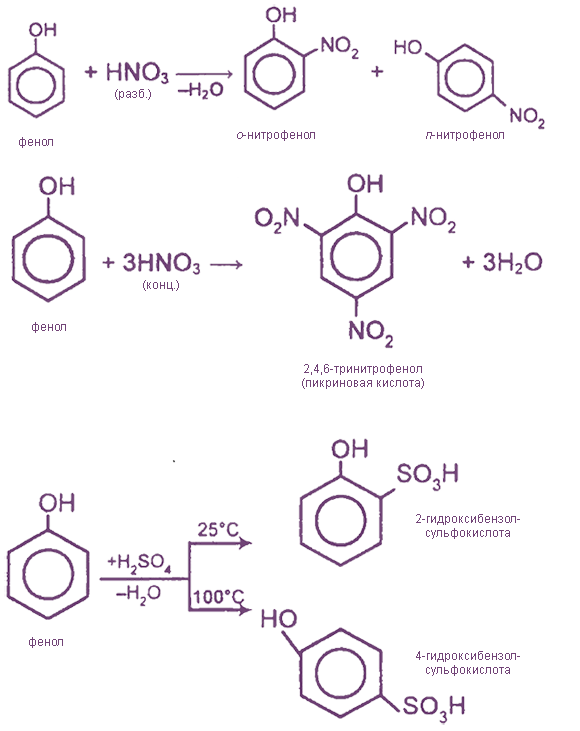
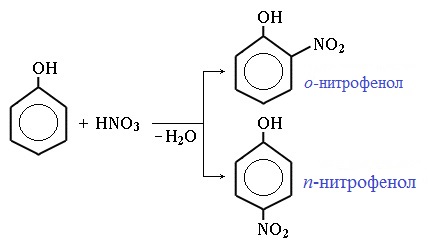
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
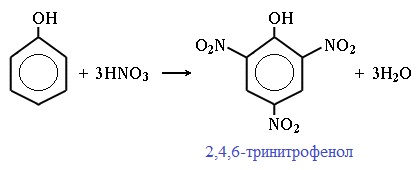
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
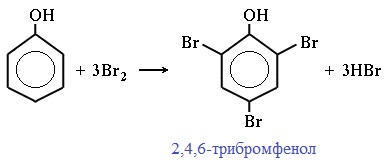
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: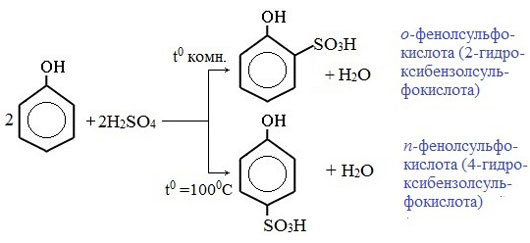
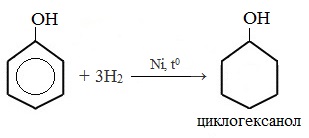
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
📸 Видео
Фенолы и ароматические спиртыСкачать

Опыты по химии. Свойства фенолаСкачать

Видеоурок по химии "Типы химических реакций в органической химии"Скачать

Химические свойства фенола. 10 класс.Скачать

Решение задач на мезомерный и индуктивный эффекты в молекулах. Часть 2.Скачать

Спирты и фенолы. Тема 23. Фенолы. Химические свойства, получение и применение фенолаСкачать

Фенолы. 1 часть. 10 класс.Скачать