Содержание:
Правило фаз (или правило фаз Гиббса) — соотношение, связывающее число компонентов, фаз и термодинамических степеней свободы в равновесной термодинамической системе. Роль правила фаз особенно велика при рассмотрении гетерогенных равновесий в многофазных многокомпонентных системах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Правило фаз Гиббса
Правило фаз Гиббса утверждает, что число степеней свободы С равновесной термодинамической системы равно разности между числом компонентов К и числом фаз Ф, плюс число факторов п, влияющих на равновесие.
Независимые компоненты и степени свободы системы
Представления о гомогенных и гетерогенных системах и фазах, изложенных в предыдущей главе, следует дополнить понятиями о компонентах и степенях свободы. Компонентами называют индивидуальные вещества системы, концентрации которых определяют состав всех ее фаз, т. е. веществ в системе может быть больше, чем требуется для описания состава всех ее фаз. Например, при установлении равновесия
система состоит из трех веществ, но для описания состава всех трех фаз достаточно знать любые два, их называют независимыми компонентами; состав третьей фазы легко определить, используя уравнение вещественного баланса. Из приведенного примера следует: число независимых компонентов равновесной системы равно общему числу индивидуальных веществ минус число связывающих их уравнений. При наличии химических реакций число независимых компонентов системы меньше числа индивидуальных веществ. Если же между веществами нет химического взаимодействия, то числа независимых компонентов и индивидуальных веществ совпадают (например, воздух состоит из такого же числа независимых компонентов, сколько сортов молекул входит в его состав).
Степенями свободы (С) равновесной системы называют те параметры, которые можно произвольно изменять, не меняя числа и природы фаз системы. Степенями свободы могут являться концентрации реагирующих веществ в фазах переменного состава (растворах), давление, температура.
Число степеней свободы определяют разностью между общим числом независимых переменных системы и числом уравнений, их связывающих. В приведенном выше примере общее число переменных равно двум (температура и давление С02 или его концентрация), уравнение одно, следовательно, число степеней свободы С данной системы равно: 2—1 = 1.
Количественное соотношение между числами степени свободы (С), фаз (Ф) и независимых компонентов (К), получившее название правила фаз, выведено В. Гиббсом (1876), оно имеет вид
Здесь 2 — число переменных параметров системы (давление и температура). Использование этого правила помогает при изучении химических реакций и равновесных систем.
Рассмотрим некоторые конкретные примеры.
Пример 1. Система представлена равновесием
Число независимых компонентов К равно разности числа индивидуальных веществ и числа уравнений, их связывающих, следовательно,

Связь 

Пример 2. Пусть система представлена равновесием 
Число независимых компонентов в ней равно

Это легко понять, если записать выражение температурной зависимости константы равновесия:

Следовательно, чтобы определить значение любой из переменных, нужно задать значения остальных трех.
Пример 3. Пусть система представлена ненасыщенным водным раствором хлористого натрия NaCl. В растворе, помимо молекул воды 

Эта однофазная система представлена тремя индивидуальными фермами соединений и одним уравнением, отсюда число независимых компонентов в этой однофазной системе равно
Поскольку газовая фаза (пар над раствором) не входит в рассматриваемую систему (по условию), то в выражении правила фаз Гиббса число параметров должно стать на единицу меньше, т. е. 
Однокомпонентные системы
Наиболее просты системы, состоящие из одного компонента. Каждая однокомпонентная система представлена единственным веществом, находящимся в различных агрегатных состояниях. Так, например, вода может существовать в парообразном, жидком и кристаллическом состояниях, каждое из которых устойчиво в определенных интервалах температуры и давления.
Переменными параметрами . однокомпонентных систем могут служить только давление и температура, поскольку состав фаз по условию постоянен. Поэтому состояние однокомпонентных систем может быть представлено в виде зависимости давления от температуры:

Графическое изображение такой зависимости получило название диаграммы состояния или фазовой диаграммы
состояния, поскольку состав фаз в однокомпонентной системе одинаков и при изменении условий не меняется.
Давление пара в процессах па рообра зова ни я уста на вл ивается и над твердыми, и над жидкими веществами:

Характер этой функциональной зависимости приведен на графике рис. 7.1. Точка плавления кристаллической фазы находится .совместным решением приведенных выше уравнений; исходя из условия равенства жидкой и кристаллической фаз должно выполняться условие 
При переходе из кристаллического состояния в пар (сублимация) степень разупорядоченности движения частиц больше, чем при испарении (в жидкости беспорядочность движения частиц больше, чем в кристаллах), поэтому величина 
Поскольку температура может принимать только значения Т > 0, величина 
Точно так же обстоит дело с полиморфными превращениями, если они есть.
Зависимость температуры плавления чистых веществ от давления p = fT можно определить уравнением Клаузиуса— Клайперона (приближенная форма):
В этом уравнении 


На рис. 7.2, а, б показано, что каждому из условий соответствует определенный наклон линии р = f(Т). Крутой ход кривых в равновесии между двумя конденсированными фазами объясняют незначительной разностью
Рассмотрим в качестве примера однокомпонентную систему вода—лед—пар. С точки зрения правила фаз Гиббса для такой системы 
Равновесие двух фаз (испарение, сублимация) характеризуется одной степенью свободы (произвольны давление или температура). Двухфазные превращения описываются следующими уравнениями:


При использовании этих данных на рис. 7.3 построен график зависимости р =f(Т), получивший название диаграммы’; состояния воды. Линии (а), (b) и (с) отвечают равновесиям двух фаз: твердое вещество— пар; твердое вещество— жидкость; жидкость— пар соответственно. Точка пересечения трех кривых носит название тройной точки, она отвечает равновесию всех трех фаз, а участки диаграммы I, II и III отвечают однофазному равновесию с тремя степенями свободы. Линия (b) имеет отрицательный наклон, соответствующий отрицательному значению 
Двухкомпонентные системы
Перейдем к характеристике более сложных, двухкомпонентных систем. С точки зрения правила фаз число степеней свободы в системах с К = 2 может максимально быть равным 3, если Ф= 1. Это означает, что кроме таких переменных параметров системы, как давление и температура, появляется третий— концентрация раствора. Примером однофазных систем переменного состава, образованных двумя и более независимыми компонентами, служат растворы. Растворы образуются во всех агрегатных состояниях. Они могут быть газообразными, жидкими и твердыми.
Все газы в любых соотношениях между собой неограниченно растворимы. Только при низких температурах и очень высоких давлениях в некоторых газовых смесях наблюдается расслоение. В жидком состоянии ограничение растворимости наблюдают довольно часто. Однако с повышением температуры растворимость обычно возрастает, так что многие жидкие смеси, расслоенные на две фазы, с повышением температуры становятся однофазными. Наиболее важные группы жидких растворов следующие:
1) водные, неводные и органические растворы;
2) солевые расплавы галогенидных, кислородных и сульфидных соединений (при высоких температурах);
3) расплавы металлов (при высоких температурах).
В твердом состоянии ограничение в растворимости также имеет место. Известны три типа твердых растворов: замещения, внедрения и вычитания. Твердые растворы замещения обычно образуются двумя или несколькими различными элементами, так что в кристаллической структуре места атомов одного элемента неупорядоченно замещаются атомами второго элемента. В результате распределение каждого из элементов оказывается хаотическим, а соотношение между количествами атомов того и другого сорта — произвольным. Примерами твердых растворов замещения служат сплавы меди и никеля или смешанные кристаллы хлористого и бромистого натрия. Твердые растворы внедрения получают чаще всего при растворении небольших по размеру атомов неметаллов в металлической решетке, например раствор углерода в железе. В этом случае атомы неметаллов (Н, В, С, О и др.) хаотически и в произвольных соотношениях располагаются в промежутках между атомами металла.
Твердые растворы вычитания, или дефектные структуры, характеризуются наличием пустот, которые размещаются хаотически и создают беспорядок в расположении мест, занятых атомами элементов. Примером таких структур служит сульфидный минерал пирротин, монотонно изменяющий свой состав в пределах
Общая характеристика растворов
Процесс растворения— сложный физико-химический акт, а не простое распределение частиц одного вещества между частицами другого, которое в какой-то степени применимо для описания разреженных газовых смесей. В жидких и твердых растворах частицы растворителя и растворенного вещества непосредственно взаимодействуют между собой и находятся на таких коротких расстояниях, как и в химических соединениях. Взаимодействие молекул растворителя с растворяемым веществом зависит от сил разнообразной природы, за счет которых в растворе образуются устойчивые комплексные и полимерные соединения, способные существовать вне раствора,— сольваты, а в случае водных растворов—гидраты.
Одна из важнейших количественных характеристик растворов, связанная через закон действующих масс с энергетикой процессов растворения,— концентрация раствора. Поэтому целесообразно вспомнить некоторые наиболее используемые способы выражения концентраций, кроме уже упомянутых молярности и молярной доли следует знать массовую и объемную доли, моляльную концентрацию (моляль-ность), титр.
Поскольку процессы растворения имеют сложную химическую природу, законы, определяющие растворение и отражающие природу растворов, сложны. Для упрощения введено понятие идеального раствора, простейшими примерами которого могут служить разреженные газы. В реальных газах соотношение между объемом, давлением и температурой описывается уравнением Ван-дер-Ваальса
В этом уравнении слагаемые 

Составляя смеси таких газов, можно убедиться в том, что для их взаимодействия справедливо условие 
Газовые растворы, которые образуются из составляющих их частей с нулевым тепловым эффектом, а объем их смеси в точности равен сумме объемов частей, получили название идеальных.
Для жидких и твердых растворов также существует понятие идеальности, в общем виде оно может быть сформулировано следующим образом: идеальными называют растворы, которые образуются из составных частей при выполнении условий
Примерами идеальных растворов могут служить газовые смеси изотопов, а также все разбавленные растворы. И действительно, добавление к растворителю небольшого количества растворяемого вещества мало изменяет свойства растворителя и раствора, и условие идеальности (7.2) справедливо. Но свойства растворяемого вещества в таком растворе далеки от идеальных.
Концентрированные растворы но свойствам не близки к идеальным, однако для получения грубой качественной картины их можно описывать с помощью модели идеальных растворов. Для строгого решения производственных и научных задач требуется обязательное введение поправок на реальность.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
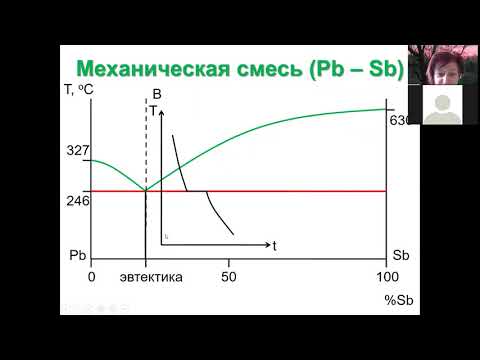
Видео:09 Фаз диагр двухкомп сист 1 принципы и мех смесьСкачать
Вывод уравнения гиббса для двухфазной двухкомпонентной системы
Гетерогенные фазовые равновесия.
При кипении жидкости при постоянном давлении, при плавлении кристаллов, при выделении кристаллов из насыщенных растворов устанавливается гетерогенное равновесие . Термодинамическое условие равновесия в гетерогенных системах – сколь угодно длительное существование фаз в условиях р и Т = const : концентрация в каждой фазе при этом не изменяется:
Изменение внешних параметров приводят к нарушению равновесия и к изменению концентраций и фаз. Предсказать возможность изменения фаз позволяет закон равновесия фаз, выведенный Гиббсом термодинамическим путем в 1876г:
В равновесной многофазной системе число степеней свободы равно числу компонентов системы плюс два минус число фаз, если на систему из внешних термодинамических параметров влияют только давление и температура:
С = К – Ф + 2
где С – число степеней свободы; К – число компонентов; Ф – число фаз.
Компонентами называются химические однородные вещества, которые являются независимыми составными частями системы. При выборе компонентов выбираются те вещества, наименьшее число которых достаточно для образования всей системы, так и любой ее части.
При определении минимального числа компонентов, таким образом, необходимо знать число связей, т.е. число уравнений, которые определяют соотношения компонентов в условиях термодинамического равновесия.
например, система, состоящая из СаО, СаСО3 и СО 2 может быть описана двумя компонентами, т.к. концентрация СО2 при данной температуре однозначно определяется через константу равновесия обратимого процесса:




может быть задана количеством НУ (г.), т.е. число независимых компонентов для данной системы может быть определено равным 1.
Гомогенная часть гетерогенной системы определяется как фаза. Для фазы должны быть одинаковые термодинамические и физические свойства. Этим фаза отличается от агрегатного состояния. В одном и том же агрегатном состоянии могут быть вещества, составляющие несколько независимых фаз.
Вариантностью системы, или числом степеней свободы называется число тех параметров состояния системы, величину которых можно менять без применения числа фаз.
Вывод правила фаз.
Правило фаз выводится их известного алгебраического условия: в системе уравнений число независимых переменных равно разности между общим числом переменных и числом связывающих эти переменные уравнений.
Если в гетерогенной системе к — коэффициентов и Ф – фаз находятся в устойчивом термодинамическом равновесии. Состояния каждой фазы определяются внешними параметрами, которые задаются и меняются — это, как правило, р и Т , и составом. Состав каждой фазы определяется не всеми К компонентами, а только К – 1, т.к. 
Число связывающих эти компоненты уравнений определяются на основе уравнения (5-1). В равновесии наблюдается равенство химических потенциалов всех компонентов во всех фазах.




μ 


μ 


Очевидно, что для каждого компонента (Ф-1) – уравнение, а всего для всех компонентов во всех фазах К( Ф-1) – уравнение связи.
Отсюда, число степеней свободы:
С = Ф( К-1) + 2 – К(Ф-1) = К – Ф + 2
Установить наличие полиморфных превращений в однокомпонентной системе, природу фаз и область их существования в зависимости от температуры и давления, а также проанализировать взаимодействие в многокомпонентной системе можно двумя путями: препаративным или проводя физико-химический анализ и построив диаграммы «состав-свойство».
Препаративный метод требует подбора условий синтеза и используется в случае одновременно протекающих нескольких реакций, когда равновесие не достигается.
Однако, состав конкурентных соединений, бывает сложно определить, поскольку не всегда удается выделить чистые вещества. В этом случае получают физико-химический анализ.
Физико-химический анализ заключается в изучении взаимодействия веществ в многокомпонентных системах без выделения образующихся продуктов. В физико-химическом анализе исследуется функциональная зависимость между численными значениями физических свойств равновесной химической системы и концентрациями компонентов, определяющими состояние равновесия.
На основании результатов измерения строятся химические диаграммы в координатах «состав свойство».
Геометрические особенности этих диаграмм позволяют судить как о природе продуктов, так и числе этих продуктов, границах их устойчивости, условиях совестного существования различных фаз в системе.
Анализ гетерогенных равновесий проводится по диаграмме на основе правила фаз Гиббса и принципов непрерывности и соответствия, сформулированных А.С. Кураковым.
Принцип непрерывности. Если непрерывно изменяются давления, температуры, концентрации, то свойства отдельных фаз системы изменяются также непрерывно. Пока не изменится число и характер фаз, непрерывно изменяются свойства всей системы.
Принцип соответствия. Совокупности находящейся в равновесии фаз на диаграмме соответствует определенный образ.
Наиболее распространен среди методов физико-химического анализа – термический анализ. Термический анализ состоит в изучении систем по кривым нагревания или охлаждения в координатах «температура-время». Изломы и кипейные участки на этих кривых позволяют построить диаграммы в координатах «температура — состав» для многокомпонентной системы или «температура — давление» для однокомпонентной. Исследование однокомпонентных систем этим методом позволяет определить температуры полиморфных превращений, плавления, кипения и тепловые эффекты этих процессов. В сложных системах можно установить наличие или отсутствие взаимодействия компонентов, составы фаз и другую информацию.
Однокомпонентные системы: Р-Т проекции
В координатах Р-Т однокомпонентные системы имеют вид:

 |
 |

 |
 |

Если удельный объем жидкости фазы, образующийся при плавлении больше удельного объема твердой фазы, то диаграмма соответствует рис. 1. Если имеется обратная зависимость, то диаграмма соответствует рис. 2. Линии, разделяющие поля, отвечают сосуществованию двух фаз и описываются уравнением Клапейрона — Клаузиуса. Они многовариантны, т. к. произвольно на этих линиях можно изменить только давление или температуру, изменение второго параметра определяется уравнением.
Точка пересечения трех линий – тройная точка, ноивариантна. Она соответствует сосуществованию в равновесии всех трех фаз.
В зависимости от состояния фаз, диаграммы для двухкомпонентных систем можно классифицировать следующим образом.



 |


I тип (рис. 5-3): диаграмма отвечает случаю полной взаимной растворимости компонентов А и В как в расплаве так и в твердой фазе.








кристаллы А + кристаллы В

II тип (рис. 5-4): диаграмма с простой эвтектикой. А и В не расслаиваются в жидкой фазе, но в твердом состоянии представляют собой гетерогенную двухфазную систему.














тв. р-р α + тв. р-р β
эвтектика + этектика рис. 5-5

III тип ( рис. 5-5): диаграмма с неограниченной растворимостью в жидкой фазе при частичной растворимости в твердой фазе.
 |

 |
жидк. + жидк. + хим. соед. кр. В


 |
А + Э 1 х.с. + Э1 хим. соед. В т. + Э 2



эвтектика 1 эвтектика 2
IV тип (рис. 5-6): диаграмма, отвечающая образованию химического соединения, плавящегося без разложения (т.е. конгруэнтно).










V тип (рис 5-7): диаграмма со скрытым максимумом, который отвечает химическому соединению, которое разлагается при плавлении (т.е. плавится инконгруэнтно).
🎦 Видео
09 Фазовые диаграммы 2 правило фазСкачать

Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

Фазовые равновесия | ФизхимияСкачать
Вывод уравнения неразрывности - Лекция 1Скачать

Коробов М. В. - Физическая химия. Часть 1 - Двухкомпонентные системы. Правило КоноваловаСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовое равновесие. Уравнения Гиббса-Дюгема-МаргулесаСкачать

Вывод уравнений движения идеальной жидкости - Лекция 2Скачать

Гидродинамика. Вывод уравнения БернуллиСкачать

Закон БернуллиСкачать

Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Фазовые диаграммыСкачать

Дифференциальное уравнение Эйлера. Основное уравнение гидростатикиСкачать

Уравнения состояния. Фазовое равновесиеСкачать

✓ Как решать кубические уравнения. Формула Кардано | Ботай со мной #025 | Борис ТрушинСкачать

Коробов М. В. - Физическая химия. Часть 1 - Химический потенциалСкачать

Метод РозебомаСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовая диаграмма воды. Закон Рауля. Закон ГенриСкачать

Успенская И. А. - Химическая термодинамика и кинетика - Фазовые диаграммыСкачать




























