Страницы работы
Содержание работы
Министерство Образования Российской Федерации
Новосибирский Государственный Университет
Факультет Естественных Наук
Кафедра Физической Химии
Изучение кинетики реакции оксида азота
с кислородом методом УФ-спектроскопии
Студент группы 141
Цель работы: Изучение кинетики реакции оксида азота с кислородом, определение порядка реакции по NO и O2, константы скорости реакции 2NO+O2→2NO2
Окисление азота молекулярным кислородом до диоксида протекает как тримолекулярная реакция. Ее особенностью является аномальная температурная зависимость: скорость реакции уменьшается с ростом температуры, т.е. наблюдается отрицательная энергия активации.
Согласно [], реакция имеет следующий вид: 2NO2 + X2 = 2NOX, где X – может быть молекулой кислорода. Одно из объяснений отрицательной энергии активации получается на основании теории столкновений при допущении, что реакция протекает по сложному механизму через образование комплексов (NO)2 или NO3, находящихся в термодинамическом равновесии с окружающим газом. Можно представить механизм реакции упрощенной схемой:
(NO3)* + NO → 2NO2, тогда уравнение для скорости реакции можно записать следующим образом:
exp[-E1/RT], где Е1 – энергия связи ON-O2 , тогда для энергии активации, входящей в выражение общей константы скорости реакции, будем иметь: E = E2 – E1, где E2 – энергия активации второго процесса, и, если E2 0 1(NO)=100 мм.масл.ст. P 0 2(NO)=70 мм.масл.ст.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Окисление оксида азота II (NO).
Лекция 8.
Оксид азота II (NO) имеет низкую растворимость в воде. Коэффициент поглощения 
| Т, °С | ||||||
 | 0,07381 | 0,05709 | 0,04706 | 0,03507 | 0,02954 | 0,0270 |
Вследствие чего NO не может быть использован для производства азотной кислоты, поэтому его подвергают дальнейшему окислению.
При окислении NO образуются высшие оксиды. Образование высших оксид протекает по реакциям:



Оксиды азота имеют различную термодинамическую устойчивость, которая в свою очередь зависит от температуры.
| Температура, К | Термодинамические устойчивости различных оксидов, расположенные в порядке уменьшения |
| N2O4>N2O>N2O5>NO2>N2O3>NO | |
| NO>N2O>NO2>N2O3>N2O4>N2O5 |
Таким образом, при низких температурах наибольшей термодинамической устойчивость обладает N2O4, а при высоких – NO. Так как оксид азота II (NO) имеет низкую растворимость в воде, то его целесообразно окислять при низких температурах, когда его термодинамическая устойчивость наименьшая по сравнению с другими оксидами.
С понижением температуры равновесие реакций (1)-(3) смещается в сторону образования продуктов. При низких температурах и времени, достаточном для установления равновесия, а так же при избытке кислорода преобладающим продуктом окисления будет оксид N2O4. Об условиях превращений одних оксидов азота в другие и перехода их из газообразной фазы в жидкую и твердую можно судить по диаграмме состояния системы NO-NO2 при атмосферном давлении (рисунок 1).
 | Рис. 1. Диаграмма состояния системы NO-NO2 при атмосферном давлении. |
При недостатке кислорода или неустановившемся равновесии в нитрозных газах могут одновременно содержаться N2O4, NO2, N2O3, NO.
Оксид азота N2O5 при окислении N2O4 кислородом не образуется, даже если процесс происходит при повышенном давлении. Оксид азота N2O5 может быть получен только окислением N2O4 озоном, при этом протекает реакция:

Одновременно с образованием N2O5 может образовываться N2O6.
От степени полноты протекания реакции (1) будет зависеть остаточное содержание NO в газовой смеси. Поэтому при окислении оксида азота NO данная реакция является определяющей. Зависимость константы равновесия реакции:
выраженная через парциальные давления веществ имеет следующий вид:

Существует эмпирическое уравнение, описывающее зависимость константы равновесия от температуры (уравнение Боденштейна):

На рисунке 2 представлен график зависимости равновесной степени окисления оксида азота NO ( 
 | Рис. 2. Зависимость равновесной степени окисления оксида азота NO (  ) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2. Значения Р, МПа: 1 – 0,1; 2 – 0,8. ) от температуры и давления при начальной концентрации 9,92% NO и 5,68 О2. Значения Р, МПа: 1 – 0,1; 2 – 0,8. |
Из диаграммы (рис. 2) следует, что понижение температуры и повышение давления газа смещают равновесие реакции в сторону образования продуктов. При температуре менее 200°С реакция окисления NO при давлении 0,1 МПа протекает почти на 100%. Поэтому при данных условиях реакцию можно рассматривать как протекающую необратимо в сторону образования NO2.
Окисление оксида азота NO протекает по уравнению реакции третьего порядка. Дифференциальное уравнение скорости окисления NO кислородом имеет вид:
где 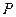

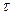
Значения констант скорости реакции, по данным М. Боденштейна, представлены в таблице 1.
Константы скорости окисления NO кислородом при различных температурах и давлении 1 МПа
Для определения времени, необходимого для окисления NO до заданной степени, можно использовать уравнение:
где 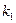
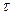



Степень окисления NO в долях единицы можно при помощи уравнения: 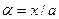
На рисунке 3 представлена номограмма для определения скорости окисления NO.
Рис. 3. Номограмма для определения скорости окисления NO.
На номограмме: 



Реакция окисления NO является суммой двух бимолекулярных реакций:
Первая реакция протекает быстро, вторая – медленно. С повышением температуры равновесие первой реакции смещается в сторону исходных веществ, концентрация NO3 уменьшается, поэтому реакция образования NO2 замедляется. С понижением температуры концентрация NO3 увеличивается, что приводит к ускорению второй реакции, которая и определяет общую скорость процесса.
Реакция окисления NO кислородом относится к тем немногочисленным процессам, скорость протекания которых с понижением температуры увеличивается.
Как видно из уравнения кинетики окисления NO, скорость реакции давлению во второй степени. То есть если увеличить общее давление в 2 раза, то скорость окисления увеличится в четыре раза.
В действительности практически невозможно достичь 100% окисления NO в NO2, так как для этого требуется высокое давление, высокие концентрации NO и кислорода в исходных реагентах (другими словами исходные газы должны содержать как можно меньше примесей в своем составе).
Переработка нитрозных газов зачастую производят при низких температурах. В этих условиях двуокись азота практически не существует, часть ее всегда полимеризуется в четырех окись азота:
Степень полимеризации тем выше, чем ниже температура и больше концентрация двуокиси азота NO2. Процесс диссоциации (распада молекулы N2O4 на NO2) имеет обратную зависимость.
Зависимость содержания диоксида азота (NO2) и четырех окиси азота (N2O4) от температуры можно проследить по следующим данным:
| Температура, °С | ||||||||||||||||||||||||||
| Содержание NO2, % об. | 31,0 | 88,0 |
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Способы получения
1. Оксид азота (IV) образуется при окислении оксида азота (II) кислородом или озоном:
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например , при действии концентрированной азотной кислоты на медь:
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например , при разложении нитрата серебра:
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические свойства
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
При нагревании выделяется кислород:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
🎥 Видео
Основы химической кинетикиСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Составление уравнений реакций (по валентности). 8 класс.Скачать

Составляем кинетические уравненияСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Скорость химических реакций. 9 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Уравнения реакцииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Химические свойства алканов. Реакция окисления алканов (механизм + сложные случаи). ЕГЭ по химии.Скачать










 .
. .
.

 .
.