Химия | 5 — 9 классы
Выделение газа происходит в результате реакции серной кислоты с 1) гидроксид калия 2) карбонат натрия 3) оксидом калия 4) нитратов свинца.
Правильный ответ 2) карбонат натрия.
- Напишите уравнение осуществимых реакций :а)Нитрат алюминия и фосфатом натрияб)Сульфидом калия и соляной кислотойв)Сульфидом калия и нитратом натрияг)Сульфатом калия и нитратом свинца (lll)д)Соляной ки?
- Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно : оксид калия, оксид фосфора(V), гидроксид бария, серная кислота, иодид калия, нитрат свинца(II)?
- Как написать молекулярные и ионные уравнения реакциимежду растворами :серной кислоты и хлорида бариягидроксида калия и фосфорной кислотыкарбоната натрия и нитрата свинца (2)?
- Напишите уравнение осуществимых реакции между : 1)соляной кислотой и гидроксидом калия2)гидроксидом цинка и азотной кислотой3)оксидом магния и серной кислотой4)хлоридом серебра и иодом свинца( / / )5)?
- Составьте молекулярные и ионные уравнения :1) Силикат натрия и серная кислота2) Карбонат натрия и хлорид кальция3) Гидроксид калия и нитрат свинца?
- Какая реакция невозможна ?
- Реакция идет до конца в результате образования осадка между электронами ?
- 352. В водном растворе возможна реакция А) сульфат железа(II) + гидроксид калия Б) нитрат аммония + соляная кислота B) дигидрофосфат калия + гидроксид натрия Г) сульфат алюминия + нитрат бария Д) карб?
- 1. Гидроксид железа(3) образуется при взаимодействии : а)хлорид железа(2) и гидроксид калия б)сульфат железа(3)и гидроксид натрия в)оксид железа(3)и серной кислоты г)нитрат железа(3) и гидроксид лития?
- С выделением газа протекает реакция между А?
- Выделееие газа.происходит в результате реакции.серной кислоты с. Написать.уравнение 1.SO 2.HNO 3.KCL 4.HBr
- Ответы
- Серная кислота
- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Серная кислота
- 📽️ Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнение осуществимых реакций :а)Нитрат алюминия и фосфатом натрияб)Сульфидом калия и соляной кислотойв)Сульфидом калия и нитратом натрияг)Сульфатом калия и нитратом свинца (lll)д)Соляной ки?
Напишите уравнение осуществимых реакций :
а)Нитрат алюминия и фосфатом натрия
б)Сульфидом калия и соляной кислотой
в)Сульфидом калия и нитратом натрия
г)Сульфатом калия и нитратом свинца (lll)
д)Соляной кислотой и гидроксидом калия
е)Гидроксидом цинка и азотной кислотой
ж)Оксидом магния и серной кислотой
з)Хлоридом серебра и иодидом свинца (ll) Составьте ионные уравнения.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно : оксид калия, оксид фосфора(V), гидроксид бария, серная кислота, иодид калия, нитрат свинца(II)?
Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно : оксид калия, оксид фосфора(V), гидроксид бария, серная кислота, иодид калия, нитрат свинца(II).
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Как написать молекулярные и ионные уравнения реакциимежду растворами :серной кислоты и хлорида бариягидроксида калия и фосфорной кислотыкарбоната натрия и нитрата свинца (2)?
Как написать молекулярные и ионные уравнения реакции
серной кислоты и хлорида бария
гидроксида калия и фосфорной кислоты
карбоната натрия и нитрата свинца (2).
Видео:Химия 9 класс (Урок№12 - Оксид серы (IV). Сернистая кислота и ее соли.)Скачать

Напишите уравнение осуществимых реакции между : 1)соляной кислотой и гидроксидом калия2)гидроксидом цинка и азотной кислотой3)оксидом магния и серной кислотой4)хлоридом серебра и иодом свинца( / / )5)?
Напишите уравнение осуществимых реакции между : 1)соляной кислотой и гидроксидом калия
2)гидроксидом цинка и азотной кислотой
3)оксидом магния и серной кислотой
4)хлоридом серебра и иодом свинца( / / )
5)серной кислотой и сульфитом натрия
6)серной кислотой и нитратом бария
7)азотной кислотой и гидроксидом калия
8)сульфатом натрия и нитратом меди( / / )
9)оксидом свинца( / / ) и азотной кислотой
10)гидроксидом меди( / / ) и серной кислотой
11)фосфатом цинка и гидроксидом свинца( / / )
Составьте ионное уравнение.
Определите форму связывания ионов в результате протекания возможных реакций.
Видео:Выделение газов — признак протекания реакцииСкачать
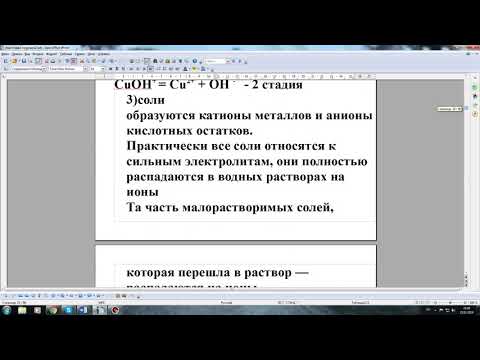
Составьте молекулярные и ионные уравнения :1) Силикат натрия и серная кислота2) Карбонат натрия и хлорид кальция3) Гидроксид калия и нитрат свинца?
Составьте молекулярные и ионные уравнения :
1) Силикат натрия и серная кислота
2) Карбонат натрия и хлорид кальция
3) Гидроксид калия и нитрат свинца.
Видео:Особенности серной и азотной кислот | Химия ЕГЭ, ЦТСкачать

Какая реакция невозможна ?
Какая реакция невозможна ?
Напишите молекулярные и ионные уравнения взаимодействия фосфорной кислоты с : а) гидроксидом калия б) силикатом калия в) оксидом натрия г) свинцом д карбонатом калия.
Видео:Реакции ионного обмена. 9 класс.Скачать

Реакция идет до конца в результате образования осадка между электронами ?
Реакция идет до конца в результате образования осадка между электронами ?
1) гидроксидом калия и нитратом натрия 2) карбонат натрия и соляной кислотой 3) нитратом меди (II) и гидроксидом натрия 4) гидроксидом меди (II) и серной кислотой.
Видео:Все типы 7 задания ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

352. В водном растворе возможна реакция А) сульфат железа(II) + гидроксид калия Б) нитрат аммония + соляная кислота B) дигидрофосфат калия + гидроксид натрия Г) сульфат алюминия + нитрат бария Д) карб?
352. В водном растворе возможна реакция А) сульфат железа(II) + гидроксид калия Б) нитрат аммония + соляная кислота B) дигидрофосфат калия + гидроксид натрия Г) сульфат алюминия + нитрат бария Д) карбонат натрия + гидроксид лития Е) нитрат калия + сульфат натрия 357.
В водном растворе с выделением газообразного продукта протекает реакция А) хлорид алюминия + гидроксид калия Б) нитрат натрия + сульфит калия B) сульфид калия + соляная кислота Г) хлорид аммония + гидроксид натрия Д) карбонат кальция + азотная кислота Е) сульфат натрия + серная кислота 362.
В водном растворе с выпадением осадка протекает реакция А) хлорид алюминия + нитрат серебра Б) карбонат натрия + гидроксид кальция B) нитрат магния + соляная кислота Г) сульфат калия + гидроксид натрия Д) карбонат калия + фосфорная кислота Е) сульфат натрия + нитрат бария 367.
В водном растворе с образованием воды протекает реакция А) сернистая кислота + гидроксид калия Б) азотная кислота + ортофосфат калия B) гидроксид натрия + соляная кислота Г) сульфат калия + гидроксид алюминия Д) гидроксид бария + азотная кислота Е) сульфат натрия + хлорид бария 372.
В водном растворе не возможны реакции между следующими реагентами А) нитрат железа(III) + хлорид калия Б) сульфат магния + нитрат калия B) сульфат калия + соляная кислота Г) сульфат железа(III) + гидроксид натрия Д) карбонат калия + азотная кислота Е) нитрат серебра + хлорид натрия.
Видео:Решение цепочек превращений по химииСкачать

1. Гидроксид железа(3) образуется при взаимодействии : а)хлорид железа(2) и гидроксид калия б)сульфат железа(3)и гидроксид натрия в)оксид железа(3)и серной кислоты г)нитрат железа(3) и гидроксид лития?
1. Гидроксид железа(3) образуется при взаимодействии : а)хлорид железа(2) и гидроксид калия б)сульфат железа(3)и гидроксид натрия в)оксид железа(3)и серной кислоты г)нитрат железа(3) и гидроксид лития 2.
Гидроксид натрия образуется при взаимодействии : а)карбонат натрия и гидроксид калия б)карбонат натрия и гидроксид кальция в)оксид натрия и вода г)нитрат натрия и гидроксид кальция 3.
Реакции нейтрализации протекают при взаимодействии : а)карбонат железа(2) и соляная кислота б)магний и серная кислота в)гидроксид калия и сероводородная кислота г)гидроксид магния и серная кислота.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

С выделением газа протекает реакция между А?
С выделением газа протекает реакция между А.
Силикатом калия и гидроксидом кальция Б.
Карбонатом кальция и уксусной кислотой В.
Нитратом свинца и оксидом бария Г.
Сульфатом калия и хлоридом магния.
На этой странице сайта вы найдете ответы на вопрос Выделение газа происходит в результате реакции серной кислоты с 1) гидроксид калия 2) карбонат натрия 3) оксидом калия 4) нитратов свинца?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 5 — 9 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Видео:Разбор всех типов 29-30 заданий из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Выделееие газа.происходит в результате реакции.серной кислоты с. Написать.уравнение
1.SO 2.HNO 3.KCL 4.HBr
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Ответы
когда кислород впервые появился на земле, он уничтожил 99 % всей жизни на планете.
вся зелень планеты за один только год образует приблизительно 3 триллиона тонн кислорода.
в год одно дерево может вырабатывать до 125 кг. кислорода. этого вполне достаточно, чтобы обеспечить свежим воздухом 2-х человек.
мозг может жить в течение 4-6 минут без кислорода, а затем начинает умирать. нехватка кислорода от 5 до 10 минут может к необратимым повреждениям мозга.
ни один процесс в организме не может обойтись без серы. она является одним из главных составляющих всех существующих белков. функции, которые возлагаются на работу серы в человеческом организме огромны. начиная от стабильной работы нервных клеток, уравновешивания сахара в крови и общего повышения иммунитета, заканчивая ранозаживляющими и противовоспалительными действиями.
«чудо»-сера входит в состав лекарств и используется в чистом виде для лечения.
кому-то покажется странным, а кто-то об этом давным давно знает, однако сера содержится в массе продуктов, которые мы используем ежедневно, даже на подозревая об этом. к этому числу относятся: все бобовые, злаки и крупы, а также хлебобулочные изделия.
вроде бы надеюсь что смогла
кошки, сыночек, мурмурка, хвостик, шкурка, мурлетты
1) где большинство фабрик и заводов, расположенных в шотландии? 2) какая большая река протекает по всей стране? 3) города находятся далеко друг от друга, не так ли? 4) какой город имеет большой порт? 5) какой из двух городов имеет более долгую ?
2.eden flowed through the river water the garden, which is then divided into four smaller rivers.
the first of these was called the pishon and flowed around the country havilah.the second river is gihon and flowed around the entire country of ethiopia. the third river is the tigris and flows to the east of assyria. the fourth river is euphrates.
4.the ferry to the island of mull from the port of oban
during the estate monarchy in england had the institution that hasintegral and with time more and more significant part of the publicorganizations in the country — a representative parliament. his appearance hewas due both to the 13-established 14vv. political formsrelationship classes in england with the royal power and featuresthe situation in the power crisis of the second half 13th century. considerable importance inthis long process was played by the highest tradition of attracting crownnobility to public affairs, dating back to the universe of the monarchy.
на счёт 5-ого я не уверена((
1. my father said that we might buy a car the following year.
2. my mum says that she likes travelling from time to time
3. my father said that it would rain that day.
4. my sister asked what was on that night.
5. the teacher asked not to be late.
6. the doctor recommended to give up fast food.
7. she asked if i was a good reader.
8. our fans asked us to win the game.
9. the teacher asked not to speak so loudly.
10. betty asks mum to give her some bread.
11. she asked me where i would spend my holidays.
12.nick says that he likes his little sister.
13. she said that he had gone to school the day before yesterday.
14. he asked why my sister was sad that day.
Видео:Получение водорода действием разбавленной серной кислоты на цинкСкачать

Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:Реакции ионного обмена. 9 класс.Скачать

Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
- Кислотные свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
📽️ Видео
Решение задач на ОЛЕУМ (H2SO4+SO3).Скачать

Соединения серы. 9 класс.Скачать

Взаимодействие H2SO4 и HNO3 с металлами. Характерные свойства кислот. ЕГЭ по ХимииСкачать

Решаю вариант СтатГрад №3 по химии 06.02.23 | Вариант № 1 | Екатерина СтрогановаСкачать

Практическая работа №5. Получение углекислого газа, качественная реакция на карбонат ионыСкачать

Разбор Варианта №1 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать





















