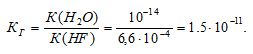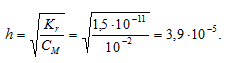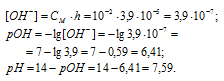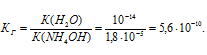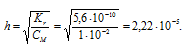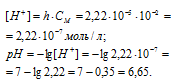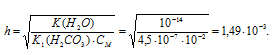Материалы портала onx.distant.ru
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
- Теоретическое введение
- Примеры обратимого гидролиза
- Случаи необратимого гидролиза
- Константа и степень гидролиза
- Примеры решения задач
- Задачи для самостоятельного решения
- Вычисление константы гидролиза, определение степени гидролиза соли
- Гидролиз солей
- Степень гидролиза
- Константа гидролиза
- 1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
- 2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
- 3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
- 4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
- Совместный гидролиз солей
- Влияние различных факторов на протекание гидролиза
- 🔥 Видео
Видео:Константа гидролиза и pH водного раствора солиСкачать

Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Видео:Степень гидролиза и как её рассчитатьСкачать

Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например , CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO3 2– + HOH ↔ HCO3 – + OH – ,
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например , NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
FeCl3 + HOH ↔ FeOHCl2 + HCl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H + ;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H + ;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например , CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25 о С примерно равны (Кд(СH3COOH) = 1,75·10 –5 , Кд(NH3·H2О) = 1,76·10 –5 ), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10 –4 ) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Видео:Гидролиз солей. 9 класс.Скачать

Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например , сульфид алюминия:
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg 2+ + HOH ↔ MgOH + + H + ,
CO3 2– + HOH ↔ HCO3 – + OH –
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.
При сливании растворов соды и солей Fe 2+ , Ca 2+ , Sr 2+ , Ba 2+ реакции протекают следующим образом:
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl 3+ , Сr 3+ и Fe 3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
Следует отметить, что катион Fe 3+ производит окисляющее действие на анион S 2- . В результате протекает реакция:
2Fe 3+ + S 2- = 2Fe 2+ + S о .
Например , хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10 -5 .
Решение.

[Н + ] = 2,4·10 –4× 0,01 = 2,4× 10 –6 М.
рН = — lg 2,4× 10 –6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10 –4 .
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО — + Н2О ↔ НСООН + ОН — .
Поскольку [НСООН] = [ОН – ] и [НСОО – ]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

[Н + ] = 10 –14 ÷1,06× 10 –6 = 9,4·10 –9 М
рН = — lg 9,4× 10 –9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10 –3 %.
Решение.
[ОН – ] = 0,006× 7× 10 –5 = 4,2× 10 –7 М.
[Н + ] = 10 –14 :4,2× 10 –7 = 2,4× 10 –8 М.
рН = — lg 2,4× 10 –8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10 — 3 , Kд.2 = 6,34× 10 — 8 , Kд.3 = 4,40× 10 — 13 .
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Следует обратить внимание на выбор “нужной” величины Кд.
Kдисс.2 = 6,34·10 — 8
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.

поскольку [HPO4 2- ] = [OH — ].
рОН = –lg 4,76× 10 — 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
Видео:Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей
В общем случае, гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Характеризовать гидролиз количественно позволяют такие величины, как Степень гидролиза и константа гидролиза.
Видео:Гидролиз солей. Практическая часть. 10 класс.Скачать

Степень гидролиза
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ.
Обычно, ее обозначают через hгидр (или α ):
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
тогда соотношение для константы гидролиза соли Kг будет иметь такой вид:
По величине константы гидролиза можно судить о полноте гидролиза:
чем больше значение константы гидролиза Kг, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Где С – концентрация соли в растворе,
h- степень гидролиза.
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Зная, константу гидролиза, можно определить pH среды:
Концентрация образовавшейся кислоты равна концентрации гидроксид ионов, тогда
Kг = [OH — ] 2 /[MA]
Используя это выражение можно вычислить pH раствора
[OH — ] = (Kг·[MA]) 1/2 моль/л
[H + ] = 10 -14 /[OH — ] моль/л
pH = -lg[H + ]
Гидролиз солей можно представить, как поляризационное взаимодействие ионов и их гидратной оболочки.
Гидролиз протекает тем полнее, сильнее поляризующее действие ионов.
Возможны 4 случая протекания гидролиза:
1. Соли, образованные сильным основанием и сильной кислотой (гидролиз не протекает)
Соли, образованные сильным основанием и сильной кислотой не подвергаются гидролизу.
В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7):
NaCl ↔ Na + + Cl —
Na + + HOH ↔ реакция практически не протекает
Cl — + HOH ↔ реакция практически не протекает
2. Соли, образованные слабым основанием и сильной кислотой (гидролиз по катиону)
Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7:
NH4Cl ↔ NH4 + + Cl —
NH4 + + HOH ↔ NH4OH + H +
Cl — + HOH ↔ реакция практически не идет
NH4Cl+ HOH ↔ NH4OH + HCl
Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением:
Понятно, что чем меньше сила основания, тем в большей степени протекает гидролиз.
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато:
FeCl2 ↔ Fe 2+ + 2Cl —
| I ступень | Fe 2+ + HOH ↔ (FeOH) + + H + FeCl2 + HOH ↔ (FeOH)Cl + HCl |
| II ступень | (FeOH) + + HOH ↔ Fe(OH)2 + H + (FeOH)Cl + HOH↔ Fe(OH)2 + HCl |
Константа гидролиза по первой ступени связана с константой диссоциации основания по второй ступени, а константа гидролиза по второй ступени — с константой диссоциации основания по первой ступени:
Поскольку первая константа диссоциации кислоты всегда больше второй, то первая константа гидролиза всегда больше, чем константа вторая гидролиза, так как первая константа диссоциации основания всегда больше второй
Отсюда следует, что по первой ступени, гидролиз всегда будет протекать в большей степени, чем по второй. Этому также способствуют ионы, которые образуются при гидролизе по первой ступени, они приводят подавлению гидролиза по второй ступени, смещая равновесие влево.
Сравнивая величины Kг и Kосн можно качественно определить pH среды.
Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
3. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону)
Такое соединение в растворе образует слабополяризующие катионы и среднеполяризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH > 7:
NaCN ↔ Na + + CN —
CN — + HOH ↔ HCN + OH —
Na + + HOH ↔ реакция практически не идет
NaCN + HOH ↔ HCN + NaOH
Константа гидролиза и константа диссоциации кислоты связаны зависимостью:
Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
Возможен гидролиз соли, образованной слабой многоосновной кислотой и сильным основанием. В этом случае гидролиз протекает по ступеням:
| I ступень | SO3 2- + HOH ↔ HSO3 — + OH — Na2SO3 + HOH ↔ NaHSO3 + NaOH |
| II ступень | HSO3 — + HOH ↔ H2SO3 + OH — NaHSO3 + HOH ↔ H2SO3 + NaOH |
В этом случае, константа гидролиза по первой и второй ступеням определяется соотношениями:
Следует помнить, что гидролиз по второй ступени протекает в ничтожно малой степени.
Сравнивая величины Kг и Kк-ты, можно качественно определить pH среды. Так, если Kг намного больше Kк-ты, то среда сильнощелочная, при Kг намного меньшей Kк-ты — среда слабощелочная, а если Kг и Kосн сопоставимы, то — среднещелочная.
4. Соли, образованные слабым основанием и слабой кислотой (гидролиз и по катиону и по аниону)
Такие соли, при ионизации образуют среднеполяризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону.
При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Такого типа гидролиз протекает особо полно, обычно с образованием малорастворимого вещества:
Константу гидролиза можно рассчитать, зная константы диссоциации кислоты и основания с помощью следующего соотношения:
Совместный гидролиз солей
Совместный гидролиз протекает при взаимодействии растворов двух солей, одна из которых образована слабым основанием и сильной кислотой, а вторая напротив сильным основанием и слабой кислотой. Т.е. одна соль гидролизуется по катиону, а другая – по аниону.
В таких случаях гидролиз взаимно усиливается.
Например, рассмотрим совместный гидролиз растворов солей хлорида алюминия и сульфида натрия:
При гидролизе хлорида алюминия соль гидролизуется по катиону:
AlCl3 ↔ Al 3+ + 3Cl —
Al 3+ + 3HOH ↔ Al(OH)3 + 3H +
При гидролизе сульфида натрия соль гидролизуется по аниону:
Na2S ↔ 2Na + + S 2-
S 2- + 2HOH ↔ H2S + 2OH —
Суммарная реакция гидролиза:
Влияние различных факторов на протекание гидролиза
- Природа соли. Это видно из выражения для константы гидролиза.
- Концентрация соли и продуктов реакции. В соответствии с принципом Ле-Шателье, равновесие должно смещаться вправо, при этом увеличивается концентрация ионов водорода (или гидроксид-ионов), что приводит к уменьшению степени гидролиза.
- Температура. Известно, что гидролиз притекает с поглощением теплоты (эндотермическая реакция), поэтому согласно принципу Ле Шателье, при увеличении температуры равновесие сдвигается вправо, что ведет к росту степени гидролиза.
В разделе Задачи к разделу Гидролиз солей приведены задачи на определение степени и константы гидролиза, составление уравнений гидролиза, определение рН среды и др.
🔥 Видео
Кислотно-основные равновесия в водном растворе. Гидролиз солей.Скачать

Вычисление рН в растворах солейСкачать

Закон разбавления ОствальдаСкачать

Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

№ 76. Неорганическая химия. Тема 9. Гидролиз солей. Часть 5. Константа гидролиза солейСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

pH раствора солиСкачать

11 класс. Гидролиз солей.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия 8 класс: Гидролиз солейСкачать