При обучении школьников способам решения задач очень большое значение придаю применению алгоритмов. Я считаю, что вначале нужно уверенно овладеть небольшим числом стандартных приемов, получить представление о возможных типах задач. Это позволит ученику выйти на творческий уровень в своем дальнейшем химическом образовании и самообразовании.
Одно из заданий высокого уровня сложности (оно входит в третью часть экзаменационной работы – задание С4) проверяет умение производить расчеты по уравнениям реакций, происходящих в растворах.
В учебной литературе недостаточно подробно объясняются особенности решения таких задач. Поэтому мы с учениками вначале разбираем все моменты, на которые нужно обратить внимание, записываем алгоритмы в общем виде, рассматриваем решение задач каждого типа, затем отрабатываем умения на самостоятельном решении целого ряда подобных задач.
Прежде всего ученик должен усвоить понятие о массовой доле растворенного вещества, или, иначе, процентной концентрации раствора. Эта величина показывает отношение массы растворенного вещества к массе раствора:

mр.в-во = mр-р•
mр-р = mр.в-во / 
Если в условии задачи указан объем раствора с определенной плотностью, то прежде всего находят массу раствора:
mр-р = Vр-р•
затем – массу растворенного вещества:
mр.в-во = mр-р•
Количество вещества находят по массе растворенного вещества:

Рассмотрим некоторые типы задач с расчетами по уравнениям реакций, происходящих в растворах.
• Нахождение массовых долей веществ в растворе после реакции.
При решении таких задач прежде всего нужно найти количества вещества реагентов. Если задача на избыток и недостаток, то количества вещества продуктов реакции находят по веществу, которое дано в недостатке.
Один из важных моментов – это нахождение массы раствора после реакции (массы полученного раствора, mр-р получ). Если какое-либо вещество взаимодействует с веществом, находящимся в растворе, то складывают массу вещества и массу раствора; в случае, когда оба реагирующих вещества даны в виде растворов, складывают массы двух растворов. Если в результате реакции образуется осадок или газ, то из полученной суммы вычитают массу вещества, ушедшего из раствора в виде осадка или газа:
При решении задач на избыток и недостаток нужно помнить о том, что в растворе после реакции будет находиться в растворенном виде не только продукт реакции, но и вещество, которое было дано в избытке.
Чтобы найти количество вещества, которое не прореагировало – избытка, нужно от исходного количества вещества отнять количество прореагировавшего вещества:



Затем найти его массу и массовую долю в растворе, полученном после реакции.
Задача 1. 4,8 г магния растворили в 200 мл 12%-го раствора серной кислоты (


 р.в-во(MgSO4 ).
р.в-во(MgSO4 ).
mр-р(H2SO4) = Vр-р• 
mр.в-во(H2SO4) = mр-р•

В недостатке – Mg. Следовательно:


mр.в-во(MgSO4) = M• 
m(H2) = M• 

О т в е т. 
Задача 2. Смешали 250 г раствора сульфата железа(III) с концентрацией 8 % и 50 г раствора гидроксида натрия с концентрацией 30 %. Найти концентрацию веществ в получившемся растворе.


 р.в-во получ.
р.в-во получ.mр.в-во(Fe2(SO4)3) = mр-р•

mр.в-во(NaOH) = mр-р•







m(NaOH) = M• 
m(Na2SO4) = M• 
m(Fe(OH)3) = M• 


О т в е т. 

Задача 3. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (
О т в е т. 
Задача 4. 5,6 г железа растворили в 100 мл 10%-го раствора соляной кислоты (
О т в е т. 
Задача 5. 5,6 г железа растворили в 200 мл раствора соляной кислоты (
О т в е т. 
Задача 6. Смешали 110,4 г раствора карбоната калия с концентрацией 25 % и 111 г раствора хлорида кальция с концентрацией 20 %. Найти концентрацию вещества в полученном растворе.
О т в е т. 
Задача 7. Смешали 320 г раствора сульфата меди(II) с концентрацией 5 % и 120 г раствора гидроксида натрия с концентрацией 10 %. Найти концентрации веществ в полученном растворе.
О т в е т. 

• Более сложными являются задачи на нахождение массы (или объема) вещества, которое нужно добавить к раствору другого вещества для того, чтобы его концентрация изменилась в результате произошедшей реакции.
В этом случае алгоритм решения следующий:
1) нужно обозначить за x количество добавленного вещества – реагента;
2) выразить через х количества прореагировавшего с реагентом вещества и полученного в результате реакции газа или осадка;
3) найти количество растворенного вещества в исходном растворе и его количество, оставшееся после реакции (


4) выразить через х массу оставшегося в растворе вещества;
5) найти массу раствора, полученного после реакции:
6) все данные подставить в формулу:

7) найти количество вещества реагента, его массу или объем.
Задача 8. Найти массу карбоната кальция, которую следует добавить к 600 г раствора азотной кислоты с массовой долей 31,5 %, чтобы массовая доля кислоты уменьшилась до 10,5 %.





m(CaCO3) = M• 
mр.в-во1(HNO3) = mр-р1•




mоставш(HNO3) = М• 

0,105 = (189 – 126х) / (600 + 56х),
х = 0,955 моль, 
m(CaCO3) = M• 
О т в е т. m(CaCO3) = 95,5 г.
Задача 9. Найти массу кристаллогидрата CaCl2•6H2O, которую необходимо добавить к 47 мл 25%-го раствора карбоната натрия (



Найти: m(CaCl2•6H2O).




m(CaCl2•6H2O) = M• 
m(CaCO3) = M• 
mр-р1(Na2CO3) = Vр-р1•
mр.в-во1(Na2CO3) = mр-р1•




mоставш(Na2CO3) = M• 
219x + 50,76 – 100x = 50,76 + 119x,

0,1 = 12,69 – 106х / 50,76 + 119х,
m(CaCl2•6H2O) = М• 
Задача 10. Какой объем 30%-го раствора аммиака (

Задача 11. Какой объем углекислого газа нужно добавить к 100 мл 20%-го раствора гидроксида натрия (
Задача 12. Найти объем раствора соляной кислоты (
О т в е т. Vр-р(HCl) = 135,6 мл.
• Внимание: растворенное вещество – реагент!
При решении задач на растворы нужно помнить о том, что при обычных условиях с водой реагируют следующие вещества:
1) щелочные и щелочно-земельные металлы, например:
2Na + 2H2O = 2NaOH + H2
2) оксиды щелочных и щелочно-земельных металлов, например:
3) оксиды неметаллов, например:
4) многие бинарные соединения – гидриды, карбиды, нитриды и другие, например:
KН + Н2О = KОН + Н2
Растворение вещества-реагента в воде.
Растворенным веществом в данном случае будет продукт взаимодействия вещества-реагента с водой. Масса раствора будет складываться из массы реагента и массы воды:
Если в результате реакции выделился газ, то
Задача 13. В каком объеме воды нужно растворить 11,2 л оксида серы(IV), чтобы получить раствор сернистой кислоты с массовой долей 1 %?



mр.в-во(H2SO3) = M• 
mр-р(H2SO3) = mр.в-во(H2SO3) / 
m(SO2) = M• 
m(H2O) = 4100 (г) – 32 (г) = 4068 г,
V(H2O) = m/ 
О т в е т. V(H2O) = 4068 мл.
Задачи, в которых неизвестна масса вещества-реагента, необходимого для образования раствора с определенной концентрацией.
Алгоритм решения следующий:
1) принять количество растворенного реагента за х моль;
2) согласно уравнению реакции выразить через х количества продуктов реакции;
3) найти через х массы реагента и продуктов реакции;
4) найти массу раствора;
5) подставить все данные в формулу для расчета массовой доли вещества в растворе:

Задача 14. Найти массу гидрида лития, которую нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида лития 5 %.

Пусть 
тогда 

m(LiH) = M• 
m(LiOH) = M• 
m(H2) = M• 
m(H2O) = V• 

х = 0,21, 
m(LiH) = M• 
О т в е т. m(LiH) = 1,7 г.
Растворение вещества-реагента в растворе.
В этом случае растворяемое вещество реагирует с водой, которая присутствует в растворе. Масса растворенного вещества во втором растворе складывается из массы вещества в первом растворе и массы вещества – продукта реакции:
mр.в-во1 = mр-р1•

Задача 15. К 200 г 10%-го раствора ортофосфорной кислоты добавили 28,4 г фосфорного ангидрида. Найти массовую долю кислоты в получившемся растворе.

m(P2O5) = 28,4 г.
 р.в-во2(Н3РО4).
р.в-во2(Н3РО4).

mпрод(Н3РО4) = М• 
mр.в-во1(Н3РО4) = mр-р1•

О т в е т: 
Задача 16. Найти массу фосфорного ангидрида, которую необходимо добавить к 70 г 10%-го раствора ортофосфорной кислоты, чтобы получить 40%-й раствор.


Пусть 
тогда 
mпрод(Н3РО4) = М• 
mреаг(Р2О5) = М• 
mр.в-во1(Н3РО4) = mр-р1•

х = 0,15, 
m(P2O5) = M• 
Задача 17. В 240 мл воды опустили 69 г натрия. Найти массовую долю продукта в растворе.
О т в е т. 
Задача 18. Найти массовую долю кислоты в растворе, полученном при растворении 33,6 л сернистого газа в 320 г 5%-го раствора сернистой кислоты.
О т в е т. 
Задача 19. Какую массу оксида серы(VI) нужно растворить в 150 мл воды, чтобы получить 60%-й раствор серной кислоты?
Задача 20. Найти массу оксида серы(VI), которую необходимо растворить в 99 г 40%-й серной кислоты, чтобы получить 80%-й раствор.
Задача 21. Какую массу оксида фосфора(V) нужно растворить в 120 г воды, чтобы получить 40%-й раствор ортофосфорной кислоты?
Задача 22. К 180 г 50%-го раствора ортофосфорной кислоты добавили 42,6 г оксида фосфора(V). Найти массовую долю кислоты в полученном растворе.
О т в е т. 
Задача 23. В 20 г воды растворили 3,5 г оксида натрия. Вычислите массовую долю растворенного вещества.
О т в е т. 
Задача 24. К 120 г 8%-го раствора гидроксида натрия добавили 18,6 г оксида натрия. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
О т в е т. 
Задача 25. Найти массу оксида серы(VI), которую нужно добавить к 2 л 8%-го раствора серной кислоты (
Задача 26. Какую массу фосфора необходимо сжечь в кислороде, чтобы, растворив полученный оксид в 1000 г раствора ортофосфорной кислоты с массовой долей 50 %, получить раствор этой кислоты с массовой долей 75 %?
О т в е т. m(P) = 173,2 г.
Задача 27. Какую массу натрия необходимо растворить в 120 мл воды для получения раствора щелочи с массовой долей 18 %?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
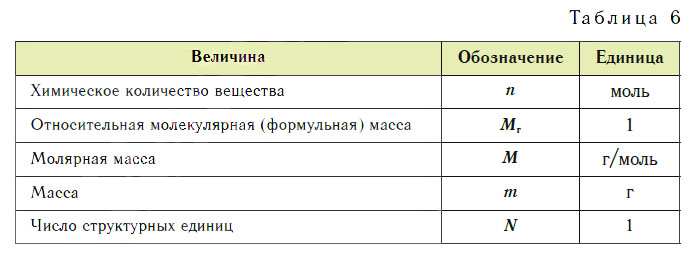
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Урок химии 10 класса на тему «Вычисления по уравнениям реакций, протекающих в растворах»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Тема: Вычисления по уравнениям реакций, протекающих в растворах
Цель: формировать умение решать расчетные задачи по уравнениям реакций, протекающих в растворах.
-создать условия для закрепления и развития умений решения расчетных задач изученных типов ;
-совершенствовать умения записывать уравнения химических реакций, решать цепочки химических превращений;
— обобщение и систематизация изученного материала по темам «Спирты. Альдегиды. Фенолы. Карбоновые кислоты»
-содействовать формированию коммуникативных навыков и развитию познавательного интереса к возможностям практического применения знаний
Тип урока : комбинированный
Приветствие, проверка готовности к уроку
2.Проверка домашнего задания (устный опрос у доски)
3.Целеполагание и актуализация знаний:
-Объявление темы и постановка цели урока;
-вспомните формулы, которые использовались вами при решении расчетных задач по теме «растворы» (запись формул на доске, их фронтальное обсуждение)
4.Этап формирования умений решения расчетных задач (самостоятельная групповая работа по решению практико-ориентированных задач)
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
5.Обобщение и систематизация (групповая работа)
Выполнение задания №2
6.Домашнее задание: §36, №1,3
7.Подведение итогов. Рефлексия
Тема: Вычисления по уравнениям реакций, протекающих в растворах
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
Тема: Вычисления по уравнениям реакций, протекающих в растворах
№1. Этиленгликоль хорошо растворяется в воде, при этом он сильно понижает температуру замерзания воды (60%-й раствор этиленгликоля понижает температуру замерзания до -49 0 С), что позволяет использовать его в качестве жидкости для очистки стекол автомобилей. Определите, какие массы этиленгликоля и воды понадобятся для приготовления 8кг данного раствора. Чему будет равна молярная концентрация этого раствора, если его плотность составляет 1,004г/см 3
№2 . Многие считают, что небольшие количества алкоголя не вредят. Но это не так. Поскольку этанол легко растворяется в воде, он сразу же поглощается пищеварительными органами и разносится кровью по всему телу (в том числе и в ткани мозга). Около 90% этанола задерживается в печени. Определите, какое количество этанола можно получить при сбраживании 20кг 70% раствора глюкозы.
№3 .Раствор с массовой долей тринитроглицерина 1% используется в медицине в качестве средства для расширения сосудов сердца. Определите, какие массы глицерина и азотной кислоты понадобятся для получения 500г этого раствора.
№4 .Динамит—это взрывчатая смесь тринитроглицерина с кизельгуром, была изобретена шведским химиком А.Нобелем. Динамит взрывается с выделением большого количества газов, вызывающих сильную ударную волну, и большого количества теплоты. Определите массу тринитроглицерина, которую можно получить из 2т 60% раствора глицерина, если выход продукта составляет 98%.
№5. При уксуснокислом брожении этанола под действием ферментов образуется уксусная кислота, которая затем используется в пищевых целях (столовый уксус—9%-й раствор уксусной кислоты в воде). Рассчитайте, какую массу уксусной кислоты можно получить из 0,5кг раствора с массовой долей этанола 70%, если выход продукта реакции равен 85%.
📺 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Карбоновые кислоты. Тема 29. Вычисления по уравнениям реакций, протекающих в растворахСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

10 класс § 5 "Расчеты по уравнениям химических реакций"Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Химия. 10 класс. Расчеты по уравнениям химических реакций /04.11.2020/Скачать

Задачи на "избыток" и "недостаток". 1 часть. 10 класс.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Составление уравнений реакций. 1 часть. 10 класс.Скачать

Вычисления по уравнения химических реакций, протекающих в водных растворахСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать